CHEMIA FIZYCZNA
Ćwiczenie 9
Wyznaczanie iloczynu rozpuszczalności chlorku srebra metodą potencjometryczną
CZĘŚĆ TEORETYCZNA
Iloczyn rozpuszczalności AgCl wyznacza się na podstawie pomiaru siły elektromotorycznej ogniwa o następującej budowie:
Ag | AgCl | Cl- (c1) | KNO3 (nas.) | Ag+ (c2) | Ag (1)
Na prawej elektrodzie zachodzi reakcja redukcji:
Ag+ + e = Ag (2)
Potencjał tej elektrody opisany jest równaniem:
![]()
(3)
Lewa elektroda jest elektrodą II rodzaju, której potencjał zależy od stężenia kationu metalu tworzącego elektrodę. Ponieważ kation ten tworzy trudno rozpuszczalną sól z anionami znajdującymi się w roztworze, to jego stężenie jest zależne od stężenia anionów. Dla elektrody tej można zapisać równanie reakcji:
Ag + Cl- = AgCl + 1e (4)
Potencjał Nernsta dla tej reakcji opisuje równanie:
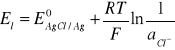
(5)
Elektrodę drugiego rodzaju można rozpatrywać również jako elektrodę pierwszego rodzaju, gdzie stężenie jonów Ag+ jest określone przez iloczyn rozpuszczalności KSO i stężenie jonów Cl-:
(6)
Równowagę tę opisuje iloczyn rozpuszczalności KS0:
![]()
(7)
Potencjał lewej elektrody można zapisać więc w postaci:
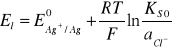
(8)
Korzystając z równań 3 i 8 można zapisać równanie opisujące siłę elektromotoryczną analizowanego ogniwa:
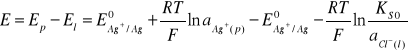
(8)
Po uproszczeniu i przekształceniu otrzymujemy:
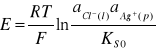
(9)
![]()
(10)
Dla aktywności jonów Ag+ i Cl- równych jedności siła elektromotoryczna ogniwa E będzie miała wartość standardowej siły elektromotorycznej E0:
![]()
(11)
Jeżeli w równaniu 10 aktywności zastąpimy iloczynem stężenia i współczynnika aktywności, to otrzymamy:
![]()
(12)
Równanie 12 możemy zapisać w postaci:
![]()
(13)
Równanie to stanowi podstawę do wyznaczania iloczynu rozpuszczalności na podstawie pomiaru siły elektromotorycznej ogniwa. Można zauważyć, że przy zmniejszających się stężeniach jonów Ag+ i Cl-, współczynniki aktywności f zbliżają się do wartości 1, a tym samym człon:
![]()
(14)
zbliża się do wartości 0. Wynika to z równania Debye'a-H*ckela:
![]()
(15)
gdzie: z+, z- - ładunki elektryczne kationu i anionu,
- moc jonowa roztworu,
które opisuje zależność pomiędzy współczynnikami aktywności jonów i siłą jonową roztworu, obliczaną na podstawie równania:
![]()
(16)
gdzie: ci, zi - stężenie i ładunek jonu i,
Po połączeniu równań 15 i 16 i wstawieniu ich dla obu roztworów do równania 13 otrzymuje się równanie:
![]()
(17)
Równanie (17) opisuje liniową zależność ![]()
od sumy ![]()
. Stanowi ono podstawę metody wyznaczania iloczynu rozpuszczalności metodą potencjometryczną. Po wykreśleniu zależności ![]()
, a następnie ekstrapolacji ![]()
do wartości 0, otrzymuje się wartość ![]()
, z której można następnie wyliczyć iloczyn rozpuszczalności KS0.
ZAGADNIENIA TEORETYCZNE
Definicje elektrody, półogniwa, ogniwa.
Rodzaje elektrod.
Rodzaje ogniw.
Procesy elektrodowe.
Konwencja sztokholmska.
Termodynamika ogniw galwanicznych.
Równanie Nernsta.
Metodyka pomiaru SEM ogniwa.
Definicja standardowej siły elektromotorycznej ogniwa E0.
Sposób wyznaczania standardowej siły elektromotorycznej E0.
Zastosowania pomiarów SEM ogniwa.
LITERATURA:
1. L. Smoczyński, S. Kalinowski, J. Wasilewski, F. Karczyński, Podstawy Chemii fizycznej z ćwiczeniami, Wyd. UWM, Olsztyn 2000.
2. L. Sobczyk, A. Kisza, K. Gartner, A. Koll, Eksperymentalna chemia fizyczna, PWN, Warszawa 1982.
3. Praca zbiorowa, Chemia fizyczna, PWN, Warszawa 1980.
4. G.M. Barrow, Chemia fizyczna, PWN, Warszawa 1978.
CZĘŚĆ DOŚWIADCZALNA
SPRZĘT I ODCZYNNIKI:
- woltomierz cyfrowy,
- elektroda srebrowa,
- elektroda chlorosrebrowa,
- statyw,
- przewody do elektrod,
- klucz elektrolityczny,
- zlewki o pojemności 50 cm3,
- pipety jednomiarowe 10 cm3 - 2 szt.
- pipeta wielomiarowa 5 cm3,
- nasycony roztwór KNO3,
- roztwór AgNO3 0.1 mol/dm3,
- roztwór KCl 0.1 mol/dm3.
WYKONANIE ĆWICZENIA:
Do zlewki wlać 20 cm3 roztworu AgNO3 i umieścić w niej elektrodę srebrową.
Do drugiej zlewki wlać 20 cm3 roztworu KCl, dodać kilka kropel roztworu AgNO3 i umieścić w niej elektrodę chlorosrebrową.
Obydwa roztwory połączyć kluczem elektrolitycznym napełnionym roztworem KNO3.
Elektrody połączyć z zaciskami woltomierza.
Po ustaleniu się potencjału odczytać go, następnie pipetą usunąć 10 cm3 roztworu AgNO3 i wlać 10 cm3 wody (dwukrotne rozcieńczenie). Gdy potencjał ustali się, odczytać go.
Czynność rozcieńczania i odczytu potencjału powtarzać tyle razy, aby uzyskać wyniki dla pięciu roztworów o różnym stężeniu AgNO3.
Następnie przeprowadzać rozcieńczanie roztworu KCl w drugiej zlewce i pomiar potencjału ogniwa tak, aby odczyty wykonać dla roztworów o pięciu różnych stężeniach KCl.
OPRACOWANIE WYNIKÓW:
1. Obliczyć stężenia KCl (c1) i AgNO3 (c2) w kolejnych roztworach.
2. Obliczyć wartość wyrażenia: ![]()
dla kolejnych roztworów.
3. Obliczyć wartość wyrażenia ![]()
dla kolejnych roztworów.
4. Narysować wykres funkcji : ![]()
.
5. Poprzez ekstrapolację do zerowej wartości ![]()
odczytać z wykresu wartość E0. Na podstawie otrzymanej wartości i równania 11 należy obliczyć wartość iloczynu rozpuszczalności KS0.
6. Wyniki pomiarów i obliczeń umieścić w tabeli.
Nr roztworu |
Stężenie KCl c1 [mol/dm3] |
Stężenie AgNO3 c2 [mol/dm3] |
Potencjał E [V] |
|
|
|
|
|
|
|
|
7. Otrzymaną wartość iloczynu rozpuszczalności chlorku srebrowego porównać z wartością literaturową, obliczyć błąd względny. Określić przyczyny powstawania błędów.
8. Ocenić przydatność metody do wyznaczania iloczynów rozpuszczalności innych substancji. Podać przykłady substancji, których iloczyn rozpuszczalności może być wyznaczany tą metodą.
Wyszukiwarka
Podobne podstrony:
wyklad z czwartku chemia fizycz dnia19 marca
Chemia fizyczna sprawozdanie (6 1) id 112219
Chemia fizyczna wykład 11
chemia fizyczna38
chemia fizyczna07
chromatografia jonowymienna 2, Rok I, chemia fizyczna, chemia fizyczna-protokoły
10.6 poprawione, semestr 4, chemia fizyczna, sprawka laborki, 10.6
Pojęcia na egzamin z metali, Chemia Fizyczna, chemia fizyczna- laborki rozne, Rozne
Tabelka pomiarowa do 21, BIOTECHNOLOGIA POLITECHNIKA ŁÓDZKA, CHEMIA FIZYCZNA
CHEMIA FIZYCZNA- spektrografia sc, Ochrona Środowiska pliki uczelniane, Chemia
Kolokwium nr 2 (2), Technologia chemiczna, Chemia fizyczna, 3 semestr, fizyczna paczi
Chemia fizyczna 18, chemia fizyczna, chemia, FIZYCZNA - raporty
mmgg, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczna cz II sprawka
Pytania z wejściówek, analityka medyczna UMP 2014, chemia fizyczna, ćwiczenia
raport5.2, UMK, Chemia fizyczna
Chemia fizyczna - sprawozdanie 2-1, Chemia Fizyczna
więcej podobnych podstron