W3
ABZYMY (dodatkowo seminarium)
Są to katalityczne przeciwciała występujące w naturze.
mleko kobiet karmiących- abzymy o aktywności kinazy białkowej, rybonukleazy, deoksyrybonukleazy, α-amylazy.
mikrozymy
masy molowe niższe niż 10 kDa
najmniejszy opisany enzym to mikroesteraza z Bacillus stearothermophilus
(problemy z procedurą izolacji i oczyszczania)
mikroesteraza z Candida lipolytica (5,7 kDa)
mikroproteaza z termofilnego szczepu Actinomyces sp.
mikrozym z archeabakterii Sulfolubus sulfataricus
metaloproteinaza z Grant Kurthia spirofornie (alkalofilna, termostabilna)
mikroesterazy z termofilnych grzybów (1530-5257 kDa)
Mikrozymy są alternatywą dla rybozymów i abzymów.
Jaka jest różnica między ekstermofilami a ekstremozymami? (EGZAMIN)
EKSTREMOZYMY
Enzymy pochodzące z mikroorganizmów ekstremofilnych.
Termofile : Topt > 45°C
hipertermofile : Topt > 85°C
psychrofile : Tmin < 0°C
acidofile : pH < 2
alkalofile : pH > 10
barofile : p > 1 atm
halofile : NaCl 4-5 M
metalofile : odpowiednie metale ciężkie
mikroaerofile : O2 < 21%
enetektofile : mikroorganizmy żyjące w eutektycznej warstwie lodu (lód typu 4)
Badania zaawansowane prowadzone są na termozymach.
Komercyjny sukces: fag polimerazy z Thermus agnaticus (Pyrococcus furiosus):
termofilne amylazy, ksylanazy, proteazy (produkcja glukozy i fruktozy ze skrobi, bielenie mas papierniczych, browarnictwo, detergenty piorące).
Etap wdrażania:
pullulanaza z Thermococcus aggregans
hydrataza nitrylowa z Bacillus pallidens
W3
termoacydofilna esteraza z Bacillus acidocaldavirus
termostabilne lipazy z Bacillus thermocatemulants
Badane psychrofile:
lipaza z Candida autarctica
antarktyczna mletylizyna z TA41 (muteina 3G7-3 cykle ukierunkowanej ewolucji
in vitro, wymiana 7 aminokwasów, 500-krotny wzrost termostabilności w 60°C, przesunięcie Ttop)- detergenty piorące
psychrofilne oksydorektuazy- biosensory, bioremedacja skażonych ropopochodnymi związkami środowisk
lipazy i esterazy w środowiskach niewodnych (gęstość cząsteczki)
glikozydaza - w niskotemperaturowych roztworach hydrolizy (hydroliza laktozy w mleku i ściekach o dużej zawartości serwatki
Enzymy eutektofili- badanie metagenomu („środowiskowe DNA”).
Ukierunkowana ewolucja enzymów in vitro
opiera się na wykreowaniu dużej liczby wariantów wyjściowego białka katalitycznego i znalezienie wśród nich docelowego ulepszonego enzymu;
stworzenie biblioteki wariantów genu enzymów (108 - 1012 wariantów) i sprawdzenie czy każdy wariant ulega ekspresji;
Tworzenie biblioteki genów:
metody nierekombinacyjne
Ep-PCR (error-prone PCR)
mutacje chemiczne wyjściowego DNA
techniki inżynierii białkowej (ukierunkowane punktowe mutacje, mutacje poprzez nasycenie punktowe)
pasaże genów przez mutatorowe szczepy Escherichia coli
metody rekombinacyjne
„tasowanie genów” (DNA shuffling)
STEP (Stagered Extention Process)
RACHITT (Random Chimera Genesis On Transient Template)
Wiązanie genotypu z fenotypem:
ekspozycja na fagu (białko fuzyjne z białkiem płaszcza wirusa)
ekspozycja na powierzchni komórki drożdżowej (2002 r.)
ekspozycja na rybosomie (rybosom - m-RNA - białko = kompleks)
ekspozycja na m-RNA
kompertmentacja in vitro (jeden gen w kropelce wody; inertny)
Sortowanie biblioteki wariantów zmutowanego genu fizycznie związanego z enzymem jako produktem jego ekspresji
selekcja (ważna)
skrining wysokorpzepustowy
QUEST (obecny polimeryczne aktywator transkrypcji)
FAS (pomiar fluorescencji klonów zawierających różne warianty genów enzymu)
Dotychczasowe osiągnięcia DE:
zmieniona peroksydaza cytochromowu C
Escherichia coli β- galaktozydaza → β- glukozydaza
lipaza Staphylococcus aureus → fosfolipaza
dehydrogenaza 3-izopropylojabłczan (zwiększenie aktywności)
fragment DNA (biblioteka genów hipertemofilnego Pyrococcus furiosus)
aktywność β-laktamazy
inżynierowanie szlakami metabolicznymi (biosynteza karotenoidów)
modyfikacje DE (3-indolo-glicerol)
izomeraza fosforybozylo antranilanu
biokatalityczny plastik złoża do bioreaktorów
enzymy zamykane w hybrydowych kompozytach organiczno- nieorganicznych
biokatalizator zamykany w sieci polimeru wraz z cząsteczkami magnetytu (złoża do reaktorów fluidalnych)
sieciowanie kryształów enzymów (CLESs)
usieciowane agregaty białek enzymatycznych (CLEAs)
ciecze jonowe- sole występujące w temperaturze otoczenia w stanie ciekłym (ciekłe w temperaturze T>300°C, rozpuszczają się w nich różne związki, organiczne i nieorganiczne polimery; wysoka polarność, znikome ciśnienie par, doskonała kwasowość Lewisa Bronsteda, recykling) stosowane w laboratorium w procesach transestryfikacji, alkoholizy, amonolizy, rozdziale racematów P-chiralnych hydroksymetanofosfonatów, syntezie aspartamu (przy udziale termolizyny)
rozpuszczalniki nadfluoranowe
biokataliza kombinatoryjna jest techniką stosowaną w celu stworzenia bibliotek produktów naturalnych lub syntetycznych
lipaza z Candida antarctica (biblioteka 24 estrów; 4 alkohole + 6 estrów)
biosynteza kombinatoryjna to przetwarzanie lub inżynierowanie naturalnymi szlakami metabolicznymi aby otrzymać analogi produktów naturalnych
nowe makrolidy- manipulacje na poziomie syntezy poliketydylowej
karotenoidy
pochodne aminokwasów, np.:
β-laktamy
antybiotyki polipeptydowe
antybiotyki glikopeptydowe
antybiotyki lipopeptydowe
pochodne cukrów, np.:
aminoglikozydy
glikolipidy
antybiotyki makrocykliczne
chinony i ich pochodne, np.:
antracykliny
inne (pochodne cykloalkanów, nukleozydy, polietery aromatyczne, fosfoniany, steroidy)
Liofilizowane spory szczepu produkcyjnego.
Hodowle na skosach agarowych.
Kultury wegetatywne w kolbach stożkowych.
Namnażanie biomasy.
Właściwy proces syntezy (dozowanie odpowiednich składników i prekursorów, izolacja, oczyszczanie).
trofofaza- namnażanie grzybni (30-40 h), szybka asymilacja składników podłoża, temperatura 27-24°C;
idiofaza- właściwa faza produkcji
oddzielenie grzybni od płynu pohodowlanego, filtracja;
ekstrakcja rozpuszczalnikami w układzie ciecz-ciecz;
chromatografia kolumnowa (węgiel aktywny);
krystalizacja, suszenie i inne czynności prowadzące do otrzymania farmaceutyku
p/gronkowcowe (Oksacylina, Kloksacylina, Metycylina, Nafcylina)
szeroki zakres (Ampicylina, Amoksycylina, Piperacylina)
nocardicyna A (aktywna przeciwko Gram - , nietoksyczna, stabilna w roztworach wodnych, odporna na β-laktamazy)
aminocyklitol jest pochodną streptaminy- streptomycyna
aminocyklitol jest pochodną
zmianami w przepuszczalności błony komórkowej
mutacjami 30S
enzymami modyfikującymi antybiotyki
W3
Nowe postacie preparatów enzymów
Inżynierowanie środowiskiem reakcji
Biokataliza i biosynteza kombinatoryjna
ANTYBIOTYKI
1928 r. - początek ery antybiotyków
1942 r. - definicje antybiotyków S.A.Waksman „... antybiotyki są to substancje chemiczne wytwarzane przez mikroorganizmy i mające w dużych rozcieńczeniach zdolność zabijania lub hamowania wzrostu innych drobnoustrojów...”
W3
DEFINICJA WSPÓŁCZESNA
Makrocząsteczkowe substancje naturalne, najczęściej pochodzenia drobnoustrojowego lub ich półsyntetyczne modyfikacje albo syntetyczne analogi, które w małym stężeniu działają wybiórczo na struktury i procesy biologiczne hamujące wzrost lub rozmnażanie komórek.
PODZIAŁ ZE WZGLĘDU NA BUDOWĘ CHEMICZNĄ
PODZIAŁ ZE WZGLĘDU NA WŁAŚCIWOŚCI BAKTERIOBÓJCZE I BAKTERIOSTATYCZNE
Antybiotyki β-laktamowe - penicyliny
TYP PENICYLINY |
ŁAŃCUCH BOCZNY |
PREKURSOR |
benzylowa (penicylina G) |
|
kwas fenylooctowy |
hydroksybenzylowa (X) |
|
kwas hydroksyfenylooctowy |
pentylowa (F) |
|
kwas 3-heksynowy |
fenoksymetylowa (V) |
|
kwas fenoksyoctowy |
n-heptylowa (K) |
|
kwas karpylowy |
Penicylina G - pierwszy naturalny antybiotyk β-laktamowy o bardzo dobrej aktywności wobec ziarenkowców, Gram (+), wywiera działanie bakteriobójcze; nie jest stabilna w roztworach wodnych, więc nie może być podawana doustnie.
W3
Penicylina V- podobne spectrum aktywności- nieaktywna w stosunku do gronkowców; podawana doustnie.
AKTYWNOŚĆ:
Penicylina G |
1667 mg-1 |
Penicylina V |
1595 mg-1 |
Penicyliny degradowane są przez β-laktamazy.
Inhibitory β-laktamaz: kwas klawulanowy, sublaktam, tiazolaktam.
JAK DZIAŁA PENICYLINA?
Blokuje ostatni etap biosyntezy bakteryjnej ściany komórkowej (tworzenie poprzecznych wiązań pomiędzy różnymi łańcuchami peptydoglikanu). Jej bezpośrednim celem jest transpeptydaza glikopeptydowa (mimikra molekularna).
PROCES PRODUKCJI PENICYLIN:
PROCES BIOSYNTEZY PENICYLIN (II fazy):
WYODRĘBNIANIE PRODUKTU I OCZYSZCZANIE:
Penicyliny semisyntetyczne
Penicyliny półsyntetyczne zostały wprowadzone do lecznictwa pod koniec lat 50. Niektóre z nich mają wąski zakres działania, np.:
Najbardziej znanym antybiotykiem tej grupy jest Ampicylina, która jako pierwsza była wprowadzona do lecznictwa. Następcą Ampicyliny jest Amoksycylin, która wykazuje znacznie lepszą aktywność i korzystniejsze właściwości farmakokinetyczne.
W3
W ostatnich latach pojawiły się skuteczne preparaty, łączące penicylinę półsyntetyczną z inhibitorem β-laktamaz.
Połączenie to rozszerza zakres działania penicylin na bakterie wytwarzające β-laktamazy. Przykładem takich połączonych leków jest amoksycylina z kwasem klawulanowym, ampicylina z sublaktamem czy piperocylina z tazolaktamem.
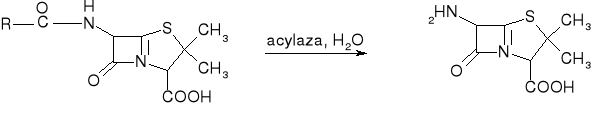
6APA
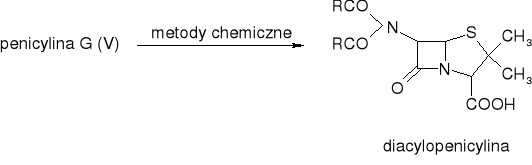
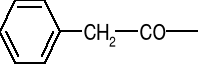
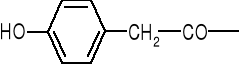
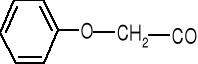
Jak się otrzymuje semisyntetyczne penicyliny? (E)
NOWE ANTYBIOTYKI β-LAKTAMOWE
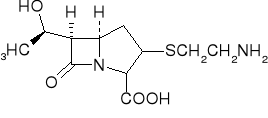
Thienamycyna- Streptomyces cattleya szerokie spektrum działania (Gram +, Gram -); odporny na działanie β-laktamaz.
Kwas klawulanowy- Strepotmyces sp.; inhibitor β-laktamaz.
Epithienamycyny (kwas oliwanowy) Streptomyces olivaceus; aktywne wobec Gram (-); inhibitory β-laktamaz.
W3
Nocardicyny- Nocardia sp.; monocykliczne β-laktamy, np.:
Cefalosporyny
Wzory strukturalne penicylin, Thienamycyny (E).
Antybiotyki aminoglikozydowe
Aminocukier + aminocyklitol
Produkty naturalne : Streptomycyna, Neomycyna, Kanamycyna, Gentamycyna
Produkty semisyntetyczne: Dibekacyna, Amikacyna
PODZIAŁ ANTYBIOTYKÓW AMINOGLIKOZYDOWYCH
Bardzo silne antybiotyki. Szerokie spektrum działania- działanie bakteriobójcze. Aktywne przeciw Escherichia coli, Klebsiella sp, Proteus sp, Enterobacter enterococcus, Pseudomonas aeruginosa, Staphylococcus aureus. Nieaktywne wobec Streptococcus sp., bakterii beztlenowych, grzybów, wirusów i pierwotniaków. Odporność na te antybiotyki powstaje powoli wśród bakterii
MECHANIZM DZIAŁANIA
Działają na poziomie biosyntezy białka - rybosom 70S.
Streptomycyna- podjednostka 30S, wiązanie terminalnego RNA z rybosomami (inicjacja biosyntezy białka), błędna odczytanie m-RNA .
Gentamycyna, Neomycyna, Kanamycyna- dezorganizacja miejsca dekodowania, blokada splicingu autokatalitycznego grupy I intronów.
TOKSYCZNOŚĆ: narządy słuchu, nerki.
Oporność na antybiotyki aminoglikozydowe może być spowodowana:
7
Wyszukiwarka
Podobne podstrony:
Systemy Bezprzewodowe W3
Gospodarka W3
w3 skrócony
AM1 w3
w3 recykling tworzyw sztucznych
Finansowanie W3
W2 i W3
so w3
UE W3 cut
W3 Elastycznosc popytu i podazy
reprod w3 2008
W3 Sprawozdawczosc
W3 Opakowania
zsf w3 pdf
chrobok w3
MEN w3
Hoffmann, W3 - chemiczny
więcej podobnych podstron