9 INHIBITORY KOROZJI, PODZIAŁ,ZASADA DZIALANIA INHIBITORÓW;PASYWATORY DEPASYWATORY.
Inhibitory korozji są to takie substancje, które po wprowadzeniu do agresywnego środowiska, w pewnych warunkach utrudniają, a czasami całkowicie zatrzymują proces korozji. Jest to jedna z najprostszych metod ochrony metali i stopów przed korozją.
W zależności od rodzaju substancji i sposobu jej oddziaływania inhibitory poddaje się klasyfikacji:
- w zależności od składu chemicznego dzieli się inhibitory na organiczne i nieorganiczne,
- w zależności od środowiska, w jakim są stosowane, rozróżnia się inhibitory działające w fazie gazowej, ciekłej, w środowiskach: kwaśnym, obojętnym i zasadowym,
- z uwagi na rodzaj reakcji elektrodowej, którą w głównej mierze hamują, odróżnia się inhibitory anodowe, katodowe oraz o działaniu mieszanym.
Inhibitory katodowe zmniejszają efektywny proces katodowy na metalu. Zmniejszają tym samym szybkość korozji, ponieważ proces anodowy rozpuszczania się metalu jest uzależniony od reakcji zachodzących na katodzie. Działanie inhibitorów katodowych polega na reakcji kationów z jonami OH- i tworzeniu się trudno rozpuszczalnych osadów, które- osadzając się na miejscach katodowych metalu -hamują proces redukcji tlenu, tworząc w ten sposób zabezpieczenie przed korozją.
Inhibitory anodowe są to w większości przypadków substancje utleniające powierzchnię metalu, na której powstaje ochronna warstewka tlenkowa, lub tworzące się na powierzchni metalu inne nierozpuszczalne, szczelne warstewki.
Do inhibitorów o działaniu mieszanym typu katodowo-anodowego należą polifosforany i krzemiany, gdyż hamują one oba procesy elektrodowe.
Pasywatory są to inhibitory anodowe, które działają zarówno w obecności jak i nieobecności tlenu, utleniające powierzchnię metalu. Do najważniejszych pasywatorów należą: chromiany, dwuchromiany, azotyny, a ze związków organicznych- benzoesany. Pasywatorami mogą być tylko te jony, które są utleniaczami i które mogą łatwo się redukować.
Brak materiałów na temat depasywacji!
10. Rodzaje zanieczyszczeń na powierzchni metali.
•Woda pochodząca z obróbki mechanicznej z zastosowaniem chłodziw, deszczu lub skraplania;
•Zgorzelina, powstająca na stali bądź żeliwie w wyniku oddziaływania tlenu w podwyższonej temperaturze (procesy stalownicze, obróbka cieplna, obróbka plastyczna na gorąco ). Może ona odrywać się przy zmianach temperatury lub działaniu wilgoci;
•Produkty korozji atmosferycznej, powstające w wyniku działania tlenu i wilgoci. Mogą być różne rodzaje tej korozji (nalotowa, wżerowa),Fe2O3 , Fe3O4 , oraz przy powierzchni FeO. Poza tym na stali może wystąpić rdza w innych postaciach;
•Warstwa tlenkowa powstająca na powierzchni wyrobów wyżarzanych lub walcowanych na gorąco;
•Oleje, smary, tłuszcze, jako pozostałości po obróbkach : mechanicznej, cieplnej oraz montażu;
•Kurz, pył, a więc cząstki stałe, piasek sadza opiłki, materiał ścierny, pozostałości po długotrwałym magazynowaniu;
•Żużel i topniki pochodzące z procesów odlewania i spawania, o odczynie kwaśnym lub alkalicznym, silnie związane z podłożem, higroskopijne;
•Sole organiczne i nieorganiczne, jako pozostałości po obróbce chemicznej i cieplnej, rozpuszczalne w wodzie, przyspieszają korozję. Także pot i sole hartownicze;
•Kwasy i alkalia, pochodzące z obróbki chemicznej, plastycznej, past polerskich, kwasów tłuszczowych, produktów hydrolizy olejów i tłuszczów roślinnych, oraz składników emulsji;
•Powłoka malarska, pozostała na odlewach i odkuwkach po znakowaniu lub przemalowywaniu;
•Masa formierska, czyli glinka i piasek formierski na odlewach;
•Wapno traserskie i kreda, jako pozostałości po trasowaniu blach i odlewów;
•Inne zanieczyszczenia takie jak grafit po obróbce plastycznej, pasty szlifierskie i polerskie, produkty zżywiczenia i rozkładu emulsji.
11. Elektropolerowanie - znaczenie charakterystyk polaryzacyjnych.
Metale lub ich stopy zanurzone w odpowiedniej kąpieli, w dobranych warunkach elektrycznych i temperaturze, mogą rozpuszczać się na anodzie w ten sposób, że powierzchnia ich zostanie wygładzona i wybłyszczona. Proces ten nosi nazwę polerowania elektrolitycznego. Podobny efekt można osiągnąć, gdy zamiast umieszczenia metali (lub stopów ) na biegunie dodatnim dodamy do kąpieli odpowiednich środków utleniających. W takim przypadku zachodzić będzie polerowanie chemiczne.
Polerowania elektrolityczne zachodzi on wtedy gdy powierzchnia anody pokryje się cienką lepką warstwą o większym oporze elektrycznym niż opór elektryczny kąpieli. Odległości między „szczytami nierówności” powierzchni (b)i końcem warstewki są mniejsze niż między wgłębieniami i końcem warstewki (a), więc opór elektryczny na drodze do szczytów jest mniejszy niż na drodze do wgłębień (rysunek na następnej stronie). Z tego powodu natężenie prądu płynącego do szczytu jest większe niż natężenie prądu płynącego do wgłębień, a więc przede wszystkim zachodzi rozpuszczanie się szczytu.
Znajomość charakterystyki jest niezbędna do zaprojektowania procesu technologicznego polerowania elektrochemicznego każdego materiału. Do tego celu potrzebna jest znajomość zakresu potencjału, w którym występuje tzw. krzywa plateau i zakres najlepszego polerowania, zakresu, w którym występuje wydzielanie się pęcherzyków tlenu na powierzchni próbki, które prowadzi do powstawania na powierzchni metalu tzw. pittingu w postaci widocznych pod mikroskopem małych wżerów.
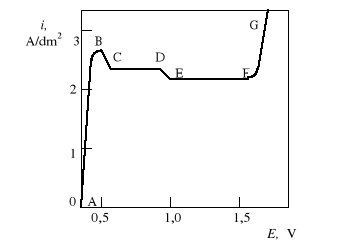
Na każdym z odcinków krzywej zachodzą inne zjawiska:
AB - zakres aktywnego rozpuszczania miedzi, powodujący trawienie warstwy wierzchniej próbki, bardzo mocno zależy od potencjału anody.
BD - rozpuszczanie powierzchni, dającemu jasną strukturę metalu, nie zawsze dobrze wygładzoną;
BC - najintensywniejsze rozpuszczanie owierzchni; CF - niemal poziomy odcinek krzywej, tzw. lateau krzywej polaryzacji, odpowiadający gęstości prądu granicznego ilim.
EF - zakres „najlepszego elektropolerowania”,
FG - gwałtowny, ciągły wzrost gęstości prądu anodowego i wydzielanie się pęcherzyków tlenu na powierzchni próbki. Przy braku mieszania na powierzchni metalu powstaje pitting w postaci widocznych pod mikroskopem małych wżerów.
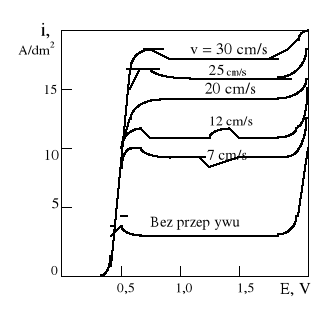
Zarówno sam przebieg krzywej polaryzacji, jak i poziom plateau zależą od wielu czynników, w tym głównie od temperatury roztworu. Innym naturalnym sposobem zwiększania anodowej gęstości prądu jest zwiększenie względnej szybkości roztworu względem polerowanej powierzchni.
12. Minimum operacji przygotowawczych pod powłoki metalowe/galwaniczne.
• odtłuszczanie wstępne,
• trawienie,
• płukanie zimne,
• odtłuszczanie chemiczne,
• płukanie gorące i zimne,
• odtłuszczanie elektrochemiczne,
• płukanie gorące i zimne,
• aktywacja powierzchni,
• płukanie zimne.
13. Odtłuszczanie/zmydlanie i emulgowanie tłuszczów.
Odtłuszczanie polega na usuwaniu z powierzchni podłoża tłuszczów (roślinnych lub zwierzęcych), ich pochodnych (mydła), substancji tłuszczopochodnych (oleje minerakne) oraz ich zanieczyszczeń (kurz, pasty itp.) różnego pochodzenia.
Odtłuszczanie w rozpuszczalnikach polega na fizycznym przejściu substancji tłuszczowych do roztworu pod działaniem niektórych związków chemicznych;
Zmydlanie tłuszczów w środowisku alkalicznym do gliceryny i kwasów tłuszczowych przebiega wg. następującej reakcji:
C3H5(RCOO)3+3NaOH = C3H5(OH)3+3RCOONa
gdzie R stanowi rodnik charakterystyczny dla odpowiedniego kwasu tłuszczowego. Sól sodowa kwasu tłuszczowego reaguje następnie z jonami Ca2+ i Mg2+ obecnymi w roztworze, dając mydła wapniowe i magnezowe bardzo żle rozpuszczalne w wodzie .
Emulgowanie tłuszczów polega na obniżenu napięcia powierzchniowego na granicy wody i tłuszczu, przez co tworzą one trwałą emulsję, przedmiot zaś oczyszczony zostaje zwilżony alkalicznym roztworem oczyszczającym.
14.PARAMETRY GALWANOTECHNIKI
Metale osadzane elektrolitycznie mają strukturę krystaliczną, a postać zewnętrzna otrzymanych powłok zależy głównie od szybkości wzrostu kryształów i szybkości powstawania nowych zarodków krystalicznych. Jeżeli warunki zewnętrzne sprzyjają szybkiemu powstawaniu zarodków kryształów, to otrzymuje się osad drobnoziarnisty, natomiast w przypadku małej liczby zarodków i szybkiemu ich wzrostu powstają stosunkowo duże kryształy. Do głównych czynników wpływających na wygląd powłoki galwanicznej mają: katodowa gęstość prądu, stężenie elektrolitu, temperatura, obecność czynników powierzchniowo czynnych i koloidów, rodzaj elektrolitu oraz własności metalu na którym jest osadzana powłoka.
Gęstość prądu - jest to stosunek całkowitego natężenia prądu I(A) do całkowitej powierzchni S(dm2). Przy małych gęstościach prądu wyładowanie jonów następuje powoli i szybkość wzrostu powstałych już zarodków
przekracza szybkość powstawania zarodków nowych.. Warunki te sprzyjają powstawaniu powłok gruboziarnistych. W miarę wzrostu gęstości prądu wzrasta szybkość powstawania zarodków i powłoka staje się bardziej drobnoziarnista. Przy bardzo dużych gęstościach prądu stężenie rozładowujących się jonów w pobliżu katody bardzo maleje, w wyniku czego kryształy wykazują tendencję wzrostu w kierunku warstw roztworu, w których stężenie jonów jest większe. Na powierzchni powstają dendryty. Przy zwiększanej gęstości prądu może dojść do wydzielania się wodoru, wskutek czego powłoki mogą być porowate i gąbczaste.
Stężenie elektrolitu - wpływ stężenia elektrolitu, gęstość prądu i mieszania w znacznym stopniu uzupełniają się wzajemnie. Zwiększając stężenie, albo mieszając elektrolit można stosować większe gęstości prądu bez obawy tworzenia się struktury gruboziarnistej (patrz wyżej) lub wydzielania się wodoru. Wpływ stężenia elektrolitu na szybkość powstawania zarodków w dalszym ciągu nie została ostatecznie do kończ wyjaśniona. Z kąpieli o dużym stężeniu elektrolitu otrzymuje się powłoki bardziej zwarte i dobrze przyczepne, ale stwierdzono że szybkość powstawania zarodków maleje ze wzrostem stężenia, a polepszenie własności powłok jest związane ze zwiększeniem szybkości wzrostu kryształów wzdłuż powierzchni katody i ze spadkiem prostopadle do jej powierzchni.
Temperatura - wzrost temperatury kąpieli ma dwojaki wpływ. Z jednej strony sprzyja on dyfuzji, co zapobiega - w pewnym stopniu - powstawania struktury gruboziarnistej lub powłok gąbczastych przy dużych gęstościach prądu, z drugiej strony zwiększa szybkość wzrostu kryształów, co sprzyja strukturze gruboziarnistej. Wzrost temp. sprzyja wydzielaniu się wodoru, czego efektem jest spadek kwasowości i wydzielanie się soli zasadowych. W niższych temp. zwykle wpływa czynnik pierwszy, przez co powierzchnia jest lepsza. W temp. wyższych powłoki mają niższą jakość.
Mieszanie kąpieli - wpływa na zmniejszenie grubości warstwy dyfuzyjnej, a przez to umożliwia zwiększenie gęstości prądu i w rezultacie szybkości osadzania. Czynnik ten dzięki, lepszemu odprowadzaniu jonów pochodzących z anody, również zmniejsza polaryzację anodową i umożliwia podniesienie wydajności anodowej. W przypadku osadzania powłok błyszczących, których otrzymywanie jest uwarunkowane jest również dyfuzją środków blaskotwórczych do katody, mieszanie odgrywa zasadniczą rolę, umożliwiając lepszy transport do katody tych związków.
Sub. pow. czynne - dodatki środków powierzchniowo czynnych powodują zmniejszenie napięcia powierzchniowego, co sprzyja odrywaniu pęcherzyków wodoru. Sub. te określa się jako antypittingowe Przypuszczalnie suib .te ulegają adsorpcji na zarodkach kryształów, hamując ich wzrost; wyładowujące się jony muszą zatem tworzyć nowe zarodki, co powoduje powstanie powłok drobno krystalicznych, gdy normalnie w tych warunkach powstaje powłoka gruboziarnista.
Elektrolit - rodzaj elektrolitu wpływa istotnie na własności powłok. Np. ołów w roztworach azotanu ołowiawego wydziela się w postaci gruboziarnistej, a z roztworów krzemo- lub borofluorków - w postaci drobnokrystalicznej; również miedź z roztworu cyjanów wydziela się w postaci drobnokrystalicznej, a z roztworów siarczanów bez dodatków blaskotwórczych - w postaci gruboziarnistej.
Metal elektrody - stwierdzono że orientacja kryształów w pierwszych warstwach powłoki jest przedłużeniem struktury materiału podłoża.
15 WŁASNOŚCI KĄPIELI STOSOWANYCH W GALANOTECHNICE
Wgłębność kąpieli - tendencja do osadzania na całej powierzchni powłoki o jednakowej grubości, zależy od takich czynników, jak przewodność kąpieli, wielkość zmian polaryzacji ze zmianą gęstości prądu oraz wielkość zmiany wydajności prądu ze zmianą jego gęstości. Wgłębność można poprawić zwiększając jej przewodnictwo np. przez zwiększenie stężenia soli przewodzących i podwyższenie temperatury. Podwyższenie temp. może jednak obniżyć polaryzację, w wyniku czego czynnik ten może ostatecznie pozostać bez wpływu.
Zdolność krycia kąpieli - jest to minimalna gęstość prądu, przy której rozpoczyna się osadzanie powłoki galwanicznej. Zdolność krycia zależy od stężenia jonu metalu osadzanego, a przede wszystkim od gęstości prądu. Własność ta ma szczególne znaczenie przy chromowaniu dekoracyjnym, gdy w celu pokrycia całkowitego powierzchni powłoką trzeba stosować tzw. uderzenie prądowe
Mikrowygładzanie - jest to własność nowoczesnych kąpieli do osadzania powłok błyszczących, umożliwiająca uzyskanie powłok galwanicznych o gładkości wyższej od gładkości podłoża; Zdolność wygładzania def. się jako stosunek grubości powłok w zagłębieniu rysy do jej grubości na brzegach .
- zdolność rozpraszania - jest to zdolność kąpieli do równomiernego rozdziału materiału do pierwotnego rozkładu gęstosci prądu
16. Jakie jest główne niebezpieczeństwo odtłuszczania katodowego stali? Jak go uniknąć?
Główne niebezpieczeństwo odtłuszczania katodowego stali polega na tym, że w tym procesie na stali wydziela się gaz - wodór, który powoduje znaczne nawodorowanie przedmiotów poddawanych obróbce. Prowadzi to do zmian własności mechanicznych podłoża, do tzw. kruchości wodorowej, lub też do złuszczania się powłoki z upływem czasu wskutek dyfuzji wodoru z głębszych warstw do warstwy powierzchniowej.
Niebezpieczeństwo to unika się poprzez:
zastosowanie anodowego odtłuszczania stali pomimo względnie łatwego pokrywania się tlenkami (można łatwo je usunąć w kwasach). Po tym zabiegu należy ewentualnie, bardzo krótko, oczyścić przedmioty w cyklu katodowym.
zastosowanie odtłuszczania anodowego i przejście na katodowe w końcowej fazie odtłuszczania elektrochemicznego
stosowanie oczyszczanie prądem stałym okresowo zmienianym (np. w cyklach : 20s odtłuszczanie katodowe, 10s anodowe)
18. Zachowanie się układu po przerwaniu powłoki Fe/Ni i Fe/Zn
Schematy przebiegu korozji powłok: a) anodowe, b) katodowe
Powłoka Fe/Zn jest powłoką anodową, czyli z metalu (cynku), który w określonym środowisku korozyjnym wykazuje potencjał niższy od potencjału metalu podłoża (stali) i w związku z tym nie tylko izoluje go od otaczającego środowiska, lecz również chroni elektrochemicznie, ulegając sam korozji; w przypadku powstania ogniwa elektrochemicznego korozji ulega metal powłoki - cynk.
Powłoka Fe/Ni jest powłoką katodową, czyli z metalu (niklu), który w określonym środowisku korozyjnym wykazuje potencjał elektrochemiczny wyższy od potencjału metalu podłoża (stali) i w związku z tym chroni go przez odizolowanie jego powierzchni od otaczającego środowisku; w przypadku powstania ogniwa elektroche-micznego korozji ulega metal podłoża - stal.
23 JAK POLĄCZYĆ PRZEDMIOT PRZY; (1) odtłuszczaniu elektrochemicznym Cu, (2) polerowaniu elektrolitycznym, (3) trawieniu elektrochemicznym: a-stali, b-Zn, c-Ni.
Ad.1
Odtłuszczanie miedzi odbywa się katodowo, ponieważ w procesie anodowym ulegają one bardzo szybkiemu utlenieniu, zwłaszcza przy stosowaniu większych gęstości prądu lub przy wyższych wartościach pH. Tym niemniej wielu autorów jest zdania, że miedź na skutek łatwości nawodorowania w cyklu katodowym należy oczyszczać tylko anodowo, mimo względnie łatwego pokrywania się tlenkami. Wytworzone tlenki usuwa się w kwasach, co zachodzi łatwo i jest mniej szkodliwe od nawodorowania podłoża w cyklu katodowym
Ad 2.
W procesie polerowania elektrolitycznego metal (lub stop) umieszczany jest na anodzie (czyli biegunie dodatnim).
Ad 3.
Trawienie stali jest anodowe, ze względu na łatwość nawodorowania.
Brak materiałów o trawieniu cynku i niklu(prawdopodobnie metal jest anodą)!!!
Pytanie 8
Korozja wysokotemperaturowa- prawa korozji metali; wymienić tlenki na miedzi i stali.
Korozja wysokotemperaturowa (gazowa) jest chemicznym procesem utleniania metali w różnego typu spalinach lub środowiskach zawierających siarkę, siarkowodór lub chlorowce.
Ma ona największe znaczenie praktyczne. Jest to proces niszczenia fazy metalicznej zachodzący na granicy: metal/suchy gaz w temperaturach podwyższonych, gdy nie powstaje ciekły elektrolit, jak również lotny produkt reakcji. Produktami korozji gazowej w środowisku zawierającym tlen są stałe tlenki metali tworzące na powierzchni metali warstewkę stałej zgorzeliny. Na czystej powierzchni metalu w zetknięciu ze środowiskiem gazowym w wyniku reakcji chemicznej powstająca warstewka stałego produktu reakcji oddziela metal od środowiska. Dalszy przebieg reakcji w większości przypadków objawia się zwiększaniem się grubości warstewki produktów reakcji, co oznacza, że środowisko ma dostęp do powierzchni metalu. W pewnych przypadkach jest to możliwe z powodu nieciągłości i porowatości warstewki, w innych zaś gdy warstwa jest ciągła, jedynie z powodu dyfuzji przez warstwę. Może to być dyfuzja jonów metalu odrdzeniowa przez warstewkę zgorzeliny lub dyfuzja atomów, względnie jonów utleniacza w przeciwnym kierunku - dordzeniowa.
Prawa korozji
Reguła Pillinga i Bedwortha
gdzie: Vt- objętość molowa tlenku,
Vm- objętość molowa metalu,
M.- ciężar cząsteczkowy tlenku,
D-gęstość,
A-ciężar atomowy,
d-gęstość metalu,
liczba atomów metalu w cząsteczce tlenku.
Jeśli Vt/Vm>1 - tworzy się warstwa ochronna, jeśli Vt/Vm<1, utworzona warstwa nie ma własności ochronnych, gdyż powstający produkt jest rozciągany i następują pęknięcia odsłaniające powierzchnię metalu.
Prawa wzrostu warstewek zgorzeliny
prawo liniowego wzrostu zgorzeliny
y=kt+const
prawo parabolicznego wzrostu zgorzeliny
y2=2k't+const
prawo logarytmicznego wzrostu zgorzeliny
Teoria utleniania Wagnera
gdzie: E- siła elektromotoryczna krótkozwartego ogniwa galwanicznego, w którym anodą jest powierzchnia metalu utlenianego, a katodą powierzchnia tlenku graniczącego z utleniaczem
ne,nk,na- liczby przenoszenia elektronów, kationów i anionów,
χ- przewodność elektryczna właściwa tlenku,
stała Faradaya.
Tlenki wytwarzające się na:
miedzi: Cu2O, CuO
stali: Fe3O4- magnetyt, Fe2O3- hematyt, FeO- wustyt
24 CO TO JEST WGŁĘBNOŚĆ
Wgłębność kąpieli - tendencja do osadzania na całej powierzchni powłoki o jednakowej grubości, zależy od takich czynników, jak przewodność kąpieli, wielkość zmian polaryzacji ze zmianą gęstości prądu oraz wielkość zmiany wydajności prądu ze zmianą jego gęstości. Wgłębność można poprawić zwiększając jej przewodnictwo np. przez zwiększenie stężenia soli przewodzących i podwyższenie temperatury. Podwyższenie temp. może jednak obniżyć polaryzację, w wyniku czego czynnik ten może ostatecznie pozostać bez wpływu.
Metody pomiaru-
a) z zastosowaniem elektrod umieszczonych równolegle
metoda Harringa- Bluma
m. Fielda
Przy zastosowaniu tych metod używa się dwóch katod umieszczonych w spec. komórkach, w różnych odległościach od anody i całkowicie przecinających kąpiel. W m. Harringa katody są umieszczone po dwóch stronach anody, w m. Fielda- po jednej stronie. M. Te są jedynymi, przy stosowaniu których sposób umieszczenia elektrod ma na celu zapewnienie uzyskiwania na każdej z katod powłoki o równomiernej grubości i które umożliwiają obliczenie zdolności rozpraszanie kąpieli. Ze względu na łatwość ustalenia odległości katod od anody oraz natężeń prądu lub grubości osadzanych powłok m. te b.dobrze nadają się do porównywania własności różnych kąpieli.
A i B - katody
b) am.z zastosowaniem elektrod umieszczonych prostopadle
W m.. tej stosuje się katodę złożoną z szeregu płytek położonych pod kątem prostopadłym w stosunku do płaszczyzny anody, w różnych od niej odległości Rozdział gęstości prądu obl. się z przyrostu masy katod i podaje w procentach. Im więcej katod, tym lepszy można uzyskać obraz rozdziału metalu przez daną kąpiel.
m.Horsha i Fuwy(pisownia?)
m.Olenina
c) m. z zastosowaniem elektrod umieszczonych skośnie
m.Hulla
m.Kudriawcewa-Nikiforowa
m.Wagramiana
m.Konnwerta
m.Gilmonta
m.Mohkera
m. zastosowaniem szczelin
-opór właściwy roztworu
l1-odl. rozpatrywanej części pow. katody od anody od anody
l2- odl. rozpatrywanej części pow. katody od anody od anody
i1-natęrzenie prądu płynącego przez część pow.
i2-natęrzenie prądu płynącego przez część pow.
- zmiana polaryzacji w zależności od gęstości prądu
Wyszukiwarka
Podobne podstrony:
wyklad 14
Vol 14 Podst wiedza na temat przeg okr 1
Metoda magnetyczna MT 14
wyklad 14 15 2010
TT Sem III 14 03
Świecie 14 05 2005
2 14 p
i 14 0 Pojecie administracji publicznej
Wyklad 14 2010
14 Zachowanie Przy Wypadkach 1 13
Wyklad 14 PES TS ZPE
14 Ogniwa słoneczne
Wyklad 14
Wykład z fizyki 14
1 Wprowadzenie do psychologii pracy (14)id 10045 ppt
ZO NST 14 ĆW1CZ 1, 2 STUD F F3
więcej podobnych podstron