Miareczkowanie pH-metryczne kwasu octowego przed podziałem
Przybliżone stężenie CH3COOH [mol/dm3] |
Objętość CH3COOH Vk użyta do miareczkowania [cm3] |
Całkowita objętość NaOH zużyta do miareczkowania CH3COOH [cm3] |
0,3 |
5 |
16,5 |
0,4 |
5 |
22,0 |
0,5 |
4 |
22,5 |
0,6 |
4 |
26,6 |
0,7 |
3 |
23,4 |
0,8 |
3 |
27,2 |
0,9 |
2 |
25,8 |
1,0 |
2 |
22,3 |
Miareczkowanie pH-metryczne kwasu octowego po podziale
Przybliżone stężenie CH3COOH [mol/dm3] |
Objętość CH3COOH Vk użyta do miareczkowania [cm3] |
Całkowita objętość NaOH zużyta do miareczkowania CH3COOH [cm3] |
0,3 |
5 |
14,1 |
0,4 |
5 |
19,0 |
0,5 |
4 |
22,2 |
0,6 |
4 |
24,4 |
0,7 |
3 |
20,7 |
0,8 |
3 |
21,5 |
0,9 |
2 |
18,1 |
1,0 |
2 |
18,9 |
Celem ćwiczenia było wyznaczenie współczynnika podziału kwasu octowego między wodę i chloroform oraz parametru asocjacji kwasu octowego w chloroformie.
Współczynnika podziału Nernsta Kc jest wielkością charakterystyczną dla danego układu dwóch cieczy i składnika rozdzielającego się między te ciecze.
Współczynnika podziału Nernsta Kc w stałej temperaturze przyjmuję wartość stałą, jest to stosunek stężeń substancji rozpuszczonej w obu fazach ciekłych. W fazie wodnej substancja rozpuszczona ulega dysocjacji, w organicznej asocjacji. Wartość współczynnika podziału wskazuję, w jakim stopniu dana substancja dzieli się (rozpuszcza się w cieczach) między dwie ciecze. Różnice rozpuszczalności wykorzystuję się w ekstrakcji do rozdziału mieszanin wieloskładnikowych.
Opracowanie wyników:
Stężenie kwasu octowego przed podziałem Ci i po podziale
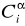
w warstwie wodnej:
Ci =(Cz*Vz )/Vk
![]()
=(Cz*Vz )/Vk
Vk- objętość roztworu kwasu octowego pobrana do miareczkowania
Cz - stężenie zasady sodowej 0,1 mol/dm3
Vz- objętość roztworu zasady sodowej zużyta do miareczkowania
Stężenie kwasu octowego w warstwie chloroformowej
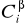
:
![]()
=Ci-![]()
Stopień dysocjacji kwasu octowego
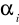
w warstwie wodnej dla poszczególnych stężeń:
![]()
=0,003565-0,002812![]()
Wykres zależności liniowej
lg[![]()
(1-![]()
)]=f (lg![]()
)wyprowadzony ze zlogarytmowanej postaci równania
lg[![]()
(1-![]()
)]=lgKc +1/n lg![]()
metodą najmniejszych kwadratów otrzymałam równanie y=0,1879x-0,0205, a więc
lg Kc=-0,0205, czyli Kc=0,94
1/n=0,1879, czyli n=5,32
metodą graficzną otrzymałam
y1=-0,14, y2=-0,255, x1=-0,7,x2=-1,3
1/n= y2 - y1 / x2 - x1
1/n=0,19, n=5,26
lg Kc=-0,0351, Kc=0,92
Tabela wyników:
Ci [mol/dm3] |
[mol/dm3] |
[mol/dm3] |
|
1- |
[mol/dm3] |
lg[ |
lg |
0,33 |
0,28 |
0,05 |
0,0071 |
0,9929 |
0,28 |
-0,55 |
-1,32 |
0,44 |
0,38 |
0,06 |
0,0063 |
0,9937 |
0,38 |
-0,42 |
-1,22 |
0,56 |
0,56 |
0,01 |
0,0052 |
0,9948 |
0,55 |
-0,26 |
-2,12 |
0,66 |
0,61 |
0,06 |
0,0050 |
0,9950 |
0,61 |
-0,22 |
-1,26 |
0,78 |
0,69 |
0,09 |
0,0046 |
0,9954 |
0,69 |
-0,16 |
-1,05 |
0,91 |
0,72 |
0,19 |
0,0045 |
0,9955 |
0,71 |
-0,15 |
-0,72 |
1,29 |
0,91 |
0,39 |
0,0038 |
0,9962 |
0,90 |
-0,05 |
-0,41 |
1,12 |
0,95 |
0,17 |
0,0037 |
0,9963 |
0,94 |
-0,03 |
-0,77 |
Stałe równania Nernsta |
1/n |
Kc |
n |
Metoda graficzna Metoda najmniejszych kwadratów |
0,19 0,17 |
0,92 0,94 |
5,26 5,87 |
Wnioski:
Znajomość współczynników podziału substancji pomiędzy nie mieszające się fazy ciekłe ma ogromne znaczenie w ekstrakcji. W badanym przypadku rozdziału kwasu octowego pomiędzy fazą wodną a chloroformową, współczynnik podziału jest bliski jedności. Efektywne usunięcie kwasu octowego z roztworu wodnego do fazy chloroformowej wymagałoby kilkakrotnej ekstrakcji za pomocą kolejnych porcji czystego chloroformu.
Wyszukiwarka
Podobne podstrony:
wyklad z czwartku chemia fizycz dnia19 marca
Chemia fizyczna sprawozdanie (6 1) id 112219
Chemia fizyczna wykład 11
chemia fizyczna38
chemia fizyczna07
chromatografia jonowymienna 2, Rok I, chemia fizyczna, chemia fizyczna-protokoły
10.6 poprawione, semestr 4, chemia fizyczna, sprawka laborki, 10.6
Pojęcia na egzamin z metali, Chemia Fizyczna, chemia fizyczna- laborki rozne, Rozne
Tabelka pomiarowa do 21, BIOTECHNOLOGIA POLITECHNIKA ŁÓDZKA, CHEMIA FIZYCZNA
CHEMIA FIZYCZNA- spektrografia sc, Ochrona Środowiska pliki uczelniane, Chemia
Kolokwium nr 2 (2), Technologia chemiczna, Chemia fizyczna, 3 semestr, fizyczna paczi
Chemia fizyczna 18, chemia fizyczna, chemia, FIZYCZNA - raporty
mmgg, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczna cz II sprawka
Pytania z wejściówek, analityka medyczna UMP 2014, chemia fizyczna, ćwiczenia
raport5.2, UMK, Chemia fizyczna
Chemia fizyczna - sprawozdanie 2-1, Chemia Fizyczna
więcej podobnych podstron