Podstawy termodynamiki
Termodynamika jest działem nauki zajmującym się energią wewnętrzną ciał, sposobami jej zmiany i przemianami jednych form energii w inne. Oprócz pojęcia energia wewnętrzna pojawiają się tu takie pojęcia jak: temperatura, ciśnienie i objętość. Wielkości te opisują stan termodynamiczny układu. W ogólnym przypadku odnosimy je do stanu płynu (ciecz lub gaz). W naszych rozważaniach ograniczymy się do rozważań związanych z gazem idealnym. Jest to gaz, którego cząsteczki traktujemy jako punkty materialne nie oddziałujące ze sobą z wyjątkiem procesów zderzeń.
równanie kinetycznej teorii gazów
Wyobraźmy sobie sześcienne naczynie o boku „a”, w który porusza się chaotycznie duża liczba punktów materialnych „N” (rysunek 34).
Rys. 34 Gaz idealny w naczyniu sześciennym
Przy chaotycznym ruchu tych cząsteczek statystycznie 1/3 z nich porusza się odpowiednio w kierunku osi: x, y i z. W czasie:
![]()
statystyczna cząsteczka odbije się jeden raz od jednej ścianki naczynia. Spowoduje to jej zmianę pędu o ![]()
(zmiana pędu na przeciwny). Z drugiej zasady dynamiki wynika, że siła pochodząca od tego uderzenia będzie równa:
![]()
.
Stąd przyczynek ciśnienia wywieranego na ściankę naczynia:
![]()
,
gdzie energia i-tej cząstki poruszającej się w kierunku x jest równa 1/3 energii kinetycznej tej cząstki:
![]()
,
a całkowita energia kinetyczna gazu:
![]()
.
Tak więc z ostatnich trzech równań otrzymujemy:
![]()
.
Jest to podstawowe równanie teorii kinetycznej gazów.
Zapisując ten związek dla jednego mola gazu o masie μ i objętości V0 uzyskamy:
![]()
.
Uniwersalna stała gazowa R związana jest przez liczbę Avogadro ![]()
ze stałą Boltzmana „k” równaniem:
![]()
![]()
.
Dla n-moli gazu o masie M i objętości V otrzymamy równanie Clapeyrona:
![]()
.
Stąd uzyskujemy znane dobrze równanie (dla stałej masy gazu):
![]()
.
I i II zasada termodynamiki, przemiany termodynamiczne
Na energię wewnętrzną gazu składają się wszystkie formy energii występujące wewnątrz układu izolowanego. Zmienić całkowitą energię można na dwa sposoby: wykonując pracę „W” nad układem (siłami zewnętrznymi lub przez układ siłami wewnętrznymi), lub wymienić energię w formie ciepła „Q”. Sformułowanie to stanowi treść I zasady termodynamiki.
![]()
Pracę obliczamy z wzoru:
![]()
Pamiętając, ze W>0 (wzrasta energia wewnętrzna), gdy zmniejsza się objętość gazu. Dlatego w powyższym wzorze występuje znak „-„. Ciepło z kolei można obliczyć dla dwóch przypadków: przy przemianie fazowej w stałej temperaturze i przy ogrzewaniu ciała w tej samej fazie od temperatury Tp do temperatury Tk.
![]()
cp oznacza ciepło przemiany fazowej, którego jednostką jest 1J/kg a cv ciepło właściwe, którego jednostką jest ![]()
.
Uwzględniając możliwości zmian różnych parametrów gazu idealnego możemy wyróżnić podstawowe przemiany gazowe:
przemiana izotermiczna, w której niezmienna jest temperatura a wykresem zależności p(V) jest hiperbola,
przemiana izochoryczna, w której niezmienna jest objętość a wykresem zależności p(T) jest linia prosta,
przemiana izobaryczna, w której niezmienne jest ciśnienie a wykresem zależności V(T) jest linia prosta,
przemiana adiabatyczna charakteryzująca się izolacją termiczną układu, czyli brakiem wymiany energii w formie ciepła.
Odpowiednie równania do tych przemian mają postać:
![]()
,
![]()
,
![]()
,
![]()
.
Ponieważ:
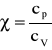
oraz ![]()
.
to współczynnik χ jest większy od jedności. Wykres adiabaty charakteryzuję się większym nachyleniem niż wykres izotermy.
Z równania Clapeyrona wynika, że energia wewnętrzna gazu idealnego jest proporcjonalna do temperatury. Fakt ten wraz z I zasadą termodynamiki i wzorem na pracę umożliwia prostą analizę przemian termodynamicznych gazu idealnego. Należy pamiętać, że wszystkie przemiany należy rozpatrywać z punktu widzenia zmiany energii wewnętrznej. Poniżej przedstawiono przemianę izotermiczną (T=const).
![]()
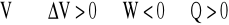
i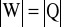
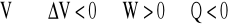
i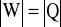
W przypadku a) znajdujemy składnik dodatni, którym jest ciepło dostarczone do układu powodujące wzrost energii wewnętrznej gazu. Prowadzi to do wykonania przez gaz pracy (W<0) kosztem uzyskanej wcześniej nadwyżki energii wewnętrznej. Przemianę nazwiemy izotermicznym rozprężaniem gazu (![]()
) w przypadku a) oraz izotermicznym sprężaniem gazu (![]()
) w przypadku b). Ostatnią sytuację obrazuje wciskanie tłoka pompki z gazem (rysunek 35). Wykonana praca nad gazem przekazywana jest przez energię wewnętrzną gazu do otoczenia w formie ciepła (każdy mógł sprawdzić pompując koło rowerowe lub samochodowe).
Rys. 35 Izotermiczne sprężanie gazu
Ważnym, z punktu widzenia zastosowań technicznych, jest tzw. cykl Carnota dla idealnego silnika składającego się z gazu roboczego, grzejnika o dużej pojemności cieplnej cieplnej mającego temperaturę T1 i chłodnicy o dużej pojemności cieplnej mającej temperaturę T2 (rysunek 36). Silnik ten pracuje na dwóch izotermach (T1 i T2) i na dwóch adiabatach (rysunek 37).
Rys. 36 Idealny silnik Carnota
Rys.37 Cykl Carnota
Sprawność takiego silnika obliczamy jako stosunek wykonanej pracy do ciepła dostarczonego do układu.
![]()
Sprawność rzeczywistych silników nie może być większa od sprawności silnika Carnota.
![]()
Ostatnie równanie stanowi jedną z postaci drugiej zasady termodynamiki. Inaczej można ją sformułować następująco: niemożliwe jest pobieranie z jednego źródła ciepła energii i zamienianie jej w 100% na pracę.
Wyszukiwarka
Podobne podstrony:
podstawy termodynamiki(1)
Wzory do teorii z podstaw termodynamiki
fiza, rozdz.9-Prąd elektryczny, 9
fiza, rozdz.9-Prąd elektryczny, 9
fiza, rozdz.15-Elementy teorii względności, 15
Podstawy termodynamiki
2 hakerstwo helion rozdz podstawy programowania dl (2)
Podstawy termodynamiki chemicznej
fiza, rozdz.4-Dynamika bryły sztywnej, 4
fiza, rozdz.12-Fale elektromagnetyczne, 12
fiza, rozdz.3-Kinematyka punktu materialnego, 3
PODSTAWY TERMODYNAMIKI przepisane wykłady, PODSTAWY TERMODYNAMIKI
fiza, rozdz.8-Stałe pole elektryczne, 8
Podstawy termodynamiki wykad
termodynamika Wzory do teorii z wymiany ciepla dla USM, Wzory do teorii z podstaw termodynamiki
fiza, rozdz.5-Ruch harmoniczny, 5
fiza, rozdz.1-Świat zjawisk fizycznych2, 1
fiza, rozdz.2-Oddziaływania w przyrodzie, 2
więcej podobnych podstron