|
INSTYTUT INŻYNIERII ŚRODOWISKA POLITECHNIKA ZIELONOGÓRSKA
|
|
|
CHEMIA FIZYCZNA LABORATORIUM
|
|
III ROK INŻYNIERII ŚRODOWISKA STUDIA DZIENNE GRUPA 36 b
|
19.04.2001 TYDZIEŃ 6 |
|
ADSORPCJA Z ROZTWORU KWASU KARBOKSYLOWEGO NA WĘGLU AKTYWNYM
TEMAT II
AUTORZY OPRACOWANIA:
Kocik Krzysztof Metanowski Zbigniew
|
||
Podstawy teoretyczne
ZJAWISKO ADSORBCJI
Na powierzchni ciała stałego niezależnie od rodzaju sieci krystalicznej panują siły wywołujące gromadzenie się cząsteczek z fazy gazowej lub roztworu. Jeżeli siły te maja charakter fizyczny, to mówimy o adsorpcji fizycznej natomiast, gdy chemiczny, to mówimy o adsorpcji aktywnej (chemisorpcji).
Powinowactwo powierzchni danego adsorbentu do określonego związku adsorbowanego określa ciepło adsorpcji ΔHads. Wielkość ta jest zawsze ujemna tzn. podczas adsorpcji zawsze wydziela się ciepło. W przypadku adsorpcji fizycznej ΔHads osiąga, co najwyżej wartość - 50 KJ/mol. Dla chemisorpcji charakterystyczne są duże efekty cieplne, porównywalne z ciepłami zwykłych reakcji chemicznych.
MODEL LANGMUIRA:
Zakłada się, że powierzchnia adsorbentu zawiera ustaloną liczbę miejsc dla zaadsorbo-wanych cząsteczek i każda takie miejsce może być obsadzone przez jedną cząsteczkę.
Ciepło adsorpcji przypadające na jedną cząsteczkę powinno być niezależne od stopnia obsadzania dostępnych miejsc. Można sformułować równowagę adsorpcji, gdzie szybkość adsorpcji jest równa desorpcji.
Vads=kap*(1-Θ)
gdzie:
k- stężenie,
p- ciśnienie
Θ - ułamek miejsc zajętych
Vdes=kd*Θ
Kd=ka*p*(1-Θ)
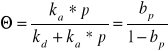
gdzie b=ka/kd
Zależność stopnia obsadzania Θ od ciśnienia:
Θ
p
W przypadku adsorpcji z roztworu stosuje się równanie Freundlicha:
![]()
gdzie:
W - liczba moli lub miara substancji zaadsorbowanej na gram adsorbenta,
c - stężenie substancji adsorbenta,
k i n - stałe,
1/n - na ogół mniejsza od 1
2. CZĘŚĆ EKSPERYMENTALNA
METODYKA ĆWICZENIA.
Celem ćwiczenia jest wyznaczenie izotermy adsorpcji Freundlicha dla układu:
Wodny roztwór kwasu organicznego - węgiel aktywny w temperaturze pokojowej.
Zadanie sprowadza się do wyznaczenia wartości współczynników k i l/n równania Freundlicha przez pomiar zależności ilości zaadsorbowanego kwasu do stężenia w roztworze. Stężenie określamy na drodze miareczkowania alkacydymetryczneego.
WYKONANIE ĆWICZENIA.
Wychodząc z 0,5n roztworu kwasu sporządzić pięć roztworów o następujących stężeniach; 0,3n, 0,25n, 0,20n, 0,15n, 0,10n. W ilości po 100cm3 każdego. Otrzymane roztwory dokładnie mianujemy za pomocą 0,1n NaOH. Pobieramy po 50 cm3 każdego roztworu, wlewamy do butelek po 150 cm3 i wsypujemy do każdej z nich dokładnie odważone 2g węgla aktywnego, zamykamy szczelnie i wstrząsamy przez 10 min. Następnie roztwory sączymy i mianujemy jak poprzednio (wobec fenoloftaleiny).
PRZEDSTAWIENIE WYNIKÓW POMIARÓW.
Z różnicy stężeń przed i po adsorpcji obliczamy x-liczbę moli zaadsorbowanego kwasu. Empirycznie równanie Freundlicha możemy tu przedstawić w postaci:
X/m =kc1/n
gdzie: m - masa węgla;
Po zlogarytmowaniu równanie przybiera postać:
![]()
Wartości bezpośrednich wyników oraz wielkości występujących w równaniu Freundlicha przedstawia tabela.
Wyniki pomiarów parametrów izotermy adsorpcji z roztworu.
L.p. |
V1 [cm3] |
V2 [cm3] |
m [g] |
x |
|
logc1 |
1 |
26,0 |
18,2 |
2,0 |
0,0018 |
-3,1079 |
-0,5850 |
2 |
23,5 |
16,4 |
2,0 |
0,0102 |
-3,1480 |
-0,6289 |
3 |
19,3 |
13,5 |
2,0 |
0,00116 |
-3,2365 |
-0,7144 |
4 |
14,2 |
9,5 |
2,0 |
0,00094 |
-3,3279 |
-0,8477 |
5 |
9,7 |
5,7 |
2,0 |
0,0008 |
-3,3979 |
-1,0132 |
Z kolei sporządzony wykres zależności ![]()
= f(logc), z punktu przecięcia prostej z osią rzędnych odczytujemy wartości log k, a z tangensa kąta nachylenia wartości 1/n.
log k = -2,7269
k = 0,001875
1/n =tgα = 0,682
n = 1,4662
OMÓWIENIE WYNIKÓW
Korzystając z zależności ![]()
= f(logc) wykreśliliśmy izoterme adsorpcji Freundlicha dla układu: wodny roztwór kwasu organicznego(kwas octowy) - węgiel aktywny w temperaturze pokojowej z wykresu odczytaliśmy wartości współczynnika k i kąt α zawarty między izotermą a osią odciętych. Kąt α posłużył nam do dalszych obliczeń stosunku 1/n.
Uzyskane wyniki potwierdzają przydatność równania Freundlicha do opisu adsorpcji substancji roztworu. Znaleziona wartość współczynnika n = 1,4662 leży w przedziale typowym dla procesów adsorpcji na węglu aktywnym.
Na podstawie współczynnika k i zależności 1/n na podstawie wzoru ![]()
możemy z łatwością wyznaczyć liczbę moli lub miarę substancji zaadsorbowanej na gram adsorbenta.
LITERATURA
I.Barycka, K.Skudlarski „Podstawy chemi „(Wrocław 1993 r.)
Adam Bielański „ Chemia fizyczna „(PWN Warszawa 1980r.)
Stanisław Bursa „Chemie fizyczna” (PWN Warszawa 1976r.)
Wyszukiwarka
Podobne podstrony:
izoterma adsorbcji, studia, chemia, chemia fizyczna, sprawozdania, sprawka
adsorbcja, Weterynaria, Chemia
OBLICZENIA DO ADSORBCJI, Weterynaria, Chemia
wyznaczanie izoterm adsorbcji substancji powierzchniowo czynnych, Chemia fizyczna, laboratorium, Che
Chemia Bionie wyk1
chemia powt
Wykład Chemia kwantowa 11
wyklad z czwartku chemia fizycz dnia19 marca
chemia(1) 3
Chemia węglowodory
Chemia organiczna czesc I poprawiona
ERGONOMIA chemia
chemia organiczna wykład 6
Chemia wyklad I i II (konfiguracja wiÄ…zania Pauling hybrydyzacja wiazania pi i sigma)
Chemia procesu widzenia
więcej podobnych podstron