Inwersja sacharozy
Celem ćwiczenia jest zbadanie kinetyki inwersji sacharozy. Proces ten polega na rozkładzie sacharozy na równomolową mieszaninę glukozy i fruktozy.
C12H22O11 + H2O → C6H12O6 (glukoza) + C6H12O6 (fruktoza)
Reakcja ta jest katalizowana przez jony wodorowe. Wobec nadmiaru wody (roztwory rozcieńczone) można ją opisać równaniem kinetycznym I rzędu, uznając stężenie wody za stałe.
![]()
(1)
gdzie c jest stężeniem sacharozy po czasie t. Rozwiązaniem tego równania jest wyrażenie
![]()
(2)
gdzie ![]()
jest początkowym stężeniem sacharozy, c jest stężeniem sacharozy po czasie t; różnica ![]()
odpowiada stężeniu produktu.
Równanie Ostawalda (patrz załącznik „Elementy katalizy”) dla badanej reakcji zapiszemy w postaci
![]()
Rozwiązaniem tego równania jest zależność
![]()
(Zobacz: załączniki “Podstawy kinetyki chemicznej”oraz „Elementy katalizy”)
Postęp reakcji inwersji można obserwować mierząc kąt skręcenia płaszczyzny polaryzacji światła. Kąt skręcania wywoływanego przez związek optycznie czynny jest zależny od stężenia i grubości warstwy:
α = [α] l c (3)
gdzie: [α] jest skręcalnością właściwą, c - stężeniem w gramach/cm3, a l grubością wyrażoną w decymetrach.
Kąt ten ulega zmianie z powodu różnic skręcalności właściwej substratu i produktów: sacharoza jest prawoskrętna, natomiast cukier zinwertowany jest lewoskrętny. (Glukoza jest prawoskrętna a sacharoza - lewoskrętna, jednak kat skręcenia fruktozy jest większy niż glukozy i ich równomolowa mieszanina jest lewoskrętna.)
Oznaczmy kąt skręcenia sacharozy jako ![]()
, a kąt skręcenia charakterystyczny dla cukru inwertowanego jako ![]()
. Wartość ![]()
oblicza się na podstawie empirycznej zależności
![]()
(4)
gdzie tC jest temperaturą otoczenia w stopniach Celcjusza.
Po czasie t reakcji kąt skręcenia ![]()
będzie sumą udziałów wnoszonych przez substrat i produkt reakcji:
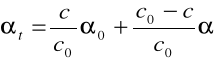
(5)
Z równania tego wynika, że
![]()
(6)
Podstawiając ostatnie wyrażenie do rozwiązania równania kinetycznego (2) otrzymujemy
![]()
(7)
Aby wyznaczyć stałą szybkości reakcji na podstawie wyników obserwacji kąta skręcenia, należy, więc sporządzić wykres zależności prostoliniowej,
![]()
(8)
której współczynnik kierunkowy wynosi (-![]()
).
Zagadnienia do opracowania
1. Pojęcie szybkości reakcji chemicznej.
2. Zależność szybkości reakcji od stężeń substratów, rząd reakcji, cząsteczkowość reakcji.
3. Równanie kinetyczne dla reakcji prostych różnych rzędów.
4. Wyznaczanie stałej szybkości.
5. Zależność stałej szybkości reakcji od temperatury. Energia aktywacji.
6. Kataliza i jej rodzaje (kataliza jedno-, wielo- i mikroheterogeniczna, kataliza kwasowo-zasadowa, ujemna, autokataliza).
7. Czynność optyczna i jej związek ze strukturą substancji.
8. Kąt skręcenia płaszczyzny polaryzacji światła, skręcalność właściwa.
9. Reakcja inwersji sacharozy, wyznaczanie stałej szybkości reakcji na podstawie pomiarów kąta skręcenia.
10. Kinetyka reakcji katalizowanych, równanie Ostwalda.
11. Kataliza i jej rodzaje (kataliza jedno, - wielo- i mikroheterogeniczna, kataliza kwasowo-zasadowa, ujemna, autokataliza).
Literatura
1. Załącznik “Podstawy kinetyki chemicznej” oraz „Elementy katalizy”).
2. Atkins P. W.: Podstawy chemii fizycznej, PWN, Warszawa1999, s. 283 - 324.
3. Atkins P. W.,: Chemia fizycznaj, PWN, Warszawa 2001, s. 735 - 762.
4. Pigo* K., Ruziewicz Z.: Chemia fizyczna, PWN, Warszawa 1980, s. 354*357, 390*396.
5. Morrison R. T., Boyd R. N., Chemia organiczna, tom I, PWN Warszawa, 1985, str. 154 - 157.
Aparatura
Polarymetr z lampą sodową, stopery, szkło laboratoryjne.
Odczynniki
Sacharoza, HCl o stężeniu 1 mol/dm3, 2 mol/dm3, 3 mol/dm3, 4 mol/dm3.
Wykonanie ćwiczenia
1. Sporządzić 100 cm3 20% roztworu sacharozy w wodzie destylowanej.
2. Roztworem tym napełnić rurkę polarymetru i odczytać wartość kąta skręcenia. Kąt ten oznaczymy jako ![]()
ponieważ w dalszym toku doświadczenia wyjściowy roztwór sacharozy zostanie dwukrotnie rozcieńczony.
3. Zmieszać 12 cm3 roztworu sacharozy i 12 cm3 roztworu kwasu solnego o stężeniu wynoszącym kolejno: 1 mol/dm3, 2 mol/dm3, 3 mol/dm3, 4 mol/dm3. Jako czas zerowy przyjąć moment zmieszania roztworów.
4. Otrzymane roztwory przelać do rurek polarymetrycznych Należy uważać, aby pod szkiełkiem nie pozostawić pęcherzyka powietrza. Odczytywać kąty skręcenia płaszczyzny polaryzacji światła, co 3 - 5 minut w przypadku 3 i 4 M HCl i 8 -12 min w przypadku 3 i 4 M HCl. Wykonać po 10 oznaczeń dla każdego roztworu.
4. Wyniki pomiarów zestawić w tabelach:
Stężenie HCl ………….
t [min] |
αt |
αt - α∞ |
ln(αt - α∞) |
|
|
|
|
Opracowanie wyników
1. Obliczyć kąt skręcenia cukru zinwertowanego z równania empirycznego.
2. Dla każdej serii pomiarów narysować wykresy zależności ln(αt - α∞) od czsu i z nachyleń wykresów obliczyć wartości stałych szybkości reakcji inwersji sacharozy, ![]()
, przy różnych stężeniach katalizatora.
3. Wyniki obliczeń zebrać w tabeli:
Stężenie HCl [mol/dm3] |
Stała szybkości |
|
|
4. Narysować wykres zależności doświadczalnie wyznaczonej stałej szybkości ![]()
od stężenia HCl i stwierdzić, czy jest on prostoliniowy. Wyznaczyć wartość stałej szybkości reakcji biegnącej bez katalizatora (jako punkt przecięcia z osią ![]()
, ekstrapolując prostą do zerowego stężenia HCl) i reakcji katalitycznej (z nachylenia prostoliniowego odcinka krzywej doświadczalnej).
Dyskusja wyników
Przedstawić badaną reakcję chemiczną. Opisać sposób oznaczania aktualnego stężenia sacharozy w mieszaninie reakcyjnej metodą pomiaru kąta skręcenia płaszczyzny światła spolaryzowanego przez związki optycznie czynne.
Przedyskutować mechanizm działania katalizatora w badanej reakcji.
Na podstawie uzyskanych wykresów stwierdzić, czy reakcja inwersji sacharozy jest reakcją I rzędu.
Porównać stałe szybkości reakcji przebiegających z różną ilością katalizatora. Zbadać wpływ stężenia katalizatora na stałą szybkości reakcji. Sprawdzić, czy układ spełnia równanie Oswalda, wdług, którego stała szybkości reakcji jest liniową funkcją stężenia katalizatora. Porównać wartości stałej szybkości reakcji biegnącej bez katalizatora i reakcji katalitycznej.
1
Wyszukiwarka
Podobne podstrony:
MEZOZOICZNE NIESPODZIANKI, NAUKA, WIEDZA
Długi wstęp, NAUKA, WIEDZA, Bazy danych
WIRUS OPRYSZCZKI NIEBEZPIECZNY W PÓŹNEJ CIĄŻY, NAUKA, WIEDZA
PLANETY SIĘ BRONIĄ, NAUKA, WIEDZA
EFEKT GREJPFRUTA WYJAŚNIONY, NAUKA, WIEDZA
SPOSÓB NA KRWIOPIJCĘ, NAUKA, WIEDZA
SPEKTROFOTOMETRYCZNE OZNACZENIE ŻELAZA W POSTACI TIOCYJANIANU ŻELAZA, NAUKA, WIEDZA
ASTRONAUTÓW OCALIŁ DŁUGOPIS, NAUKA, WIEDZA
DIALOG I SPOTKANIE JAKO MECHANIZMY KSZTAŁTOWANIA WARTOŚCI, NAUKA, WIEDZA
LUDZKA WYJĄTKOWOŚĆ, NAUKA, WIEDZA
ELEMENTY KATALIZY, NAUKA, WIEDZA
POWRÓT LODOWCÓW, NAUKA, WIEDZA
KLONOWANIE, NAUKA, WIEDZA
SPRAWNY SAMOCHÓD ALE CZY SPRAWNY KIEROWCA, NAUKA, WIEDZA
PAMIĘĆ NA ŻYCZENIE, NAUKA, WIEDZA
POLSKA LUDOWA 1944-1989, NAUKA, WIEDZA
LEGENDY MOTORYZACJI, NAUKA, WIEDZA
VOLKSWAGEN-SAMOCHÓD DLA LUDU, NAUKA, WIEDZA
NA STRAŻY PAMIĘCI, NAUKA, WIEDZA
więcej podobnych podstron