ZAKŁAD CHEMII FIZYCZNEJ
LABORATORIUM STUDENCKIE
SPRAWOZDANIE
Ćwiczenie nr 14
„Wyznaczanie stałej równowagi reakcji ”
WYKONYWALI:
Monika Matusik
Sebastian Leśniewski
Inżynieria Chemiczna i Procesowa
Grupa II rok II
marzec `99
celem ćwiczenia jest wyznaczenie stałej równowagi reakcji i wykazanie że stała ta nie zależy od stężenia reagentów.
![]()
Doświadczenie prowadzi się w warunkach, w których można przyjąć , że przybliżona stała Kc ma wartość zbliżoną do stałej termodynamicznej Ka.
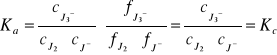
W warunkach doświadczenia stężenie wolnego jodu w stanie równowagi reakcji jest bardzo małe i można przyjąć że ![]()
. Dla jonów ![]()
i oraz ![]()
. Wielkości te można określić z wzoru Debye'a - Huckela (dla rozcieńczonych wodnych roztworów elektrolitów w temperaturze 298K).
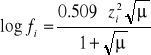
Siłę jonową roztworu μ definiuje się wzorem
![]()
gdzie:
zi -wartościowość jonu;
ci -stężenie molowe jonu w roztworze.
Ponieważ wzór nr 3 nie uwzględnia indywidualnych cech jonów , więc w tym samym roztworze współczynniki aktywności jonów ![]()
i ![]()
są jednakowe , zatem stosunek ![]()
i wyrażenie ![]()
. Wynika z stąd, że Ka=Kc .
Rekcję prowadzi się w dwóch układach różniących się stężeniem jodu. Stan równowagi ustala się szybko. Ilość jodu w mieszaninie reakcyjnej oznacza się za pomocą miareczkowania roztworem tiosiarczanu sodowego. Jednak w ten sposób oznacza się całkowitą zawartość jodu J2 i J3- w roztworze wodnym.
![]()
oraz
![]()
ponieważ jony J3- są nie trwałe i rozpadają się w cfzasie miareczkowania.
Do obliczenia stałej równowagi należy znać oddzielnie stężenie wolnego J2 i stężenie jonu trój jonowego J3- w stanie równowagi. Należy więc w inny jeszcze sposób oznaczyć ilość jednego z tych reagentów . Otóż stężenie jonu w mieszaninie reakcyjnej można wyznaczyć na podstawie prawa podziału Nernsta, stąd wynika nazwa metody - metoda podziału. W tym celu wodny roztwór, w którym zachodzi reakcja chemiczna, wytrząsa się z czterochlorkiem węgla. Praktycznie tylko J2 rozpuszcza się CCl4 i przechodzi do warstwy organicznej w takich ilościach , że stosunek jego stężeń w obu warstwach równa się współczynnikowi podziału. Ustala się równowaga dwóch procesów : równowaga reakcji chemicznej l. w roztworze wodnym oraz równowaga podziału J2 pomiędzy wodą i CCl4. Stężenie J2 w CCl4 w stanie równowagi obu procesów oznacza się również za pomocą miareczkowania roztworem Na2S2O3 . Znając współczynnik podziału J2 pomiędzy CCl4 i wodą oraz stężenie J2 w warstwie czterochlorkowej oblicza się stężenie wolnego J2 w warstwie wodnej. Na tej podstawie można już obliczyć stężenia poszczególnych reagentów oraz stałą równowagi.
TABELA WYNIKÓW:
Wyniki |
Rozdzielacz 1 |
Rozdzielacz 2 |
|
3.65 |
7.3 |
|
3.2 |
6.05 |
|
3.65*10-3 |
7.3*10-3 |
|
3.2*10-4 |
6.05*10-4 |
|
3.65*10-5 |
7.3*10-5 |
|
2.835*10-4 |
5.32*10-4 |
|
0.1 |
0.099 |
K |
-2.844*10-3 |
-5.352*10-3 |
1
3
Wyszukiwarka
Podobne podstrony:
Cwiczenie13, Studia, Politechnika
cwiczenie29, Studia, Politechnika
cwiczenie18, Studia, Politechnika
cwiczenie20, Studia, Politechnika
Ćwiczenie 00, Politechnika Lubelska, Studia, Studia, fizyka
Cwiczenie23, Studia, laborki fizyka (opole, politechnika opolska), Sprawozdania
Plan marketingowy Nestle 2, Studia - Politechnika Śląska, Zarządzanie, I STOPIEŃ, Marketing, Ćwiczen
Ćwiczenie krzywki5, Politechnika Lubelska, Studia, Studia, organizacja produkcji, laborki-moje, Wydz
Klub Pomarańcza, Studia - Politechnika Śląska, Zarządzanie, I STOPIEŃ, Nauki o organizacji, Ćwiczeni
Zasoby materialne i niematerialne w organizacji, Studia - Politechnika Śląska, Zarządzanie, I STOPIE
przykładowe pytania z kolokwium z ćwiczeń odpowiedzi, Politechnika Opolska Budownictwo, Studia Budow
cwiczeniadynamika9, Studia PWR Tranposrt Mechaniczny Politechnika Wrocławska, SEMESTR V, Mechanika
Ćwiczenie nr 13a, Studia, Politechnika
Biuro Ochrony Rządu, Studia - Politechnika Śląska, Zarządzanie, I STOPIEŃ, Nauki o organizacji, Ćwic
ĆWICZE~3, 1 STUDIA - Informatyka Politechnika Koszalińska, finish, fizyka1, fiza, Fizyka 2, 73
eihp ściaga, Studia - Politechnika Śląska, Zarządzanie, I STOPIEŃ, Ergonomia i higiena pracy, Ćwicze
Telekomunikacja Polska SA, Studia - Politechnika Śląska, Zarządzanie, I STOPIEŃ, Nauki o organizacji
więcej podobnych podstron