Sprawozdanie z ćwiczenia nr 29.
Temat ćwiczenia: Wyznaczanie ciepła rozpuszczającego się kwasu
bursztynowego w wodzie.
WSTĘP.
Celem ćwiczenia jest wyznaczenie ciepła rozpuszczania kwasu
bursztynowego - substancji trudno rozpuszczalnej metodą pomiaru zależności rozpuszczalności od temperatury.
W procesie rozpuszczania składniki układu przechodzą od stanu początkowego, który tworzą zazwyczaj fazy czyste, w stan końcowy będący ich roztworem. Przemianą tym towarzyszą na ogół efekty cieplne, które tłumaczy się zerwaniem wiązań cząsteczkowych lub nawet wewnątrzcząsteczkowych utrzymujących cząsteczki w fazach wyjściowych i powstaniem nowych wiązań między cząsteczkami znajdującymi się w roztworze. Podczas rozpuszczania często występują również różnorodne zjawiska chemiczne, takie jak dysocjacja, asocjacja i solwatacja. Oba te procesy cząstkowe - zerwanie starych wiązań i utworzenie nowych wyznaczają energetykę procesu. Zwykle zburzenie sieci krystalicznej substancji stałej wymaga dostarczenia do układu energii, a w czasie drugiego etapu energia jest wydzielana. Sumaryczny efekt energetyczny procesu rozpuszczania zależy od wielkości efektów wspomnianych etapów.
Podstawową wielkością charakteryzującą energetykę procesu rozpuszczania jest ciepło rozpuszczania, które w warunkach ustalonego ciśnienia i temperatury równa się entalpii rozpuszczania. Entalpii rozpuszczania nie można w zasadzie obliczyć, zwykle nie są znane wartości cząstkowych entalpii molowych, bądź entalpii mieszania składników roztworu. Rozróżnia się pierwsze i ostatnie ciepło rozpuszczania.
Pierwsze ciepło rozpuszczania jest to ilość ciepła wymieniona między układem a otoczeniem podczas rozpuszczania 1 mola substancji j w roztworze tak rozcieńczonym, że dalsze jego rozcieńczenie nie pociąga za sobą żadnego już efektu cieplnego. Pierwsze ciepło rozpuszczania jest wielkością charakterystyczną dla roztworu i ponieważ zależy od stężenia roztworu, jest zestawione w tablicach.
Ostatnie ciepło rozpuszczania jest to graniczna wartość cząsteczkowego molowego ciepła rozpuszczania 1 mola substancji rozpuszczonej j w roztworze nasyconym. Ciepło rozpuszczania jest funkcją temperatury. Jeżeli mamy trudno rozpuszczalną substancję i jej rozpuszczalność w temperaturze T wynosi r [moli/1000g rozpuszczalnika] to zmiana entalpii swobodnej procesu rozpuszczania. Ciepło rozpuszczania trudno rozpuszczalnej substancji jest cząstkowym molowym ciepłem rozpuszczania. Dla substancji trudno rozpuszczalnych ciepła rozpuszczania molowe i cząsteczkowe molowe różnią się nieznacznie.
OPRACOWANIE WYNIKÓW
OBLICZANIE ROZPUSZCZALNOŚCI KWASU BURSZTYNOWEGO W WODZIE DLA POSZCZEGÓLNYCH TEMPERATUR Z ZALEŻNOŚCI:
![]()
gdzie:
Vśr - średnia objętość roztworu NaOH zużytego do miareczkowania [cm3]
Vp - objętość próbki wzietej do miareczkowania [cm3], Vp = 2 cm3
NNaOH - miano roztworu NaOH użytego do miareczkowania [mol/dm3],
NNaOH = 0,5 mola/dm3
Temperatura |
Objętość NaoH [cm3] |
Rozpuszczalność r [mol/dm3] |
Ln r |
|||
[0C] |
[K] |
V1 |
V2 |
Vśr |
|
|
|
|
|
|
|
|
|
50 |
323 |
13,80 |
14,0 |
13,90 |
1,738 |
0,553 |
45 |
318 |
11,30 |
11,50 |
11,40 |
1,425 |
0,354 |
40 |
313 |
9,40 |
9,50 |
9,45 |
1,181 |
0,166 |
35 |
308 |
7,85 |
7,95 |
7,90 |
0.988 |
-0,012 |
30 |
303 |
6,40 |
6,50 |
6,45 |
0,806 |
-0,216 |
25 |
298 |
5,50 |
5.40 |
5,45 |
0,681 |
-0,384 |
20 |
293 |
5,00 |
5,00 |
5,00 |
0,625 |
-0,470 |
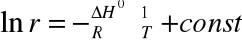
KORZYSTAJĄC Z RÓWNANIA:
![]()
Wyznaczono zmianę entalpii w procesie rozpuszczania kwasu bursztynowego, po wyznaczeniu współczynnika kierunkowego prostej metodą najmniejszych kwadratów:
Współczynnik b wyznacza się z zależności:
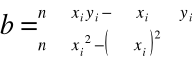
Lp |
xi [10-3] |
yi |
xiyi [10-3] |
xi2 [10-6] |
|
|
|
|
|
1 |
3,096 |
0,553 |
1,712 |
9,585 |
2 |
3,145 |
0,354 |
1,113 |
9,891 |
3 |
3,195 |
0,166 |
0,530 |
10,208 |
4 |
3,247 |
-0,012 |
-0,039 |
10,543 |
5 |
3,300 |
-0,216 |
-0,713 |
10,890 |
6 |
3,356 |
-0,384 |
-1.289 |
11,263 |
7 |
3,413 |
-0,470 |
-1,604 |
11,649 |
|
|
|
|
|
Suma: |
22,752 |
-0,009 |
-0,290 |
74,029 |
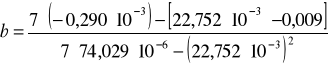
![]()
![]()
![]()
3. WYKRES ZALEŻNOŚCI ln r = f(1/T):

![]()
![]()
![]()
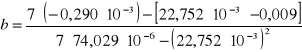
![]()
![]()
![]()

Wyszukiwarka
Podobne podstrony:
Cwiczenie13, Studia, Politechnika
cwiczenie14, Studia, Politechnika
cwiczenie18, Studia, Politechnika
cwiczenie20, Studia, Politechnika
Ćwiczenie 00, Politechnika Lubelska, Studia, Studia, fizyka
Cwiczenie23, Studia, laborki fizyka (opole, politechnika opolska), Sprawozdania
Plan marketingowy Nestle 2, Studia - Politechnika Śląska, Zarządzanie, I STOPIEŃ, Marketing, Ćwiczen
Ćwiczenie krzywki5, Politechnika Lubelska, Studia, Studia, organizacja produkcji, laborki-moje, Wydz
Klub Pomarańcza, Studia - Politechnika Śląska, Zarządzanie, I STOPIEŃ, Nauki o organizacji, Ćwiczeni
Zasoby materialne i niematerialne w organizacji, Studia - Politechnika Śląska, Zarządzanie, I STOPIE
przykładowe pytania z kolokwium z ćwiczeń odpowiedzi, Politechnika Opolska Budownictwo, Studia Budow
cwiczeniadynamika9, Studia PWR Tranposrt Mechaniczny Politechnika Wrocławska, SEMESTR V, Mechanika
Ćwiczenie nr 13a, Studia, Politechnika
Biuro Ochrony Rządu, Studia - Politechnika Śląska, Zarządzanie, I STOPIEŃ, Nauki o organizacji, Ćwic
ĆWICZE~3, 1 STUDIA - Informatyka Politechnika Koszalińska, finish, fizyka1, fiza, Fizyka 2, 73
eihp ściaga, Studia - Politechnika Śląska, Zarządzanie, I STOPIEŃ, Ergonomia i higiena pracy, Ćwicze
Telekomunikacja Polska SA, Studia - Politechnika Śląska, Zarządzanie, I STOPIEŃ, Nauki o organizacji
więcej podobnych podstron