Opracowanie wyników ćw. 11:
Sprawdzenie krzywej cechowania osi x programu spektrometru przy wykorzystaniu pomiaru długości fali helu (dla czasu naświetlania 2000 ms w programie):
Aproksymacja liniowa zależności długości fali rzeczywistej od długości fali mierzonej przeprowadzona przez program Graph doprowadziła do otrzymania zależności:
λrz = 1,012λm - 5,219
Wyniki długości fali wodoru (skorygowane)
dł. zmierzona |
dł. skorygowana |
1/dł. fali |
natężenie |
1/n2 |
658,3 |
661 |
0,001513 |
698 |
0,111111 |
589,1 |
591 |
0,001692 |
1156 |
0,0625 |
486,9 |
487,5 |
0,002051 |
317 |
0,04 |
462,9 |
463,2 |
0,002159 |
299 |
0,027778 |
Wykres zależności 1/długość fali = f(1/n2)
Aproksymowana zależność wyraża się wzorem:
1/λ = -0,0078(1/n2) + 0,0023
Przekształcając następujący wzór możemy obliczyć stałą Rydberga:
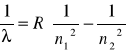
![]()
gdzie za n podstawiamy kolejno 3,4,5,6, a y jest to odwrotność dł. fali podana w m-1
Dla λ = 661 nm - R = 10892907 [1/m]
Dla λ = 591 nm - R = 9025013 [1/m]
Dla λ = 487,5 nm - R = 9767533 [1/m]
Dla λ = 463,2 nm - R = 9714275 [1/m]
Średnia - RŚR = 9849932 [1/m]
Do obliczeń przyjmę R = 9,85·106 m-1
Energia jonizacji atomu wodoru
Korzystamy ze wzoru Ej = Rhc, gdzie h - stała Plancka
Ej = 9,85·106 m-1 · 6,626·10-34 Js · 3 · 108 m/s = 1,958 · 10-18 = 12,225 eV
Błąd pomiaru stałej Rydberga
Δλ = 3 nm - rozdzielczość spektometru
tablicowa RH = 1,097 · 107 [m-1]
wyznaczona RŚR = 9,85·106 [m-1]
ΔR = 11%
Dyskusja błędów i wnioski:
Błędy pomiarów wynikały w tym ćwiczeniu z:
nieidealnego wyizolowania gazu wewnątrz próbki (szczególnie na przykładzie wodoru)
mechanicznych zakłóceń podczas pomiarów (poruszanie spktromatrem itp).
Jak widać wyznaczone wartości rozmijają się z tablicowymi wartościami w granicach 10-11%. Energia jonizacji wodoru w rzeczywistości to 13,6 eV, co różni się od otrzymanego wyniku o 10%. Podobnie stała Rydberga (również wyznaczona z niedomiarem).
Analiza widma wodoru
Jak widać z wykresu, widmo powstałem po umieszczeniu serii pomiarowej na wykresie dało wykres zbyt „poszarpany” jak na typowe widmo wodoru. Zapewne było to spowodowane nieczystością próbki z wodorem, w której prawdopodobnie znalazło się powietrze. Poniżej zamieszczam maksima odczytane wykresu i porównane do wartości tablicowych dla wodoru, azotu i tlenu (głównych składników powietrza):
Wodór: 410 nm (mało widoczne), 434 nm, 486 nm(zakłócone orzez maksima innych gazów), 656 nm (bardzo wyraźne).
oraz wybrane bardziej widoczne na wykresie maksima (za: http://astro.u-strasbg.fr/~koppen/discharge/)
Azot: 399 nm, 463 nm (rozpoznawalne na wykresie), 501 nm , 661 nm (bardzo wyraźne)
Tlen: 419 nm, 466 nm (nakłada się z maksimem widma azotu), 615 nm
Wniosek: Próbka z wodorem była zanieczyszczona powietrzem, co mogło wypatrzeć wynik (bardzo duże maksimum dla 661 nm - w rzeczywistości nie dla wodoru, a dla azotu)
Porównanie widma żarówki tradycyjnej i świetlówki
Zarówno żarówka jak i świetlówka są używane w elektrycznych instalacjach oświetleniowych codziennego użytku, jednak natura emitowanego przez nie promieniowania jest różna. Dla żarówki wolframowej emitowane jest promieniowanie cieplne. Temperatura, do której pod wpływem pradu elektrycznego rozgrzewa sie wolframowy żarnik jest tak dobrana, żeby maksimum natężenia promieniowania, zgodnie z prawem Wiena, wypadało w zakresie swiatła widzialnego. Uzyskany obraz widmowy opisuje model Plancka. Dla lampy rteciowo - argonowej promieniowanie emitowane jest w wyniku przeskakiwania elektronów w atomach z orbit dalszych na bliższe - zgodnie modelem modelem Bohra. Dlatego maksima natężenia przypadaja dla pojedynczych, scisle okreslonych długości fali, co daje „poszarpany” wykres z wyraźnymi maksimami, różny od „gładkiego” wykresu dla tradycyjnej żarówki.
Wniosek: Jeżeli widzimy gołym okiem, że 2 żarówki świecą bardo podobnym światłem, to wcale nie oznacza że widma te mają taką postać i naturę.
Wyszukiwarka
Podobne podstrony:
wspolczynnik zlamania sprawozdanie, Elektrotechnika AGH, Semestr II letni 2012-2013, Fizyka II - Lab
poziomy energetyczne sprawozdanie, Elektrotechnika AGH, Semestr II letni 2012-2013, Fizyka II - Labo
hall sprawozdanie, Elektrotechnika AGH, Semestr II letni 2012-2013, Fizyka II - Laboratorium, labork
indukcyjnosc sprawozdanie, Elektrotechnika AGH, Semestr II letni 2012-2013, Fizyka II - Laboratorium
RLC sprawozdanie, Elektrotechnika AGH, Semestr II letni 2012-2013, Fizyka II - Laboratorium, laborki
sprawozdanie05, Elektrotechnika AGH, Semestr II letni 2012-2013, Fizyka II - Laboratorium, laborki,
Sprawozdanie10, Elektrotechnika AGH, Semestr II letni 2012-2013, Fizyka II - Laboratorium, laborki,
sprawozdanie08, Elektrotechnika AGH, Semestr II letni 2012-2013, Fizyka II - Laboratorium, laborki,
Cwiczenie 3 - sprawozdanie, Elektrotechnika AGH, Semestr II letni 2012-2013, Fizyka II - Laboratoriu
sprawozdanie5, Elektrotechnika AGH, Semestr II letni 2012-2013, Fizyka II - Laboratorium, laborki, l
polaryzacja sprawozdanie, Elektrotechnika AGH, Semestr II letni 2012-2013, Fizyka II - Laboratorium,
sprawozdanie09, Elektrotechnika AGH, Semestr II letni 2012-2013, Fizyka II - Laboratorium, laborki,
SPRAWOZ1, Elektrotechnika AGH, Semestr II letni 2012-2013, Fizyka II - Laboratorium, laborki, Labork
regulator cyfrowy sprawozdanie, Elektrotechnika AGH, Semestr IV letni 2013-2014, Teoria Sterowania i
3 W LEPKO CIECZY, Elektrotechnika AGH, Semestr II letni 2012-2013, Fizyka II - Laboratorium, labor
PUZON, Elektrotechnika AGH, Semestr II letni 2012-2013, Fizyka II - Laboratorium, laborki, Laborki s
WICZENIE8 12 F, Elektrotechnika AGH, Semestr II letni 2012-2013, Fizyka II - Laboratorium, laborki,
Sprawozdanie lab3, Elektrotechnika AGH, Semestr II letni 2012-2013, Fizyka II - Laboratorium, labork
35 Elektroliza2222, Elektrotechnika AGH, Semestr II letni 2012-2013, Fizyka II - Laboratorium, labor
więcej podobnych podstron