Podstawowe własności tworzyw sztucznych a)mała gęstość (1cm3 waży od 1 do 1,8 grama) b)odporne na korozje c)większość tworzyw jest nieszkodliwa pod względem sanitarnym d)drobne właściwości jako dielektryki e)bardzo łatwo i ładnie się zabarwiają (bywają przezroczyste) f)posiadają szerokie spektrum własności mechanicznych, mogą być twarde i wytrzymałe lub giętkie i sprężyste. Wiele tworzyw sztucznych pod względem wytrzymałości przewyższa żeliwa i brązy. g)używa się ich jako materiałów łożyskowych (łożyska poliamidowe mogą pracować dłuższy czas bez smarowania) h)dobre własności termoizolacyjne(zły przewodnik ciepła, a tworzywa piankowe i porowate posiadają współczynnik przewodnictwa cieplnego, który jest 10x niższy niż w zwykłych polimerach) i)łatwo otrzymuje się kształt z form (daje się łatwo formować) j)Ujemną stroną tworzyw sztucznych jest ich niska odporność cieplna, dla większości jest to 10-1200C. W chwili obecnej są niektóre tworzywa odporne do 4000C i mogą pracować w temp do -700C. k)Mała twardość (w większości) l) tworzywa starzeją się szybko, pełzania (zmiany ich własności).
Istnieje duża gama materiałów na bazie polimerów. Na bazie polimerów termo i chemoutwardzalnych produkuje się materiały konstrukcyjne, sprzęt domowy, części maszyn, różne odlewnicze modele. Materiałem bazowym są najczęściej żywice epoksydowe, aminoplasty i termoplasty. W postaci proszkowej wprowadza się kwarc, celuloze, mączkę drzewną, grafit. Popularne są laminaty, obicia wyposażenia wnętrza pojazdów. W elektrotechnice używa się tekstolitu złożonego z żywicy i tkaniny. Często używa się ebonitu- produkt wulkanizacji kauczuku z dużą ilością siarki
Podstawowym elementem budowy fibry jest celuloza dodając chlorek cynku albo kwas siarkowy: - odporne na ścieranie (w bloku) i można ją obrabiać skrawaniem - termoplast odkształca się pod obciążeniem w temp 70-800C - trudno się zapala, wolno się tli (zapach papieru). -odporna na rozpuszczalniki, bazę. Jest higroskopijna (pochłania wodę) - robi się okładziny hamulcowe, uszczelki, tarcze szlifierskie i drobne elektryczne części.
GUMA (KAUCZUK + SIARKA)
Wyroby techniczne z gumy produkowane w procesie cieplnym nazywamy wulkanizacją. Podstawowym składnikiem do otrzymania wyrobów z gumy jest kauczuk, który nadaje gumie charakterystyczne dla niej własności sprężysto-elastyczne. Kauczuk naturalny jest węglowodorem nienasyconym, otrzymanym przez koagulacje lateksu, czyli soku kauczukonośnych drzew wilczomlecznych rosnących w brazylii, południowowschodniej azji i na malajach.
dodatkowo w kauczuku znajdują się jeszcze inne substancje w ilości około 6-8%takie jak: żywica, sole nieorganiczne, białka, węglowodany. Kauczuki syntetyczne są to wielkocząsteczkowe związki otrzymane przez polimeryzacje monomerów takich jak butapren, izoprym, przez ich kopolimeryzację z innymi monomerami jak stylen i przez polikondensację. 80% światowej produkcji to kauczuki syntetyczne. Najczęściej produkowanymi są kauczuk chloroprenowy-styreno, do celów specjalnych - kosztowne kauczuki - butylowy - silnikowy - kretanowy. Produkuje się też z ropy naftowej. W trakcie wulkanizacji kauczuku temp 140-1800C tworzą się w kauczuku wiązania poprzeczne i kauczuk przechodzi w gumę lub ebonit (twardą gumę). Jako materiały do wulkanizacji używa się najczęściej siarki. Im wyższy % siarki w gumie tym wyższa gęstość i twardość oraz większe usieciowienie ale mniejsza elastyczność. Ebonit utrzymuje się przy max wkładzie siarki(od 30-50%), a zwykła guma (5-8% siarki). Do mieszanki gumowej prócz siarki wchodzą napełniacze, palstikatory, środki stabilizujące przeciwdziałające starzeniu się gumy oraz barwniki. Wyroby z gumy często są zbrojone szkłem, siatką metalową.
Cechy gumy: -elastyczność -odporność na rozrywanie -dobre właściwości izolacyjne
Zastosowanie gum: ochrona części maszyn, izolacje, dekoracje.
Odporność od 130-1500C (ogólnie) specjalne do 3000 uszczelki od -35-500C. Małą gęstość jest zaletą.
KLEJE: są to substancje otrzymywane na bazie polimerów i ich zadaniem jest tworzenie podczas zespolenia niewielkich warstw silnie związanych z materiałami, które mają łączyć. Połączenie klejowe są odporne na wpływy atmosferyczne, nie ulegają korozji, zapewniają szczelność i hermetyczność. Kleje dobrze radzą sobie z wysokimi i niskimi temp i dość wytrzymałe jest użycie materiałów. Ujemna cecha -niewysoka trwałość termiczna przy długotrwałej eksploatacji oraz niska wytrzymałość przy niesymetrycznym obciążeniu klejonych materiałów. Do produkcji klejów używa się termoplastycznych lub termoutwardzalnych polimerów. Kleje otrzymane z żywic termoutwardzalnych zawierają utwardzacze, substancje przyspieszające proces twardnienia, plastyki. Kleje tego typu są utwardzane na zimno lub na gorąco. Kleje niskotemperaturowe, przygotowuje się bezpośrednio przed użyciem dodając utwardzacz i przyspieszacz. Kleje do klejenia na gorąco są to kleje w puszkach (trwałość kilka miesięcy). W celach technicznych najczęściej stosuje się kleje wyprodukowane na bazie żywic epoksydowych. Używa się ich do łączenia metali i stopów, metali z materiałami niemetalowymi. Pracują w wysokim zakresie temp (-250- 8000C). kleje na bazie żywic mogą być w postaci ciekłej, jako pasta lub folia. Inną grupą klejów są kleje kauczukowe, fosforanowe i krzemoorganiczne. Stosuje się je w przemyśle elektrotechnicznym.
OCZYSZCZANIE POWIERZCHNI
Mechaniczne (papier ścierny), piaskowanie, odtłuszczanie. Wskazana warstwa kleju 0,1-0,6mm. Mniejsza grubość kleju grozi nieciągłością warstwy, natomiast grubsza warstwa zmniejsza wytrzymałość połączenia.
MATERIAŁY LAKIERNICZE
Są to wieloskładnikowe zestawy, które po naniesieniu na powierzchnię wyrobów, po wyschnięciu pozostawia cienką błonę, która jest utrzymywana przez podłoże siłami przyczepności. Wyschnięte i utwardzone błony nazywamy powłokami, albo pokryciami lakierniczymi.
STOP PODEUTEKTYCZNY - o składzie a1%skłA i b1%skłB rozpoczyna krzepnięcie w temp T1. Z roztworu ciekłego wytrącają się kryształy skłA. W miarę jak obniżymy temp maleje udział w stopie skłA i w temp eutektycznej TE z cieczy tworzy się mieszanina kryształów skłA oraz skłB. W stanie stałym struktura stopu składa się z kryształów skłA oraz z eutektyki.
MECHANIZM KRZEPNIĘCIA:
Polega on na powstawaniu w cieczy zarodów krystalizacji i na ich wzroście , Szybkość zarodkowania to jest liczba zarodków krystalizacji tworzących się w jednostce objętości cieczy w jednostce czasu jest różna dla różnych substancji.
FUNKCJE POKRYĆ LAKIERNICZYCH- chronią metale przed korozją- chronią drewna przed procesami gnilnymi -uzyskuje się efekty dekoracyjne -spotykamy również pokrycia posiadające specjalne właściwości np. elektroizolacyjne, lub termoizolacyjne, światłoczułe lub światłoodporne.
Powłoki lakiernicze wielokrotnie wydłużają żywotność konstrukcji, urządzeń, maszyn.
Wymagania od powłok -dużej przyczepności od podłoża -porównywalnego współczynnika rozszerzalności cieplnej powłoki i lakierowanego materiału -braku porowatości, wysokiej elastyczności przy równoczesnej wysokiej wytrzymałości i twardości -odporności cieplnej, świetlnej, chemicznej-braku przepuszczalności gazu i wody
Żywotność zależy od składu chemicznego, przygotowania powierzchni lakierowanej, rodzaju powierzchni, metody pokrywania i jakości nanoszenia. Skład materiału lakierniczego: podstawowymi składnikami są: środki błonotwórcze, pigmenty i rozpuszczalniki
Rola środków błonotwórczych: zapewniają lakierom zdolność zwilżania powierzchni i tworzenia błony. Określają podstawowe własności lakierów. Do najważniejszych grup środków błonotwórczych należą: schnące oleje roślinne, żywice aminowe, epoksydowe, pochodne celulozy, kauczuki, polimery winylowe i akrylowe. Lakiery biorą nazwę od środków błonotwórczych.
Jako rozpuszczalniki lakierów olejnych służą terpentyn, acetan, benzyna, natomiast lakierów żywicznych: etanol, aceton, toluen, do innych : estrów, ketonów.
Aby przyspieszyć schnięcie lakierów wprowadza się do ich składów utwardzacze, aktywatory i inicjatory. Używa się też katalizatorów aby przyspieszyć schnięcie; tlenki metali i soli, grafitu. Ze wzgl na sposób schnięcia rozróżniamy lakiery utwardzające są pod wpływem powietrza lub odparowanie rozpuszczalnika. Schnięcie może zachodzić w temp pokojowej nawet do 2000C
SZKŁO jest substancją bezpostaciową, amorficzną, która ze stanu stałego w ciekły (i odwrotnie) przechodzi w sposób ciągły (niepunktowy). Szkło nie jest przechłodzoną cieczą i stanowi dość szczególny stan materii, nazywany stanem szklistym. Stan szklisty jest termodynamicznie nietrwały i dąży do zmniejszenia en. Wewn. Czyli do przejścia w stan krystaliczny jako trwalszy termodynamicznie. Taki proces nazywa się odszkleniem. Szkło ma strukturę pośrednią między cieczą a materiałem krystalicznym. W szkle występuje uporządkowanie atomów bliskiego zasięgu (czyli atomy uporządkowane na małych obszarach). Struktura szkła stanowi nieuporządkowany ciągły szkielet przestrzenny, w którego węzłach znajdują się jony, atomy albo grupy atomów.
Substancjami szkłotwórczymi są tlenki: krzemu, germanu, boru, ołowiu, arsenu, niobu, litu. Największe znaczenie techniczne i zastosowanie znalazło szkło krzemowe, produkowane z krzemionki.
Każdy jon krzemu w krzemionkach krystalicznych jest otoczony czterema tlenami. Ważnym parametrem szkła jest jego temp zeszklenia czyli temp poniżej której szkło nabiera kruchości. Dla szkła krzemowego temp zeszklenia waha się 425-6000C. powyżej tej temp masa szklana jest przerabiana na wyroby szklane. Gęstość szkła wynosi 2,2-8[g/cm3]. Szkło jest materiałem przezroczystym, kruchym, a zarazem twardym. Teoretycznie wytrzymałość szkła 1500-3000mPa (taką mają włókna szklane). Szkło nie jest odporne na działanie kwasu fluorowodorowego HF, natomiast w pozostałych kwasach rozpuszcza się 100x wolniej niż w zasadach. Szkło wykazuje 8x większą odporność na nagły wzrost temp niż na nagłe oziębienie. Zwykłe szkło okienne jest przepuszczalne dla 90% pełnego zakresu długości fal światła widzialnego(380-800nm) 8%-odbicie, 1%- rozproszenie, 1% pochłanianie. Promieniowanie ultrafioletowe jest przez szkło pochłaniane prawie całkowicie. Struktura szkła powoduje że jego skład chemiczny można zmieniać w bardzo szerokim zakresie. W inżynierii szkła używa się około 35pierwiastkow do modyfikowania jego własności, kształtowania fotochemicznego, fotofizycznych cech. Podanie 1% składnika zmienia radykalnie właściwości szkła.
ELEMENTY KRYSTALOGRAFII:
Rozmieszczenie atomu w krysztale podlega pewnym prawidłowościom, którymi zajmuje się krystalografia. Każdy kryształ ma budowę sieciową utworzoną przez zwielokrotnienie komórki sieciowej w trzech kierunkach.
Cechą podstawową kryształu jest symetria. Wyróżnia się 3 podstawowe elementy symetrii: 1.płaszczyzna symetrii, 2.oś symetrii, 3.środek symetrii. Płaszczyzna symetrii dzieli kryształ na 2 części stanowiące wzajemnie lustrzane odbicie. Oś symetrii jest osią obrotu dookoła której obracając kryształ o pewien kąt otrzymuje się identyczne położenie wszystkich jego elementów jak przed obrotem. Wyróżniamy osie dwukrotne (180°) lub trzykrotne (120°). Główną osią symetrii kryształu nazywamy oś o największej krotności w krysztale. Wyznacza orientację kryształu w przestrzeni. Środek symetrii jest to punkt względem którego wszystkie elementy kryształu (czyli po obrocie po 180°) zajmują położenie identyczne jak przed obrotem. Ponadto wszystkie płaszczyzny i osie symetrii kryształu przecinają się w środku symetrii. Kryształy mogą być: dwu-, trzy-, cztero- i sześcioosiowe.
CHARAKTERYSTYKA UKŁĄDÓ KRYSTALOGRAFICZNYCH:
Oprócz typu sieci wielkościami charakterystycznymi są: liczba koordynacyjna i współczynnik wypełnienia sieci.
Liczba koordynacyjna określa liczbę atomów znajdujących się w najbliższej i równej odległości od atomu leżącego wewnątrz sieci. W układzie regularnym każdy atom wewnątrz sieci ma 6 najbliżej położonych atomów w odległości równej parametrowi sieci (liczba koordynacyjna tego układu wynosi 6). Odległość między atomami w sieci wynosi ok 10-7cm. Współczynnik wypełnienia sieci wyraża się stosunkiem objętości sieci przestrzennej zajętej przez atomy do całkowitej jej objętości. Im bardziej zwarte jest ułożenie atomów w sieci przestrzennej kryształu, tym wyższa jest liczba koordynacyjna oraz współczynnik wypełnienia sieci. W kryształach między węzłami sieci działa silne wiązanie kowalencyjne.
FUNKCJE TERMODYNAMICZNE, których wartości są określone jednoznacznie przez parametry układu, niezależnie od sposobu, w jaki stan ten został osiągnięty, nazywamy funkcjami stanu. Np funkcją stanu jest energia swobodna, która nosi również nazwę potencjału termodynamicznego. Wszystkie procesy nieodwracalne, czyli samorzutne przebiegają w kierunku zmniejszenia energii swobodnej.
Energia (swobodna 6) dla przemiany izotermiczno-izobarycznej: G=U+PV-TS T=const, P=const, G-energia swobodna Gibbsa, U-energia wewnętrzna, P-ciśnienie, V-objętość, T-temp, S-entropia.
Energia (swobodna 6) dla przemiany izotermiczno-izochorycznej: F=U-TS T=cost, V=const, F-energia swobodna Helnholsta, U-energia wewnętrzna.
Energia wewnętrzna = e.potencjalna + e.kinetyczna + e.wzajemnych oddziaływań.
STAN RÓWNOWAGI TERMODYNAMICZNEJ:
Równowaga termodynamiczna układu zostaje osiągnięta w chwili, gdy jego energia swobodna G osiąga min albo gdy potencjały chemiczne składników we wszystkich fazach są równe.
ENTROPIA:
![]()
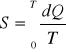
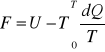
dQ- zmiana ilości ciepła podczas przemiany fazowej, T-temp bezwzględna układu.
UKŁADY RÓWNOWAGI FAZOWEJ:
Równowagę fazową materiałów można przedstawić za pomocą wykresów fazowych przedstawiając zakres zmian składu fazowego układu funkcji temp, ciśnienia i stężenia składników. Na wykresie punkt jest miejscem geometrycznym odpowiadającym 0° swobody, natomiast liczba jest miejscem odpowiadającym 1° stopniowi swobody. Pole pomiędzy liniami jest zbiorem punktów odpowiadających dwóm stopniom swobody. Jeżeli układ jest jednoskładnikowy to współrzędne wykresu stanowią ciśnienie i temp.
W temp pokojowej przy ciśnieniu atmosferycznym fazą stabilną dla węgla jest grafit. A dla żelaza jest to odmiana α. Analiza układów dwuskładnikowych pozwala wyznaczyć zmiany energii swobodnej układu w zależności od temp lub stężenia składników. Zawsze w danej temp stabilna jest faza o mniejszej energii swobodnej.
T0- temp w której mogą istnieć w równowadze 2 fazy, faza ciekłą i stała w T0 są w równowadze.
LIKWIDUS- oddziela obszar występowania roztworu ciekłego L składników A i B od obszaru dwufazowego ciecz (L) roztwór stały (α). Jest zbiorem punktów odpowiadających temp początku krzepnięcia roztworów. Najwyższą temp krzepnięcia ma składnik A, a najniższą składnik B. temp obniża się wraz ze wzrostem stężenia procentowego składnika B.
SOLIDUS- (stały) oddziela obszar 2 faz: cieczy i ciała stałego od obszaru roztworu stałego α. Jest zbiorem punktów odpowiadających temp końca krzepnięcia stopu.
Roztwór stały ciągły krzepnie w zakresie temp wyznaczonych liniami solidus i likwidus. Linie poziome wyznaczają izotermy a pionowe odpowiadają składom chemicznym poszczególnych stopów. Roztwór ciekły o składzie a%skłA oraz b%skłB zaczyna krzepnąć po osiągnięciu temp likwidus TK. w temp TK energia swobodna roztworu ciekłego L i energia swobodna roztworu stałego α są jednakowe. Mówimy, że występuje stan równowagi fazowej. Aby przejść do od fazy ciekłej do stałej należy zakłócić stan równowagi fazowej.
SKŁAD CHEMICZNY:
I-go kryształu - dopowiada punktowi przecięcia izotermy temp z likwidus z linią solidus, czyli punktowi k1. Iszy kryształ roztworu stałego α zawiera a%skłA (jest bogaty w A). Wraz z obniżeniem temp skład chemiczny roztworu ciekłego zmienia się wzdłuż linii likwidus wzbogacając się w skłB.
II kryształ - punktowi k2 odpowiada skład roztworu stałego α równy a%skłA oraz b%skłB. Im niższa temp tym więcej skłB. Wraz z obniżenie temp skład chemiczny roztworu ciekłego zmienia się wzbogacając w skłB. Można wyznaczyć udziały % fazy ciekłej oraz stałej w układzie krzepnącym przy określonej temperaturze. W tym celu wykorzystuje się tzw. Regułę dźwigni.
REGUŁA DŹWIGNI - stosunek mas faz pozostających ze sobą w równowadze jest równy odwrotności stosunku odchyleń składów tych faz od średniego nominalnego składu stopu. Udział roztworu stałego dla temp T wynosi ![]()
(odcinki), a udział cieczy wynosi 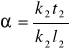
. Krzepnięcie stopu kończy się po osiągnięciu temp solidus (Ts).
III kryształ - (ostatni) roztworu stałego α o składzie odpowiadającym punktowi k3 powstaje z cieczy o składzie punktu l3. Równolegle z procesem krzepnięcia w fazie stałej zachodzą procesy dyfuzyjne, dążące do wyrównania składu chemicznego poszczególnych kryształów.
Przykładem stopu zbudowanego ze składników w stanie stałym o nieograniczonej rozpuszczalności są stopy złota i srebra (molibden i wanad).
Składniki A i B nie rozpuszczają się w stanie stałym. Linia AEB - likwidus, CED - solidus. Punkt E leży na przecięciu linii likwidus i solidus. Stop o składzie punktu E (a%skłA i b%skłB) nazywa się stopem eutektycznym. EUTEKTYKA - mieszanina składników w stanie stałym. Mieszanina złożona z kryształów skłA i kryształów skłB krzepnie w temp TE. LE --> A + B Z cieczy o składzie punktu E wydziela się mieszanina kryształów skłA i B. Stopy o składach chemicznych odpowiadających punktom leżącym na lewo od punktu E nazywają się stopami podeutektycznymi, a na prawo nadeutektycznymi.
SZYBKOŚĆ KRYSTALIZACJI:
Czyli liniowa szybkość wzrostu kryształu w jednostce długości na jednostkę czasu (czyli mm/min) zależy od temp. Przechłodzenia cieczy.
W zakresie temp. przechłodzenia odpowiadających temp. Cieczy Tk-Tm atomy tworzą zarodki kondensacji, które rozrastają się w wyniki osadzania atomów na powierzchniach fazy stałej, w odpowiednich miejscach sieci krystalicznej. Ciecz krystalizuje fazę stała o strukturze kryształu. W zakresie temperatur cieczy niższych od Tm zmniejszaniu ruchliwości atomów towarzyszy gwałtowny wzrost lepkości cieczy, co uniemożliwia tworzenie się i wzrost zarodków krystalizacji. Ciecz wprawdzie krzepnie, ale przechodzi w ciało stałe o strukturze bezpostaciowej.
Ruchliwość - prędkość/masa cząsteczkowa. Lepkość - tarcie zewnętrzne.
Wyszukiwarka
Podobne podstrony:
dokumenty word Sciąga mechanika
Ściąga mechanika gruntów
ściąga mechanika płynów
ściaga mechanika
ściąga mechanika 3
ściąga mechanika płynów 2
sciaga 4 mechanika, Zaawansowane materiały i nanotechnologia UJ, Fizyka, Mechanika
Ściąga Z Mechaniki, Studia - Budownictwo, Mechanika ogólna
Sciąga mechanika gruntów
ściąga mechanika
mechanika, sciaga mechana(2), 1 zasada dynamiki-jeśli na ciało nie działa żadna siła lub siły działa
ŚCIĄGI, Sciaga 1, Mechanika płynów - część mechaniki teoretycznej, zajmuje się badaniem ruchu płynów
ŚCIĄGA Z MECHANIKI GRUNTÓW, AGH-materiały, TPEZ Technika Podziemnej Eksploatacji Złóż
ściąga mechana
ściąga mechana
ściąga mechana
OSN ściąga, Mechanika i Budowa Maszyn, sem. 6, Obrabiarki CNC, Zaliczenie
sciaga 5 mechanika, Zaawansowane materiały i nanotechnologia UJ, Fizyka, Mechanika
ściaga mechana 4a
więcej podobnych podstron