Dominika Wichoczek 14.12.2011r.
Chemia biologiczna
6.Pomiar napięcia powierzchniowego roztworów - izoterma Gibbsa
DANE DOŚWIADCZALNE:
Tabela 1. Dane doświadczalne.
Objętość CH3OH [cm3] |
Objętość H2O [cm3] |
|
Ilość kropli |
|||
|
|
1 próba |
2 próba |
3 próba |
średnia |
|
13 |
0 |
35 |
35 |
35 |
35 |
|
11 |
2 |
31 |
31 |
31 |
31 |
|
10 |
3 |
30 |
30 |
30 |
30 |
|
8 |
5 |
27 |
27 |
27 |
27 |
|
7 |
6 |
25,5 |
25 |
25,5 |
25,33 |
|
5 |
8 |
22 |
22 |
22 |
22 |
|
3 |
10 |
18,5 |
18,5 |
18,5 |
18,5 |
|
2 |
11 |
17 |
17 |
17 |
17 |
|
0 |
13 |
13 |
13 |
13 |
13 |
|
1.Wyznaczanie objętości piknometru.
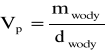
Vp = 10,22329g / 0,998 g/cm3=10,24378 [cm3]
masa wody= masa piknometru z wodą - masa piknometru
masa piknometru z wodą= 24,27266g
masa piknometru= 14,04937g
masa wody=24,27266-14,04937=10,22329g
![]()
2.Obliczanie gęstości badanych próbek:
Tabela 2. Wyliczone gęstości poszczególnych roztworów.
Masa piknometru z roztworem= mpc |
Masa badanych próbek=mc |
Gęstość badanych próbek=dc |
Objętość piknometru=mp |
[g] |
[g] |
[g/dm3] |
[cm3] |
22,13494 |
8,08557 |
789,315265 |
10,24378
|
22,67688 |
8,62751 |
842,219577 |
|
22,93145 |
8,88208 |
867,070761 |
|
23,32182 |
9,27245 |
905,178773 |
|
23,48166 |
9,43229 |
920,782392 |
|
23,76955 |
9,72018 |
948,886282 |
|
23,96885 |
9,91948 |
968,341996 |
|
24,06945 |
10,02008 |
978,162591 |
|
24,27266 |
10,22329 |
998 |
|
3.Wyliczanie napięcia powierzchniowego ze wzoru:
Napięcie powierzchniowe:
σc=σw(nw*dc)/(nc*dw)
gdzie:
σc = napięcie powierzchniowe roztworu
σw = napięcie powierzchniowe wody =0,0728 N/m
nw = liczba kropel cieczy wzorcowej
dc = gęstość badanego roztworu
nc = liczba kropel badanego roztworu
dw = gęstośc cieczy wzorcowej (woda)
Tabela 3. Napięcia powierzchniowe poszczególnych roztworów.
Nr roztworu |
Napięcie powierzchniowe [N/m] |
1 |
0,02139 |
2 |
0,02576 |
3 |
0,02741 |
4 |
0,03179 |
5 |
0,03447 |
6 |
0,04090 |
7 |
0,04964 |
8 |
0,05456 |
9 |
0,07280 |
4.Obliczanie stężenia procentowego dla poszczególnych rozcieńczeń ze wzoru:
5. Przeliczenia stężenia procentowego na stężenie molowe:
gdzie:
Cm. - stężenie molowe [mol/dm3]
Cp - stężenie procentowe [%]
dc - gęstość roztworu [g/m3]
MMETANOLU - masa molowa metanolu [g/mol]
Tabela 4.Stężenia procentowe i molowe poszczególnych roztworów.
Numer zlewki |
Stężenie procentowe |
Stężenie molowe |
log(Cm) |
|
[%] |
[mol/dm3 ] |
|
1 |
100 |
24,67 |
1,392 |
2 |
81,30818002 |
21,40 |
1,330 |
3 |
72,49969671 |
19,64 |
1,293 |
4 |
55,85837291 |
15,80 |
1,199 |
5 |
47,99016405 |
13,81 |
1,140 |
6 |
33,07951116 |
9,81 |
0,992 |
7 |
19,1768399 |
5,80 |
0,764 |
8 |
12,57208713 |
3,84 |
0,585 |
9 |
0 |
0,00 |
|
Wykres 1. Zależność napięcia powierzchniowego od logarytmu stężenia molowego.
Wykres 2.Zależność napięcia powierzchniowego od stężenia molowego.
y= 0,000069x2-0,003587x+0,070002
Pochodna z tego równania wynosi: y' = 0,000138x - 0,003587
Nadmiar powierzchniowy:
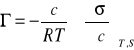
gdzie:
Г- nadmiar powierzchniowy, czyli ilość substancji zaadsorbowanej z roztworu, przypadającej na jednostkę powierzchni
c - stężenie molowe roztworu
R - stała gazowa, równa 8,314 J* mol-1*K-1
T - temperatura (tu 294K)
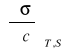
- pochodna wyrażająca zmianę napięcia powierzchniowego wywołaną zmianą stężenia roztworu, w warunkach izotermicznych i przy zachowaniu stałej powierzchni S granicy faz; pochodna ta jest miarą aktywności powierzchniowej substancji w roztworze.
Tabela nr 5. Obliczenia nadmiaru powierzchniowego Nr zlewki Stężenie molowe cm y' Г Г-1
[mol/dm3]
[mol/dm3] [dm3/mol]
1 24,67 -0,00018308 0,0000018474 541288,3721
2 21,40 -0,00063383 0,0000055490 180212,0735
3 19,64 -0,00087606 0,0000070406 142033,365
4 15,80 -0,00140652 0,0000090919 109988,1902
5 13,81 -0,00168137 0,0000094986 105279,149
6 9,81 -0,00223336 0,0000089623 111579,0559
7 5,80 -0,00278618 0,0000066145 151182,0348
8 3,84 -0,00305667 0,0000048056 208088,6588
9 0,00 -0,003587 0,0000000000
|
6.Obliczenie parachory:
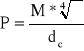
gdzie:
M - masa molowa [g/mol]
σ - napięcie powierzchniowe [N/m]
dc - gęstość badanego roztworu [g/dm3]
wartość parachory P [N*cm3 *m-1*mol-1]
Obliczenia prowadzone dla roztworu 100% metanolu
P= 15,503549
Wartość tablicowa: P=16,5281
5
dwody - gęstość wody = 0,998 g/cm3
mwody - masa wody [g]
dc - gęstość cieczy [g/cm3]
mc - masa cieczy [g] = mpc - mp (dane w tabeli)
Vc - objętość cieczy [cm3]
Wyszukiwarka
Podobne podstrony:
wyklad z czwartku chemia fizycz dnia19 marca
Chemia fizyczna sprawozdanie (6 1) id 112219
Chemia fizyczna wykład 11
chemia fizyczna38
chemia fizyczna07
chromatografia jonowymienna 2, Rok I, chemia fizyczna, chemia fizyczna-protokoły
10.6 poprawione, semestr 4, chemia fizyczna, sprawka laborki, 10.6
Pojęcia na egzamin z metali, Chemia Fizyczna, chemia fizyczna- laborki rozne, Rozne
Tabelka pomiarowa do 21, BIOTECHNOLOGIA POLITECHNIKA ŁÓDZKA, CHEMIA FIZYCZNA
CHEMIA FIZYCZNA- spektrografia sc, Ochrona Środowiska pliki uczelniane, Chemia
Kolokwium nr 2 (2), Technologia chemiczna, Chemia fizyczna, 3 semestr, fizyczna paczi
Chemia fizyczna 18, chemia fizyczna, chemia, FIZYCZNA - raporty
mmgg, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczna cz II sprawka
Pytania z wejściówek, analityka medyczna UMP 2014, chemia fizyczna, ćwiczenia
raport5.2, UMK, Chemia fizyczna
Chemia fizyczna - sprawozdanie 2-1, Chemia Fizyczna
więcej podobnych podstron