Frankiewicz Waldemar
III rok chemii inf
Refrakcja molowa a budowa związku chemicznego.
Celem ćwiczenia jest wykorzystanie refrakcji molowej do wyznaczenia wzoru strukturalnego związku chemicznego oraz nieznanego stężenia roztworu.
Posługując się zasadą Fermata otrzymujemy związek:
sinα1 = sinα2
zatem
α1 = α2
Jest to prawo odbicia, które wyrażamy słowami:
Kąt padania jest równy kątowi odbicia.
Zgodnie z prawem Sneliusa, dla danej pary ośrodków stosunek sinusa kąta padania do sinusa kąta załamania jest wielkością stałą, zwaną współczynnikiem załamania światła, lub współczynnikiem refrakcji, i równą stosunkowi prędkości rozchodzenia się światła w tych ośrodkach. Prawo to opisuje równanie:
![]()
![]()
= n = ![]()
gdzie: α- kąt padania
β- kąt załamania
c1 - prędkość rozchodzenia się światła w ośrodku 1
c2 - prędkość rozchodzenia się światła w ośrodku 2
Bezwzględny współczynnik załamania światła jest to współczynnik załamania danego ośrodka wyznaczany względem próżni.
Zgodnie z równaniem Lorentza - Lorentza, daną substancję chemiczną charakteryzuje refrakcja właściwa rw oraz refrakcja molowa R:
rw =![]()
R = ![]()
gdzie: n- współczynnik załamania światła
M - Masa molowa
d - gęstość badanej substancji
Refrakcja molowa jest addytywna, tzn. jest sumą refrakcji molowych wiązań, atomów, grup atomów.
Rroztw. = ΣniRa + ΣniRw
gdzie: ni jest liczgą określonych atomów lub wiązań w cząsteczce.
Refrakcję można wyznaczyć doświadczalnie poprzez pomiar współczynnika załamania światła lub można ją obliczyć, gdy znana jest budowa związku. Jednostką refrakcji jest m3/mol .
Obliczenia .
Wyznaczanie wzoru strukturalnego dioksanu.
gęstość dioksanu d= 1.033 g/cm3
masa molowa dioksanu M= 88,11 g/mol
współczynnik załamania światła n = 1,4176
R =![]()
=![]()
= ![]()
= 21,4768 * 10![]()
m![]()
/mol
Mając dany wzór sumaryczny dioksanu (C4H8O2) obliczamy wartość refrakcji dla kilku izomerycznych struktur. Dla każdej z powyższych cząsteczek obliczamy wartość refrakcji dwukrotnie - podstawiając wartość refrakcji atomów i refrakcji wiązań.
1.
H H H O
H - C - C - C - C <
H H H O - H
![]()
4٠RC + RH + R=0 + R - o = 9,672 + 8,8 + 2,211 + 1,525 = 22,208٠ 10-6 m3/mol
Σ RW = 7٠ RC-H + 3٠ RC - C + RC=O + RC - O + ROH = 11,76 + 3,898 + 3,32 + 1,54 + 1,8
= 22,318 ٠ 10 -6 m3/mol
R =![]()
22,263 ٠ 10 -6 m3/mol
2.
H O
H - C - C H H
H O - C - C - H
H H
ΣRa = 4٠RC +8٠ RH + R=o +R - 0 - = 9,672+8,8+2,211+1,525 = 22,208٠10-6m3/mol
ΣRw = 8٠RC - H +2٠RC - C +RC=O = 13,44+2,592+3,32+3,08 = 22,432٠10-6 m3/mol
R= ![]()
22,32٠10-6 m3/mol
3.
H H H O
H - C - C - O - C - C
H H H H
![]()
![]()
ΣRa = 4٠RC +8٠ RH + R=o +R - 0 - = 9,672+8,8+2,211+1,525 = 22,208٠10-6m3/mol
ΣRw= 8 · RC - H +2·RC - C + 2·RC - O = 13,44+2,592+ 3.32 = 19,352·10-6 m3/mol
R = ![]()
= 20,78 ·10-6 m3/mol
4.
O
H H
C C
H H
C C
H H
H O H
ΣR = 4·RC +8·RH +2·R>O = 21,758·10-6 m3/mol
ΣRw = 8 · RC - H + 8 · RC - H +4·RC - O = 2,592+13,44+6,16 =22,192·10-6 m3/mol
R = ![]()
= 21,975·10-6 m3/mol
C(%wag) |
X1 |
N |
nśr |
5% |
0,516
|
1,39 |
1,339 |
|
|
1,39 |
|
|
|
1,39 |
|
10%
|
1,033 |
1,343 |
1,344 |
|
|
1,346 |
|
|
|
1,345 |
|
15% |
1,549 |
1,349 |
1,347 |
|
|
1,349 |
|
|
|
1,345 |
|
20% |
2,066 |
1,354 |
1,355 |
|
|
1,354 |
|
|
|
1,353 |
|
Woda |
0 |
1,334 |
1,335 |
|
|
1,336 |
|
|
|
1,336 |
|
Dioksan |
1 |
1,340 |
1,341 |
|
|
1,342 |
|
|
|
1,341 |
|
Obliczam ułamki molowe.
Dla roztworu 1.
Obliczam ilość wody
VH2O = 10 cm3 - 0,5 cm3 = 9,5 cm3
stąd: m H2O = 9,5 g
obliczam liczbę moli:
n H2O = ![]()
= 0,52778 mol
obliczam ilość dioksanu
1 cm3 - 1,033 g
0,5 cm3 - md
md = 0,5165 g
1mol - 88,11 gl
n - 0,5165 g
n = 0,005862 mol
ułamek molowy
X0 = ![]()
= ![]()
= 0,010985
Dla roztworu 2.
Ilość wody: m H2O = 9,0 g
Liczba moli: n H2O = 0,5 mol
Ilość dioksanu: 1 cm3 - 1,033 g
1 cm3 - md
md = 1,033 g
1mol - 88,11 g
n - 1,033 g
n = 0,0117mol
X1 = ![]()
= ![]()
= 0,022865
Dla roztworu 3.
Ilość wody: m H2O = 8,5 g
Liczba moli: n H2O = 0,472 mol
Ilość dioksanu: 1 cm3 - 1,033 g
1,5 cm3 - md
md = 1,5495 g
1mol - 88,11 g
n - 1,5495 g
n = 0,017561mol
X2 = ![]()
= ![]()
= 0,035871
Dla roztworu 4.
Ilość wody: m H2O = 8 g
Liczba moli: n H2O = 0,4444 mol
Ilość dioksanu: 1 cm3 - 1,033 g
2 cm3 - md
md = 2,066 g
1mol - 88,11 g
n - 2,066 g
n = 0,02348 mol
X3 = ![]()
= ![]()
= 0,05018
Na podstawie wyników zawartych w poniższej tabeli wykreślam krzywą kalibracyjną jako funkcję n = f(xi)
Lp. |
Xi |
ni |
Xini |
Xi2 |
1. |
0 |
1,3327 |
0 |
0 |
2. |
0,010985
|
1,3373 |
0,01469 |
1,2*10-4 |
3. |
0,022865 |
1,3427 |
0,0307 |
5,23*10-4 |
4. |
0,035871 |
1,3470 |
0,04832 |
1,29*10-3 |
5. |
0,05018 |
1,3523 |
0,06786 |
2,5*10-3 |
6. |
1,0 |
1,4176 |
1,4176 |
1 |
|
|
Σni=8,1296 |
Σxini=1,5792 |
Σxi2 = 1,00445 |
k- liczba pomiarów = 6
Metodą najmniejszych kwadratów obliczam równanie prostej ni = axi + b
a = 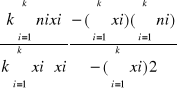
b = 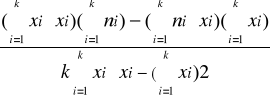
po podstawieniu do w/w wzorów otrzymałem:
a = 0,0979
b = 1,6893
ni = 0,0979·xi + 1,6893
Wyszukiwarka
Podobne podstrony:
wyklad z czwartku chemia fizycz dnia19 marca
Chemia fizyczna sprawozdanie (6 1) id 112219
Chemia fizyczna wykład 11
chemia fizyczna38
chemia fizyczna07
chromatografia jonowymienna 2, Rok I, chemia fizyczna, chemia fizyczna-protokoły
10.6 poprawione, semestr 4, chemia fizyczna, sprawka laborki, 10.6
Pojęcia na egzamin z metali, Chemia Fizyczna, chemia fizyczna- laborki rozne, Rozne
Tabelka pomiarowa do 21, BIOTECHNOLOGIA POLITECHNIKA ŁÓDZKA, CHEMIA FIZYCZNA
CHEMIA FIZYCZNA- spektrografia sc, Ochrona Środowiska pliki uczelniane, Chemia
Kolokwium nr 2 (2), Technologia chemiczna, Chemia fizyczna, 3 semestr, fizyczna paczi
Chemia fizyczna 18, chemia fizyczna, chemia, FIZYCZNA - raporty
mmgg, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczna cz II sprawka
Pytania z wejściówek, analityka medyczna UMP 2014, chemia fizyczna, ćwiczenia
raport5.2, UMK, Chemia fizyczna
Chemia fizyczna - sprawozdanie 2-1, Chemia Fizyczna
więcej podobnych podstron