Ćwiczenie nr 22 Aleksandra Drzewiecka
Małgorzata Giszczak
PRAWO PODZIAŁU NERNSTA
1.Układy trójskładnikowe-jednofazowe:
W stałej temperaturze, równowaga pomiędzy fazami skondensowanymi będzie równowagą dwuzmienną, ponieważ temperatura i stężenie substancji rozpuszczonej w fazie ciekłej wyznacza jednocześnie, stężenie tej substancji w fazie drugiej, i to niezależnie od stanu skupienia substancji rozpuszczonej, jednak substancja rozpuszczona nie może powiększać wzajemnej rozpuszczalności obu cieczy. Jeśli substancją rozpuszczoną jest gaz -to jego stężenia c1 i c2 są proporcjonalne do ciśnienia p zgodnie z prawem Henry`ego.
2.Prawo podziału Nernsta:
Prawo głoszące, że dla dwu nie mieszających się, będących w kontakcie i pozostających ze sobą w równowadze cieczy, stosunek stężeń (ściślej aktywności) trzeciego składnika, rozpuszczonego w każdej z tych cieczy, jest stały w danych warunkach temperatury i ciśnienia. Stosunek ów nazywa się współczynnikiem podziału. Zgodnie z powyższym , mamy :
K=![]()
gdzie: K- stała podziału
![]()
i ![]()
- aktywności w poszczególnych warstwach
Prawo to w postaci prostej jest słuszne tylko tych przypadkach, gdy po doprowadzeniu do stanu równowagi, substancja rozpuszczona nie zmienia swojego stanu cząsteczkowego tj: gdy w obu rozpuszczalnikach nie dysocjuje ani też nie asocjuje, a temperatura pozostaje stała.
Wzór Nernsta: K - 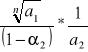
A w rozcieńczonych aktywności możemy zastąpić stężeniami : K - 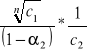
3. Wykonanie ćwiczenia:
W kolbie miarowej na 50 cm3 sporządzamy roztwór zawierający 2,5 grama kwasu benzoesowego w toluenie. Trzy roztwory robocze otrzymujemy pobierając pipetą miarową odpowiednio 3,8 cm3, 7,5 cm3 , 15 cm3 roztworu podstawowego i dopełniamy do 25 cm3 toluenem do kreski. Następnie przelewamy je do rozdzielaczy, w którym znajduje się 50 cm3 wody i mieszamy dzięki wytrząsarce ręcznej. Następnie gdy warstwa wodna będzie klarowna i wypuszczamy warstwę wodną do zlewki. Następnie odpipetowujemy dwie próbki po 10 cm3 i miareczkujemy rozpuszczony w nich kwas 0.01 M roztworem NaOH wobec fenoloftaleiny.
4. Opracowanie wyników (wyznaczanie stałych K i n ):
Ilość moli kwasu benzoesowego w rozdzielaczu |
Średnia ilość cm3 NaOH |
c2
[mol/dm3]
|
c1
[mol/dm3] |
log[c2(1-α2)] |
log[c1] |
1,55 * 10-3 |
10,03 |
0,01003 |
0,0419 |
- 2.03 |
-1,37 |
3,06 * 10-3 |
11,05 |
0,01105 |
0,1003 |
- 1,99 |
-0,99 |
6,12* 10-3 |
18,39 |
0,01839 |
0,2080 |
- 1,76 |
-0,68 |
8,16* 10-3 |
21,18 |
0,02118 |
0,2840 |
- 1,69 |
-0,54 |
Mmol kw.benz. = 122,123g
1 mol - 122,123 g
x - 2,5 g
x=0,0204 mola kwasu benzoesowego
0,0204 mola - 50 cm3
x - 1000 cm3
x - 0,408 stężenie kwasu benzoesowego
Dla pierwszego rozdzielacza:
c2 = ![]()
= 0,01003
0,408 - 1000 cm3
x - 3,8 cm3
x = 1,55 * 10-3
c1= ![]()
= ![]()
= 0,0419
K=![]()
= ![]()
= 4,17
Dla drugiego rozdzielacza:
c2 = ![]()
= 0,01105
0,408 - 1000 cm3
x - 7,5 cm3
x = 3,06 * 10-3
c1= ![]()
=![]()
= 0,1003
K=![]()
= ![]()
= 9,077
Dla trzeciego rozdzielacza:
c2 = ![]()
= 0,01839
0,408 - 1000 cm3
x - 15 cm3
x = 6,12* 10-3
c1= ![]()
=![]()
= 0,208
K=![]()
= ![]()
= 11,31
Dla czwartego rozdzielacza:
c2 = ![]()
= 0,02118
0,408 - 1000 cm3
x - 20 cm3
x = 8,16* 10-3
c1= ![]()
=![]()
= 0,2840
K=![]()
= ![]()
= 13,408
1. α2=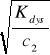
czyli α2= 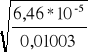
= 0,080
2. α2=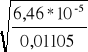
= 0,076
3. α2=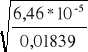
= 0,059
4. α2=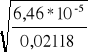
= 0,055
dla I-wszego rozdzielacza : log[c2(1-α2)] = log[0,01003*(1-0,080)] = - 2.03
dla II-ego rozdzielacza : log[c2(1-α2)] = log[0,01105*(1-0,076)] = - 1,99 dla III-ego rozdzielacza : log[c2(1-α2)] = log[0,01839*(1-0,059)] = - 1,76 dla IV-ego rozdzielacza : log[c2(1-α2)] = log[0,02118*(1-0,055)] = - 1,69
dla I-wszego rozdzielacza: log[c1] = log[0,0419] = -1,37
dla II-ego rozdzielacza: log[c1] = log[0,1003] = -0,99
dla III-ego rozdzielacza: log[c1] = log[0,2080] = -0,68
dla IV-ego rozdzielacza: log[c1] = log[0,2840] = -0,54
Kdys = 6,46 *10-5
Obliczenie K:
Równanie funkcji: y-y1=![]()
(x - x1)
A(-1,37;-2,03)
B(-0,54;-1,69)
y + 2,03 = ![]()
(x +1,37)
y = 0,4096*x - 1,4687
Przecięcie z osią OY w punkcie -1,47 (y =0,4096*0-1,4687 )
log[K] = -1,47
K = 10-1,47 = 0,00338
Obliczenie n:
Δy = - 0,54 - (-1,34) = 0,83
Δx = -1,69 -(- 2,03) = 0,34
![]()
)= ![]()
= ![]()
= 0,4096
n = ![]()
=1 / 0,4096 = 2,44
Wyszukiwarka
Podobne podstrony:
wyklad z czwartku chemia fizycz dnia19 marca
Chemia fizyczna sprawozdanie (6 1) id 112219
Chemia fizyczna wykład 11
chemia fizyczna38
chemia fizyczna07
chromatografia jonowymienna 2, Rok I, chemia fizyczna, chemia fizyczna-protokoły
10.6 poprawione, semestr 4, chemia fizyczna, sprawka laborki, 10.6
Pojęcia na egzamin z metali, Chemia Fizyczna, chemia fizyczna- laborki rozne, Rozne
Tabelka pomiarowa do 21, BIOTECHNOLOGIA POLITECHNIKA ŁÓDZKA, CHEMIA FIZYCZNA
CHEMIA FIZYCZNA- spektrografia sc, Ochrona Środowiska pliki uczelniane, Chemia
Kolokwium nr 2 (2), Technologia chemiczna, Chemia fizyczna, 3 semestr, fizyczna paczi
Chemia fizyczna 18, chemia fizyczna, chemia, FIZYCZNA - raporty
mmgg, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczna cz II sprawka
Pytania z wejściówek, analityka medyczna UMP 2014, chemia fizyczna, ćwiczenia
raport5.2, UMK, Chemia fizyczna
Chemia fizyczna - sprawozdanie 2-1, Chemia Fizyczna
więcej podobnych podstron