WYZNACZANIE ILOCZYNU ROZPUSZCZALNOŚCI METODĄ POMIARU PRZEWODNICTWA |
ĆW.26. |
Cel ćwiczenia
Celem ćwiczenia jest wyznaczenie iloczynu rozpuszczalności Ksp dla kilku słabo rozpuszczalnych związków jonowych, na przykład CaSO4. Takie sole jak CaSO4 są zaliczane do mocnych elektrolitów; cała ilość CaSO4, która rozpuści się w wodzie, całkowicie dysocjuje na jony Ca2+ i SO42- zgodnie z równaniem reakcji:
CaSO4(s) Ca2+(aq) + SO42-(aq)
W reakcjach heterogenicznych stężenie fazy stałej nie zmienia się, dlatego stałą równowagi reakcji dysocjacji CaSO4 można wyrazić równaniem:
Ksp = [Ca2+ ]·[ SO4 2-]
Iloczyn rozpuszczalności Ksp jest to iloczyn stężeń molowych jonów soli trudno rozpuszczalnej w jej roztworze nasyconym. Ksp ma wartość stałą w stałej temperaturze. W celu wyznaczenia iloczynu rozpuszczalności związku należy precyzyjnie wyznaczyć stężenia molowe jonów w nasyconym roztworze. Ze względu na bardzo małą rozpuszczalność tej soli, molowe stężenia jonów są bardzo małe, więc wyznaczenie ich wartości wymaga specjalnych metod, na przykład pomiarów przewodnictwa.
Odczynniki:
► nasycony roztwór siarczanu(VI) wapnia, CaSO4

► nasycony roztwór chlorku ołowiu(II), PbCl2
► woda destylowana
Sprzęt laboratoryjny:
► 2 zlewki o pojemności 50 cm3
► zestaw do sączenia
► konduktometr
Wykonanie ćwiczenia:
Nasycony roztwór siarczanu(VI) wapnia, CaSO4 (lub chlorku ołowiu(II), PbCl2) należy przesączyć przez bibułę filtracyjną do uzyskania ok. 30 cm3 przesączu w zlewce.
Przygotuj konduktometr do pomiaru. W tym celu przepłucz wodą destylowaną elektrodę i dokładnie osusz.
Następnie zmierz przewodnictwo badanego roztworu i zanotuj jego wartość (κr).
Zmierz przewodnictwo wody destylowanej i zanotuj wynik (κw).
Na termometrze odczytaj temperaturę panującą w laboratorium.
Obliczenia:
Obliczenie przewodnictwa właściwego soli rozpuszczonej.
Przewodnictwo właściwe roztworu nasyconego trudno rozpuszczalnej soli jest bardzo małe. W celu uniknięcia błędu oznaczenia należy uwzględnić przewodnictwo właściwe wody destylowanej, na bazie której został sporządzony roztwór soli nasyconej.
Następnie wartość przewodnictwa właściwego rozpuszczonej soli otrzymaną w warunkach pomiaru należy przeliczyć na warunki standardowe.
Przewodnictwo właściwe soli rozpuszczonej obliczamy korzystając ze wzoru:
κs = κr - κw
κs - przewodnictwo właściwe soli rozpuszczonej [S/cm]
κr - przewodnictwo właściwe nasyconego roztworu badanej soli (zmierzone w ćwiczeniu i podane w jednostkach [S/cm])
κw - przewodnictwo właściwe wody destylowanej [S/cm])
Przyjmując, że przewodnictwo zmienia się o 2% przy zmianie temperatury o 1º otrzymaną wartość przewodnictwa należy przeliczyć na warunki standardowe korzystając z tabeli 1.
Tabela 1. Sposób przeliczenia wartości przewodnictwa właściwego soli rozpuszczonej wyznaczonego w temperaturze T na warunki standardowe:
T (º) |
18 |
19 |
20 |
21 |
22 |
23 |
24 |
25 |
wartość κs298K |
κs+0,14κs |
κs+0,12κs |
κs+0,1κs |
κs+0,08κs |
κs 0,06κs |
κs+0,04κs |
κs+0,02κs |
κs |
gdzie κs - przewodnictwo właściwe soli rozpuszczonej obliczone w temperaturze pomiaru
Obliczenie granicznego przewodnictwa molowego
Graniczne przewodnictwo molowe (![]()
) badanej soli obliczamy na podstawie równania:
![]()
![]()
- graniczne przewodnictwo molowe soli rozpuszczonej [S⋅cm2/mol];
ν+ i ν- - liczba kationów i anionów, na jakie dysocjuje dana sól;
![]()
i ![]()
- graniczne przewodnictwo molowe kationu i anionu [S⋅cm2/mol]
(odczytane z tabeli 2)
Tabela 2. Wartości granicznych przewodnictw molowych jonów w 298K.
jon |
[S⋅cm2/mol] |
jon |
[S⋅cm2/mol] |
Pb2+ |
141 |
Cl- |
76,44 |
Ca2+ |
118,97 |
|
159,9 |
Obliczanie stężenia soli w oparciu o wartość granicznego przewodnictwa molowego.
Dla soli trudno rozpuszczalnych można przyjąć, że graniczne przewodnictwo molowe (![]()
) jest równe przewodnictwu molowemu (![]()
), czyli: ![]()
= ![]()
Ponieważ: ![]()
![]()
κ - przewodnictwo właściwe [S/cm]
c - stężenie roztworu [mol/dm3]
λM - przewodnictwo molowe [S⋅cm2/mol]
1000 - oznacza zamianę dm3 na cm3 (1000 cm3 = 1dm3)
stąd: ![]()
κs - przewodnictwo właściwe soli rozpuszczonej w 298K [S/cm]
![]()
- graniczne przewodnictwo molowe soli rozpuszczonej [S⋅cm2/mol]
zatem stężenie badanej soli możemy obliczyć ze wzoru:
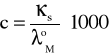
Stężenie (c) badanej soli w roztworze nasyconym jest równe jej rozpuszczalności (R) w jednostkach [mol/dm3].
Iloczyn rozpuszczalności analizowanej soli obliczamy następująco:
♦ dla soli typu AB:
AB A+ + B-
R = [A+] = [B-] [mol/dm3 ]
![]()
♦ dla soli typu AB2:
AB2 A2+ + 2B-
R = [A+] = 1/2[B-] [mol/dm3 ]
![]()
Obliczanie rozpuszczalności badanej soli w [g/dm3].
Znając wartość rozpuszczalności soli w jednostkach [mol/dm3] (R) oraz jej masę molową (M) oblicz rozpuszczalność soli w [g/dm3] (R′) korzystając ze wzoru:
R′ = R⋅M
Wyniki:
Uzupełnij poniższą tabelę:
sól |
κr [S/cm] |
κw [S/cm] |
κs* [S/cm] |
[S⋅cm2/mol] |
rozpuszczalność |
Ir |
|
|
|
|
|
|
R [mol/dm3] |
R′ [g/dm3] |
|
|
|
|
|
|
|
|
|
* wartość przeliczona na warunki standardowe
Dyskusja:
1. Na przykładzie BaSO4 wyjaśnij różnicę pomiędzy rozpuszczalnością, stężeniem molowym a iloczynem rozpuszczalności.
2. Dlaczego nie stosuje się pojęcia iloczynu rozpuszczalności dla dobrze rozpuszczalnych związków jonowych?
3. Napisz równanie dysocjacji oraz wyrażenie na iloczyn rozpuszczalności dla następujących związków chemicznych: Ag2CrO4; AuCl3; Mn3(PO4)2.
4. W jaki sposób można przewidzieć, czy wytrąci się osad po zmieszaniu dwóch roztworów?
5. W jaki sposób możemy rozdzielić jony Cl-, Br- , oraz I- z wodnego roztworu?
6. Wyjaśnij zasadę metody frakcjonowanego wytrącania.
Wyszukiwarka
Podobne podstrony:
iloczyn rozpuszczalności
Iloczyn rozpuszczalnosci roztwo Nieznany
iloczyn rozpuszczalności, STUDIA (ochrona), ROK I, chemia, laboratoria
Iloczyn rozpuszczalności
Iloczyn rozpuszczalności soli trodno rozpuszczalnych, studia, chemia, chemia fizyczna, sprawozdania,
Iloczyn rozpuszczalnoÂci, Studia II rok, Studia, PD materialy donauki, PD materialy donauki
iloczyn rozpuszczalnosci id 210 Nieznany
iloczyn rozpuszczalności
Hydroliza soli iloczyn rozpuszczalności
Iloczyn rozpuszczalnosci (Kso) Nieznany
Iloczyn rozpuszczalności(1), Chemia, Chemia nieorganiczna
Iloczyn rozpuszczalnosci -zadania kl.I WORD2003, szkoła, chemia
Z Rownowagi dys słabe hydroliza iloczyn rozpuszczalnosci
Laboratorium 9 Iloczyn rozpuszczalności, Studia - Inżynieria materiałowa, Chemia ogólna i nieorganic
iloczyn rozpuszczalnosci, studia, ochrona środowiska UJ, chemia analityczna, wyrównawcze
iloczyn rozpuszcalnosci, chemia fizyczna, Nowy folder, zalaczniki
W10s-rownowagi heterogeniczne-Iloczyn rozpuszczalnosci, chemia, szkolka
Iloczyn rozpuszczalności
więcej podobnych podstron