OGNIWA
GALWANICZNE
CO TO JEST OGNIWO GALWANICZNE?
Każdy z nas zastanawiał się kiedyś na jakiej zasadzie działa bateria lub akumulator? W jaki sposób „magazynujemy” prąd? Jest to bardzo ciekawe zagadnienie. Wiadomo, że w dzisiejszych czasach bez baterii i akumulatorów nie dałoby się żyć. Nie byłoby telefonów komórkowych i zegarków elektronicznych. Samochody zapalane byłyby na korbę. Ogólnie nasze życie byłoby mocno utrudnione i bardziej kosztowne. Dlaczego takie nie jest?
Generalnie wszystko opiera się o wykorzystanie takiego źródła prądu, które energię czerpie z zachodzących w nim reakcji chemicznych odwracalnych lub nie. Takie źródło prądu nazywamy ogniwem. Zasadą działania najprostszego z nich, ogniwa galwanicznego, jest fakt, że na granicy między metalem a elektrolitem tworzy się spadek potencjału, podtrzymywany ciągle podczas przepływu prądu kosztem energii chemicznej.
Wynika to z faktu, że obok przewodników pierwszego rodzaju (metale, węgiel), w których nie zachodzą żadne zmiany chemiczne przy przepływie prądu elektrycznego, istnieją tzw. przewodniki drugiego rodzaju, w których zachodzą zmiany chemiczne przy przepływie prądu. Do przewodników drugiego rodzaju zaliczamy roztwory soli, kwasów i zasad. W metalach prąd elektryczny sprowadza się do ruchu postępowego swobodnych elektronów. W przewodnikach drugiego rodzaju nośnikami ładunków są jony. Cząsteczki soli przy rozpuszczaniu rozpadają się na jony tj. na cząsteczki naładowane przeciwnymi znakami. Ruch tych jonów pod wpływem zewnętrznego pola elektrycznego powoduje prąd w przewodniku drugiego rodzaju. Proces rozpadania się cząsteczek w roztworze na jony, nosi nazwę dysocjacji elektrolitycznej.
W obwodzie zamkniętym złożonym z różnorodnych przewodników pierwszego rodzaju nie powstaje siła elektromotoryczna. Jeśli zestawimy zamknięty obwód z przewodników pierwszego i drugiego rodzaju, to powstanie w nim różna od zera SEM. Tego rodzaju kombinacja przewodników pierwszego i drugiego rodzaju tworzy wspomniane ogniwo galwaniczne. Składa się ono z dwóch, najczęściej metalowych płytek, zwanych elektrodami, zanurzonych w określonych roztworach (elektrolitach).
Na granicy między metalem (przewodnikiem pierwszego rodzaju) i roztworem (przewodnikiem drugiego rodzaju) tworzy się spadek potencjałów, którego ciągłe podtrzymywanie zachodzi kosztem pracy sił chemicznych. W wyniku pracy tych sił następuje stałe utrzymywanie się skoków potencjałów przy obu płytkach metalowych. Istnienie tych, nierównych sobie skoków potencjałów, podtrzymywanych kosztem pracy sił chemicznych, warunkuje siłę elektromotoryczną ogniwa galwanicznego. Możliwy jest dobór takiej pary metal - roztwór, dla której dodatnie jony przechodzą z roztworu do metali; w tym przypadku metal ładuje się dodatnio, roztwór ujemnie.
KLUCZ ELEKTROLITYCZNY
Klucz elektrolityczny, mostek elektrolityczny, połączenie półogniw, najczęściej szklana rurka wygięta w kształcie litery U (tzw. U-rurka), wypełniona roztworem elektrolitu, np. chlorku potasu, z przegrodami porowatymi na końcach. Klucz elektrolityczny stosuje się w celu uniemożliwienia szybkiego mieszania się roztworów elektrolitów w obu półogniwach tworzących ogniwo (ogniwo elektrochemiczne).
POTENCJAŁ STANDARDOWY OGNIWA
Potencjał standardowy, standardowy potencjał półogniwa, siła elektromotoryczna ogniwa zestawionego z danego półogniwa, zawierającego jony o jednostkowej aktywności, oraz standardowej elektrody wodorowej. Stabelaryzowane potencjały standardowe umożliwiają obliczenie siły elektromotorycznej dowolnego ogniwa elektrochemicznego oraz powinowactwa chemicznego reakcji, która w nim zachodzi.
SIŁA ELEKTROMOTORYCZNA OGNIWA - SEM
Siła elektromotoryczna ogniwa, SEM, różnica potencjałów dwóch półogniw otwartego ogniwa elektrochemicznego (przez ogniwo nie płynie prąd, znajduje się ono w stanie równowagi). Źródłem SEM są reakcje przebiegające w półogniwach (ich suma nosi nazwę reakcji ogniwa). SEM zależy od aktywności jonowej składników półogniw, temperatury i ciśnienia.
Może być wyliczona z równania Nernsta 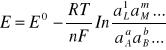
,
gdzie E0 - standardowa SEM ogniwa równa różnicy potencjałów standardowych półogniwa prawego i lewego, R - stała gazowa, T - temperatura bezwzględna, n - liczba elektronów wymienianych podczas jednego stechiometrycznego przebiegu reakcji ogniwa, F - stała Faradaya (elektroliza), aL, aM - aktywności produktów, aA, aB aktywności substratów, l, m, a, b - wykładniki potęgowe równe współczynnikom stechiometrycznym w równaniu reakcji ogniwa. Znak SEM jest dodatni, gdy zapis reakcji ogniwa (a więc i schematu ogniwa) odpowiada jej samorzutnemu przebiegowi.
STANDARDOWE PÓŁOGNIWO WODOROWE - SPW
Aby dokonywać pomiarów różnic potencjałów dwóch półogniw jest konieczne wyznaczenie punktu odniesienia. Takim punktem jest SPW. Półogniwo wodorowe nosi nazwę standardowego gdy:
stężenie jonów wodorowych wynosi 1mol/dm3,
ciśnienie wodoru równe jest 1013 hPa.
Półogniwu o takich właściwościach przypisuje się potencjał równy zeru w każdej temperaturze.
Anoda
1) w ogniwie galwanicznym elektroda pobierająca elektrony z obszaru międzyelektrodowego; zachodzi na niej reakcja utleniania; jest elektrodą ujemną;
2) w przyrządzie elektronicznym (np. lampie elektronowej, tranzystorze) lub elektrycznym (np. elektrolizerze) elektroda odprowadzająca ujemne nośniki prądu z obszaru międzyelektrodowego; połączona z dodatnim biegunem zewnętrznego źródła prądu jest elektrodą dodatnią.
Katoda
1) w ogniwie galwanicznym elektroda oddająca elektrony do obszaru międzyelektrodowego; zachodzi na niej proces redukcji; jest elektrodą dodatnią;
2) w przyrządzie elektronicznym (np. lampie elektronowej, tranzystorze) lub elektrycznym (np. elektrolizerze) elektroda doprowadzająca ujemne nośniki prądu do obszaru międzyelektrodowego; połączona z ujemnym biegunem zewnętrznego źródła prądu - jest elektrodą ujemną.
TYPY OGNIW
Obecnie różnorodność występujących ogniw jest ogromna. Powstawały one w różnych czasach i opierały się na różnych zasadach - pomijając tę podstawową. Oto opis tych najbardziej podstawowych i najbardziej rozpowszechnionych ogniw, które spotykamy w naszym życiu codziennym i nie tylko.
Ogniwa dzielimy na dwie zasadnicze grupy: ogniwa regenerowalne (odwracalne) i ogniwa nieregenerowalne (niodwracalne).
OGNIWA REGENEROWALNE
Jednym z najstarszych ogniw odwracalnych jest ogniwo Daniella.
OGNIWO DANIELLA
To ogniwo galwaniczne odwracalne. Zostało opracowane przez Johna Frederica Daniella w 1853 roku; SEM = 1,13 V
Budowa:
dodatnią elektrodę stanowi miedź - zanurzona w CuSO4;
ujemną - cynk zanurzony w ZnSO4;
Zastosowanie: ogniwo to obecnie jest nie stosowane.
OGNIWO POLARYZACYJNE
Przypuśćmy, że w elektrolicie są zanurzone dwie jednakowe elektrody metalowe, np. dwie płytki platynowe w roztworze wodnym siarczanu miedzi, to ten układ nie daje SEM różnej od zera. Jeżeli układ ten podłączymy do źródła zewnętrznego, wówczas na elektrodzie platynowej służącej za katodę wydzieli się miedź, a przy anodzie wydzieli się jon SO4-2. wskutek tego naruszy się symetria elektrod: jedna z nich będzie pokryta warstwą miedzi, druga zaś błoną tlenu. Zanurzone w roztwór elektrody nie będą już takie same więc powstanie ogniwo galwaniczne o pewnej SEM, tzw. ogniwo polaryzacyjne.
Jeżeli to ogniwo odłączymy od zewnętrznego źródła SEM i zewrzemy przez jakikolwiek opór, da ono prąd, który płynąć będzie dopóty, dopóki w wyniku zachodzących w porządku odwrotnym reakcji chemicznych nie zostanie znów przywrócona symetria elektrod (dopóki ogniwo się nie rozładuje).
AKUMULATORY
Akumulator to urządzenie do magazynowania energii. W fazie ładowania jest przetwornicą energii (np. prądnicą) gromadzi energię, którą następnie oddaje, w fazie rozładowywania, odbiornikowi (np. latarce).
Akumulator składa się z dwóch jednakowych przewodników pierwszego rodzaju i przewodnika drugiego rodzaju (elektrolitu). Jest to ogniwo polaryzacyjne. Jednak aby akumulator okazał się wartościowym praktycznie, powinien spełniać dwa warunki:
polaryzacja elektrod powinna być trwała,
procesy zachodzące w akumulatorze powinny być odwracalne.
Pierwszy warunek konieczny jest do tego, aby akumulator nie rozładował się sam, gdy nie pobiera się z niego prądu; drugi - aby nie zachodziły w nim zmiany, które powodowałyby jego nieprzydatność do dalszej pracy.
Pierwszy akumulator techniczny składał się z dwóch płytek ołowianych zanurzonych w roztwór wodny kwasu siarkowego (H2SO4). Był to akumulator ołowiowy.
Płytki ołowiane, rozpoczynając reakcję chemiczną z kwasem siarkowym, pokrywają się na powierzchni warstwą siarczanu ołowiu (PbSO4).
Pojemność akumulatora określamy tą ilością elektryczności, którą oddaje on przy rozładowywaniu się zachodzącym w okresie zmniejszania się jego siły elektromotorycznej od 2,7 do 1,85V. Pojemność tę mierzy się zwykle w amperogodzinach (1 amperogodzina = 3600 kulombów).
Sprawnością akumulatora nazywamy stosunek energii oddawanej przy rozładowywaniu do energii zużywanej przy jego ładowaniu. Sprawność nowoczesnych ołowianych akumulatorów osiąga wartość 80%.
Zależnie od wymagań technicznych akumulatory łączy się w baterie. Większe baterie akumulatorów mają pojemności setek i tysięcy amperogodzin i dają SEM setek woltów.
W zależności od rodzaju magazynowanej energii rozróżniamy m.in. akumulatory: bezwładnościowe, cieplne, hydrauliczne, pneumatyczne i najczęściej stosowane akumulatory elektryczne.
AKUMULATOR ELEKTRYCZNY AKUMULATOR OŁOWIANY
Obecnie obok akumulatorów ołowianych używa się również akumulatorów zasadowych żelazowo - niklowych. Katodą są w nich płytki z porowatego żelaza. Anodę stanowi wodorotlenek niklu Ni(OH)3. elektrolitem jest roztwór zasady KOH. Akumulatory te mają SEM = 1,45V. Ich sprawność jest mniejsza aniżeli akumulatorów ołowianych i nie przewyższa 60%. Lecz są one lżejsze, prostsze w eksploatacji i zdolne do krótkotrwałego wytrzymywania bardzo silnych prądów.
W najczęstszym użyciu są akumulatory kwasowe (ołowiowe) i zasadowe (niklowo - żelazowe, srebrowo - cynkowe, niklowo - kadmowe).
Techniczne zastosowania akumulatora są nadzwyczaj różnorodne. Stosuje się je m.in. do zasilania przenośnej aparatury różnego typu (np. pomiarowej), silników napędzających wózki elektryczne oraz urządzeń elektrycznych i elektronicznych w pojazdach. Stosowany do rozruchu i oświetlenia samochodu, a także do napędu pojazdów elektrycznych.
AKUMULATOR NiMH
Akumulatory NiMH znane są od połowy lat 70. Prace nad ich rozwojem zintensyfikowano ostatnio, ze względu na wymogi ochrony środowiska, szkodliwość działania akumulatorów NiCd i możliwość ich zastąpienia przez akumulatory NiMH. Faktycznie ten typ akumulatorów ma pewne zalety w stosunku do akumulatorów NiCd, ale również liczne wady. W wielu dzisiejszych urządzeniach będzie można zastąpić szkodliwe akumulatory NiCd, ale w wielu innych zastosowaniach (np. napędy elektryczne o dużym chwilowym poborze prądu większym od 5C), gdzie wykorzystuje się charakterystyczne ich własności, trzeba będzie jeszcze z tym poczekać.
NiMH jest akumulatorem charakteryzującym się najwyższą gęstością energii z ogniw znajdujących się na rynku. Jest to największa zaleta akumulatora NiMH w porównaniu z NiCd. Zasada działania ogniwa opiera się na magazynowaniu gazowego wodoru w stopie metalu. Płytka niklowa stanowi elektrodę dodatnią, a elektrodą ujemną jest specjalny stop metali ziem rzadkich, niklu, magnezu, manganu, aluminium i kobaltu. Skład procentowy jest pilnie strzeżony przez producentów. Separator wykonuje się z poliamidu lub polietylenu. Elektrolit jest zasadowy, przy ładowaniu i rozładowaniu wodór przemieszcza się pomiędzy elektrodami. Zdolność pochłaniania wodoru przez stop decyduje o pojemności akumulatora. SEM = 1,2 V.
NiMH jest jedynym typem akumulatora, który nie zawiera metali ciężkich, zanieczyszczających otoczenie i dlatego jest znacznie korzystniejszy dla środowiska niż inne typy. Stosunek ciężaru do pojemności jest jego kolejną zaletą. Jest to również ogniwo o największej gęstości energii. Czas życia jest dobry przy pracy pełnymi cyklami ładowania i rozładowania, ale nie wypada korzystnie przy ładowaniu podtrzymującym. Nie dotyczy to jednak ogniw pastylkowych, które mają własności takie same, jak ich odpowiedniki NiCd. Ładowanie wymaga bardziej precyzyjnej kontroli niż dla innych typów akumulatorów. Podobnie jak w akumulatorach NiCd, parametry ogniwa NiMH zależą od temperatury, dlatego powinna być bezwzględnie przestrzegana znamionowa temperatura pracy.
OGNIWA NIEREGENEROWALNE
Jednym z najstarszych ogniw nieodwracalnych (mogą być wykorzystane jednokrotnie) jest ogniwo Leclanchégo.
OGNIWO LECLANCHÉGO - SUCHE
Jest to ogniwo nieregenerowalne. Opracowane zostało w 1877 roku przez francuskiego chemika G. Leclanchego; SEM = 1,5V
Budowa:
dodatnią elektrodę stanowi węgiel;
ujemną - cynk;
elektrolitem jest 20% roztwór salmiaku NH4Cl;
depolaryzatorem jest MnO2, który otacza elektrodę węglową w postaci sproszkowanej;
elektrolit zmieszany jest z trocinami i mąką tworząc ciasto wypełniające ujemną elektrodę, którą jest cynkowy kubeczek.
Ogniwo Leclanchego występuje w postaci suchej (najbardziej rozpowszechnionej) i mokrej; jako depolaryzator występuje dwutlenek manganu w formie warstw materiału utleniającego wodór. Mechanizm procesów zachodzących na ogniwie Leclanchego nie został do końca wyjaśniony.
Zastosowanie: suche ogniwo Leclanchego spotykamy w handlu jako popularne bateryjki do drobnego sprzętu elektronicznego: piloty do TV, walkmany, zegarki, latarki itp.
BATERIA
Bateria, zespół identycznych lub podobnych elementów technicznych: urządzeń, przyrządów, źródeł energii itp., połączonych w jeden układ i pracujących jako całość. Dzięki zsumowania efektów działania swych części składowych pozwala zwiększyć moc, temperaturę, wydajność, wartość napięcia elektrycznego (np. bateria grzewcza, bateria koksownicza, bateria akumulatorowa) lub uzyskać inne efekty niemożliwe albo trudne do osiągnięcia w urządzeniach izolowanych (np. bateria wodociągowa, czyli zespół dwóch kurków w jednym korpusie - umożliwia mieszanie się zimnej i gorącej wody w jednym strumieniu).
OGNIWO LITOWE
Ilość energii, jaką można uzyskać z konkretnego ogniwa zależy od ilości wprowadzonych do obudowy zewnętrznej materiałów elektrodowych, czyli substratów reakcji. Wielkość tę nazywamy energią ogniwa - e, zaś energię, jaką możemy uzyskać z jednostki masy materiałów elektrodowych, nazywamy energią właściwą ogniwa - ew, wyrażaną w watogodzinach na kilogram sumy mas materiałów elektrodowych.
Energię właściwą rozpatrujemy w dwóch kategoriach:
jako energię teoretyczną eWT
jako energię praktyczną, eWP
Energia właściwa klasycznego wodnego ogniwa Leclanchégo wynosi 393 Wh/kg i SEM = 1,5 V.
Dla ogniw drugiej generacji - litowych, gdzie materiałem anodowym jest lit metaliczny, uzyskujemy energię właściwą eWT = 1090 Wh/kg.
Wartości energetyczne są wielokrotnie wyższe od ogniwa Leclanchego, stąd nazwa wysokoenergetyczne ogniwa litowe.
OGNIWO SŁONECZNE (FOTOELEKTRYCZNE)
Ogniwa słoneczne przetwarzają światło na energię elektryczną. Ogniwo słoneczne może być produkowane z wielu różnych pierwiastków, ale najczęściej używanym jest krzem. Mówi się o ogniwach pojedynczych (monokrystalicznych), wielokrystalicznych (polikrystalicznych) albo cienkowarstwowych (amorficznych). Różnica między ogniwem mono- i polikrystalicznym nie jest zbyt duża, właściwie chodzi o różny sposób produkcji materiału bazowego ogniwa. Dzięki jednolitemu materiałowi ogniwo monokrystaliczne ma nieco wyższą sprawność, tzn, że wytwarza nieco więcej energii na jednostkę powierzchni, niż ogniwo polikrystaliczne. Różnica jest jednak niewielka, 12-15% dla monokrystalicznego i 10-14 % dla polikrystalicznego.
Zwykłe ogniwo słoneczne z krystalicznego krzemu o wymiarach ok. 10 x 10 cm ma nominalne napięcie ok. 0,5 V. Poprzez połączenie szeregowe ogniw słonecznych, można otrzymać tzw. baterie słoneczne. Istnieją baterie z różną ilością ogniw, w zależności od zastosowania, jak i od jakości ogniw. Bateria słoneczna, która będzie używana do ładowania baterii ołowiowych na naszej długości i szerokości geograficznej, potrzebuje conajmniej 30 ogniw, jeśli chodzi o monokrystaliczne, i 32 ogniwa, jeżeli chodzi o ogniwa polikrystaliczne. Przy wzrastającej temperaturze napięcie ogniwa spada, co oznacza, że może być potrzebna bateria z jeszcze większą ilością ogniw. Zwykła bateria składająca się z 30-32 ogniw ma maksymalną moc rzędu 40-45W. Technika cienkowarstwowa oferuje bardzo wiele zalet z punktu widzenia możliwości produkcyjnych, ponieważ można bardzo dokładnie określić charakterystykę poprzez ułożenie wzoru połączeń w specjalny sposób. Bateria cienkowarstowa produkowana jest w ten sposób, że nakłada się cienką warstwę aktywnego materiału na specjalnie przygotowaną szybę ze szkła. Następnie można przy pomocy lasera wycinać ogniwa w pożądanych wielkościach i ilościach. Niestety sprawność tego typu ogniw jest znacznie niższa niż ogniw krystalicznych, ale do prostych zastosowań, np. do zasilania kalkulatorów, ten typ stał się bardzo powszechny. Standardowa bateria cienkowarstwowa do ładowania akumulatorów ma zazwyczaj moc ok. 10W.
Baterii słonecznych używa się normalnie do ładowania akumulatorów lub do bezpośredniego zasilania jakiegoś rodzaju urządzeń np. pompy wodnej, wentylatora itp.
Akumulatory mogą być różnych typów. Zwykły typ akumulatora samochodowego nie jest odpowiedni, ze względu na to, że jest skonstruowany tak, żeby oddawać dużo energii w ograniczonym czasie, a nie do tego, aby dawać mniejsze ilości energii w dłuższym czasie, co ma zazwyczaj miejsce tam, gdzie mamy do czynienia z urządzeniami słonecznymi. Do tego celu doskonale nadają się akumulatory ogólnego przeznaczenia, np. takie jak stosowane w układach podtrzymywania zasilania.
Baterie słoneczne powinny być montowane w ten sposób, aby były maksymalnie wyeksponowane do światła. Moc wyjściowa jest wprost proporcjonalna do ilości energii odbieranej z baterii. Panele krystaliczne są szczególnie wrażliwe na zaciemnienie i nawet jeżeli jedno ogniwo w baterii jest zacienione traci się dużą część energii. Półcień nie jest tak niebezpieczny, jak całkowite zacienienie. Bateria słoneczna produkuje energię również wówczas, gdy słońce jest za chmurami, lecz oczywiście energia, która jest produkowana jest zależna od natężenia promieniowania świetlnego. W słoneczny, letni dzień napromieniowanie wynosi do 1000 W/m2 i w tym czasie można ładować akumulator maksymalnie prądem 3A, o ile oczywiście jest on już w pełni naładowany. W pochmurny, letni dzień napromieniowanie może wynieść tylko ok. 200 W/m2 i wówczas prąd nie będzie większy niż ok. 0,5 A.
Niestety energia fotoelektryczna jest obecnie 10 - krotnie droższa niż energia jądrowa. Należy jednak uwzględnić, że ogniwa słoneczne tanieją a koszty pozyskiwania energii w elektrowniach jądrowych drożeje.
OGNIWO PALIWOWE
Korzeni tej technologii należy się doszukiwać jeszcze w XIX wieku, ale dopiero dziś zaczyna ona przynosić owoce. Sir William Grove, brytyjski sędzia i uczony skonstruował już w 1839 roku pierwsze ogniwo paliwowe.
W pierwszym ogniwie paliwowym, jego wynalazca wykorzystywał reakcję łączenia wodoru z tlenem do bezpośredniego wytwarzania prądu elektrycznego. Ogniwo takie nie ma części ruchomych, działa bezszumowo, a jego jedyną substancją odpadową jest woda. Wiele lat potem naukowcy z NASA wykorzystali tę genialnie prostą ideę i rozwinęli technologię do poziomu umożliwiającego wykorzystanie jej w pojazdach kosmicznych Apollo, Gemini, Skylab i innych, aby produkować energię elektryczną i wodę pitną.
Jeszcze pod koniec lat 80-tych ogniwa paliwowe lekceważono z powodu ich wysokiej ceny. Koszt takich urządzeń był, niestety, astronomiczny i sięgał 100 000 dolarów za kilowat. Teraz sytuacja zmienia się w szybkim tempie, zwłaszcza dzięki istotnym zaletom ekologicznym. Specjaliści oceniają, że zastąpienie tradycyjnych metod wytwarzania energii elektrycznej z węgla przez ogniwa paliwowe powinno zmniejszyć emisję dwutlenku węgla o 40% - 60%, zaś emisję tlenków azotu o 50% - 90%.
Coraz częściej spotyka się informacje o komercyjnych zastosowaniach ogniw paliwowych, nawet w celach energetycznych. Firma Southern California Gas Co. opracowała instalacje o mocy 200 kW dla jednego z hoteli, trzech szpitali i paru innych instytucji publicznych. Ambitne plany przewidują budowę elektrowni o mocy 2 MW.
Największe zainteresowanie przejawia jednak przemysł motoryzacyjny, a jest to spowodowane dwoma czynnikami: dążeniem do zwiększania sprawności napędu oraz wymuszanym przez ekologię ograniczaniem emisji zanieczyszczeń do środowiska naturalnego, w którym żyjemy. Specjaliści renomowanego amerykańskiego Instytutu Energetyki EPRI (Electric Power Research Institute) twierdzą, że nie ma drugiej, równie czystej technologii jak ogniwa paliwowe. W zasadzie jest to "czarna skrzynka", do której z jednej strony doprowadza się paliwo, a z drugiej uzyskuje prąd elektryczny - przy wysokim współczynniku sprawności wykorzystania paliwa i nikłej emisji zanieczyszczeń. Jako paliwo najprościej byłoby wykorzystywać wodór, ale lepiej używać gazu ziemnego, którego głównym składnikiem (około 90%) jest metan CH4, zaś najbezpieczniej - metanolu CH3OH.
Zarówno zwykłe baterie elektryczne, jak i ogniwa paliwowe wytwarzają prąd elektryczny dzięki reakcjom elektrochemicznym. W ogniwie paliwowym, zasilanym gazem ziemnym, cały proces zaczyna się od wydzielania czystego wodoru w urządzeniu zwanym reformerem. Następnie wodór trafia do właściwego ogniwa, wywołując kolejne reakcje chemiczne, w wyniku których powstaje prąd stały. Następnie zostaje on w przetwornicy przekształcony na prąd zmienny, z którego łatwiej można korzystać. Jak długo do właściwego ogniwa paliwowego dopływa wodór i tlen, tak długo wytwarza ono prąd elektryczny, ciepło i wodę. Siła elektromotoryczna pojedynczego ogniwa wynosi około 1 wolta, lub mniej, a natężenie prądu elektrycznego w obwodzie zależy od powierzchni elektrod. Napięcie można zwiększać łącząc ze sobą szeregowo wiele takich ogniw - jak plastry wafli przekładanych nieprzepuszczalnymi dla elektrolitu, lecz przewodzącymi prąd elektryczny, membranami - zwiększając w ten sposób ich wydajność. Stos kilku niewielkich ogniw może dostarczyć moc paru watów, zaś wiele ogniw o powierzchni metra kwadratowego jest w stanie generować setki kilowatów.
Istnieje wiele typów ogniw paliwowych, różniących się między sobą konstrukcją, materiałem elektrod, rodzajem elektrolitu i katalizatorów. W ogniwach wytwarzających energię elektryczną i wodę, przeznaczonych dla promów kosmicznych, NASA stosuje np. wodorotlenek potasu. Ale najbardziej uniwersalnymi i niezawodnymi urządzeniami, mającymi za sobą dorobek długotrwałych prac badawczo - rozwojowych, są ogniwa wykorzystujące kwas fosforowy oraz ogniwa z membranami polimerowymi.(...)
Wizja sprawnych, praktycznych aut z napędem elektrycznym kusiła producentów samochodów od dziesięcioleci. Trwa wyścig technologów, opracowujących akumulatory elektryczne o możliwie dużym stosunku zapasu energii do masy. Dużym sukcesem jest opracowanie baterii litowo-jonowych, mających pojemność trzykrotnie większą od akumulatorów klasycznych przy tej samej masie - wynoszącą 120 Wh/kg. Jednakże bardziej atrakcyjne od takich akumulatorów są ogniwa paliwowe, których nie trzeba długo doładowywać, a wystarczy tylko uzupełniać zapas paliwa, co trwa znacznie krócej.
Ponieważ bezpośrednie operowanie wodorem jest bardzo niebezpieczne konstruktorzy zdecydowali się jako źródło wodoru wykorzystać metanol. Reakcja w ogniwie paliwowym zachodzi w temperaturze 80 - 90 stopni Celsjusza przy ciśnieniu 3,0 bar. Ogniwo paliwowe wspomagane jest baterią akumulatorową, składającą się z 44 ogniw NiMH połączonych szeregowo. (...)
Realnie patrząc możemy się spodziewać, że pierwsze modele pojazdów z tym nowoczesnym źródłem energii wejdą do produkcji w latach 2002 - 2005, ponieważ wiele zagadnień technicznych i technologicznych wymaga jeszcze dopracowania. Ale warto, ponieważ - poza oczywistymi zaletami jeśli chodzi o ochronę środowiska - ogniwa paliwowe umożliwią zmniejszenie zapotrzebowania na ropę naftową. Poza tym ogólna sprawność samochodów z ogniwami paliwowymi oscyluje wokół 30%, podczas gdy w przypadku pojazdów z silnikami spalinowymi sprawność ta nie przekracza kilkunastu procent (zwykle około 10%). Technologowie myślą też o miniaturyzacji ogniw PFM. Różne firmy opracowują 25-watowe baterie, mające zastąpić baterie niklowo-kadmowe używane w wideo-kamerach. Źródłem paliwa ma być mały patron ze sprężonym wodorem, wystarczający na 2 godziny pracy kamery. Firma pracuje również nad zasilaczem PEM dla laptopów, nie większym od konwencjonalnej baterii i umożliwiającym 16 godzin pracy oraz nad czujką dymu o żywotności 20 lat.
W poszukiwaniu mocniejszych i trwalszych źródeł energii elektrycznej naukowcy sięgają po mniej znane i mało opanowane rozwiązania ogniw paliwowych ze stopionymi węglanami i zestalonymi tlenkami. Oba rodzaje mają przetwarzać paliwo na prąd elektryczny ze sprawnością 50% - 60%. Ogniwa te charakteryzują się wysoką temperaturą pracy: ogniwa ze stopionymi węglanami pracują w temperaturze 650 stopni Celsjusza, a ogniwa tlenkowe w temperaturze zbliżonej do 1000 stopni Celsjusza. Oznacza to, że powstająca jako produkt uboczny woda ma postać pary przegrzanej, którą można wykorzystywać do napędzania konwencjonalnej turbiny parowej z dodatkowym generatorem elektrycznym, albo do grzania wody. Wysoka temperatura pracy umożliwia też bezpośrednie wykorzystywanie gazu ziemnego jako paliwa (zamiast czystego wodoru).
Ogromne zainteresowanie wzbudzają ogniwa paliwowe z zestalonym tlenkiem, których technologia jest najtrudniejsza, ale osiągi są niezwykle obiecujące. Przewiduje się, że tego rodzaju ogniwa znajdą zastosowanie w dużych, przemysłowych zakładach energetycznych, lub statkach transoceanicznych.
Pomysłów na tlenkowe ogniwa paliwowe jest wiele. Jeden z nich polega na tym, aby zamiast rur ZTEC zaprasować elektrody z elektrolitem w postaci płaskiego, sztywnego dysku. Stos 16-tu takich ogniw ma zaledwie jeden cal wysokości (2,54 cm). Setki takich ogniw upakowane razem w sztywnej obudowie, mającej postać litery U, tworzy podstawowy blok o mocy 25 kW. Takie rozwiązanie konstrukcyjne umożliwia szybkie uruchamianie i skuteczne odprowadzanie ciepła. Konstruktorzy przewidują, że elektrownia z ogniwami paliwowymi o mocy 2,5 MW zmieści się na 18-kołowej przyczepie, którą będzie można łatwo przewieźć w potrzebne miejsce. Do jej pracy wystarczy otaczające urządzenie powietrze i rurociąg doprowadzający gaz ziemny, a powstająca para będzie napędzać turbogenerator.
Pozostają jednak problemy związane ze starzeniem się ogniw paliwowych. Zanieczyszczenia zawarte w paliwie powodują stopniowe zatykanie porowatych elektrod, co nieuchronnie ogranicza przepływ jonów wodoru i tlenu, zmniejszając wydajność prądową. Konstruktorzy starają się stworzyć zestawy o żywotności nie mniejszej niż 40.000 godzin (co będzie oznaczało konieczność wymiany całego bloku co 5 - 7 lat). Ważnym czynnikiem ograniczającym rozwój tej nowoczesnej technologii jest nieubłagana ekonomia. Budowa konwencjonalnej elektrowni jest znacznie tańsza od obiektu z ogniwami paliwowymi. A bez zamówień na ogniwa paliwowe producenci nie mogą uruchomić ich masowej, a więc tańszej i zautomatyzowanej produkcji. Zainteresowane firmy szacują, że uruchomienie produkcji ogniw o łącznej mocy 200 MW rocznie pozwoliłoby obniżyć ich cenę detaliczną o połowę.
Warto sobie uświadomić, jak ogromnych środków wymaga usuwanie tlenków siarki i azotu ze spalin w elektrowniach konwencjonalnych. Ogniwa paliwowe takich zanieczyszczeń nie wytwarzają w ogóle, a emisja tlenku węgla jest niższa od jego zawartości w powietrzu atmosferycznym. Może więc inwestorom bardziej opłacałoby się inwestować w dopracowanie technologii i uruchomienie masowej produkcji ogniw paliwowych, aniżeli przeznaczać ogromne środki na dopracowywanie starych i opracowywanie wciąż nowych metod oczyszczania spalin w elektrowniach konwencjonalnych.
Ogniwa paliwowe mają jeszcze jedną cechę, którą trudno uwzględniać podczas chłodnych kalkulacji kosztów i korzyści: jest to praktyczne rozwiązanie pobudzające naszą wyobraźnię. Wielu specjalistów widzi w nich jeszcze jedno ważne, ekologicznie czyste źródło energii w XXI wieku.
MAŁA ELEKTRONIKA
Stosuje się wiele różnorodnych ogniw wodnych i niewodnych jednorazowego lub wielokrotnego użytku.
Ważną rolę w zasilaniu małej elektroniki spełniają ogniwa wielokrotnego użytku (akumulatorki) o układzie elektrodowym Cd/NiO(OH) przy zastosowaniu wodnych stężonych roztworów wodorotlenku potasu. Schemat ogniwa: Cd | KOHaq | Ni(OOH); SEM = 1,35V.
Rozmiary tych baterii są bardzo zróżnicowane w zależności od potrzeb. Liczba cykli rozładowania i ładowania sięga setek razy.
Z wysokoenergetycznych niewodnych ogniw litowych najszersze zastosowanie zyskał układ jednorazowego użytku: Li/ gamma-MnO2; SEM = 3V; eWT = 752 Wh/kg.
Jako roztwór elektrolitu stosuje się np. nadchloran litu w węglanie propylenu. Ogniwa te o napięciu 3V zasilają różnorodne urządzenia elektroniczne wymagające zarówno bardzo małych, od 5 mikroamperów, jak i dość dużych prądów do 0,5A.
MEDYCYNA - STYMULATORY SERCA
W przypadku ogniw stosowanych w medycynie - stymulatorach pracy serca, niezwykle istotna jest możliwość długiej, bezawaryjnej pracy, przy bardzo małym poborze prądu.
Najlepszym, obecnie prawie wyłącznie stosowanym źródłem (SEM = 2,80V) prądu w tego typu urządzeniach są ogniwa o układzie elektrodowym Li/I2-PVP, gdzie jod występuje w postaci kompleksu z poliwinylopirydyną (PVP).
Charakterystyczne jest, iż produkt powyższej reakcji jodek litu pełni funkcję separatora oraz wykazuje właściwości stałego elektrolitu. Zwiększa to stabilność układu oraz powoduje wydłużenie czasu pracy ogniwa.
Przykład ogniwa o układzie Li/I2-PVP; rozmiar 4mm.
W temperaturze 370C, a więc zbliżonej do temperatury ciała ludzkiego, ogniwo przy obciążeniu rzędu 100 kOhm (opór stymulatora), pracuje przez 6 lat przy niemal stałym napięciu (2,63 - 2,62V) i natężeniu 30 mikroamperów.
Warunki pracy: Pobór prądu: 30 mikroamperów, temp: 370C.
Obecnie stosuje się wyłącznie stymulatory pracujące na żądanie, czyli jedynie wówczas, gdy rytm pracy serca jest nieprawidłowy. W związku z tym ogniwo przechodzi w trakcie swego życia okresy pracy i okresy bezczynności, a tym samym wydłużony jest czas jego życia (do 10 lat).
TELEFONIA BEZPRZEWODOWA
Ogólny wzór układu elektrodowego stosowanego w bateriach, a więc urządzeniach o wielokrotnych możliwościach zasilania i ładowania: MHn/NiO(OH).
Najczęściej są to stabilne wodorki związków międzymetalicznych o wiązaniu metalicznym (metale grup od III do VIII): LaNi5H6 i TiFeH2 i ZrNiH3.
Wodór jako atrakcyjne paliwo jest znacznie bardziej bezpieczny przy magazynowaniu go w formie wodorków metali, niż jako skroplona ciecz.
Uzyskuje się dużą gęstość objętościową wodoru przekraczającą na ogół gęstość objętościową ciekłego wodoru przy nieporównanie mniejszym prawdopodobieństwie wybuchu.
Schemat baterii: MHn | KOHaq | NiO(OH).
Stopy wieloskładnikowe odwracalnie absorbujące i desorbujące wodór stosowane są również jako materiał elektrod wodorowych w ogniwach paliwowych.
W odwracalnych wyżej omówionych bateriach alkalicznych jako najnowsze związki wyjściowe do tworzenia chemiwodorków zaczęto stosować stopy międzymetaliczne.
Stopy te wykazują dużą pojemność absorpcji wodoru już przy ciśnieniu zbliżonym do atmosferycznego.
AKUMULATORY LITOWO - JONOWE
W telefonii bezprzewodowej jak również w wielu innych urządzeniach zwanych małą elektroniką, do zasilania urządzeń stosuje się również najnowszej generacji tzw. akumulatory litowo - jonowe. W takim elektrochemicznym odwracalnie pracującym ogniwie materiałem anodowym (źródłem elektronów) jest materiał węglowy, np. grafity, grafitowane węgle, koksy z wprowadzonymi (interkalowanymi) atomami litu, a nie czysty metaliczny lit.
Materiałem katodowym są tlenki metali, np. dwutlenek manganu (MnO2), kobaltu (CoO2), molibdenu (MoO2) niklu (NiO2) lub tytanu (TiO2) o właściwościach półprzewodnikowych i strukturze warstwowej.
ZASTOSOWANIA W ASTRONAUTYCE I WOJSKOWOŚCI
Urządzenia w łodziach podwodnych i sondach kosmicznych wymagają wysokoenergetycznych ogniw pracujących w szerokim zakresie temperatur ujemnych i dodatnich. Warunki te spełniają właśnie ogniwa litowo - tionylowe Li/SOCl2; SEM=3,61V, eWT = 1876 Wh/kg.
Ogniwa litowo-tionylowe pojawiły się na początku lat siedemdziesiątych, obok innych ogniw wykorzystujących ciekłe materiały katodowe, jak chlorek sulfurylu (SO2Cl2) i chlorek fosforylu (POCl3). Związki te pełnią podwójną rolę materiału katodowego i rozpuszczalnika. Dzięki temu odpada konieczność stosowania oddzielnego rozpuszczalnika, który zwiększałby tylko masę układu (roztworem jest najczęściej czterochloroglinian litu w tymże chlorku tionylu). Ogniwa litowo - tionylowe posiadają wysoką wartość teoretycznej energii właściwej równą 1876 Wh/kg (dla porównania energia właściwa ogniwa Leclanchégo wynosi 393Wh/kg).
Bardzo wielką zaletą ogniwa litowo - tionylowego jest szeroki przedział temperatur, w jakim może być ono stosowane. Faza ciekła chlorku tionylu obejmuje bowiem szeroki zakres od - 104,5°C do +77° C. Ogniwa te mogą pracować, chociaż z mniejszą wydajnością nawet w temperaturach poniżej - 40° C. Pozwala to na stosowanie tych ogniw w warunkach ekstremalnie niskiej temperatury, np. w technologii lotniczej, zasilaniu urządzeń sztucznych satelitów i sond kosmicznych (zostały one np. zastosowane w sondzie kosmicznej Pathfinder, badającej powierzchnię Marsa), w łodziach podwodnych itp. Dlatego też przez wiele lat kosztowne prace badawcze nad ogniwami litowo - tionylowymi finansowane były głównie przez instytucje wojskowe.
LITERATURA:
Frisz S., Timoriewa A. Kurs fizyki tom II PWN Warszawa 1965;
Chyla K. Fizyka dla uczniów liceów ogólnokształcących Wyd. DEBIT 1996;
Chyla K. Fizyka dla II klasy gimnazjum Wyd. DEBIT 2000;
Pazdro Krzysztof M., Danikiewicz W. Chemia dla licealistów część 2 Oficyna Edukacyjna;
Chemia fizyczna pod red. Bogdana Kamieńskiego - PWN;
Powszechna encyklopedia PWN - 1976 r.;
http://www.avt.com.pl/
http://www.encyklopedia.pl
http://www.chemia.px.pl
http://physics.uwb.edu.pl/
http://www.kodron.com.pl
http://physics.uwb.edu.pl
http://www.int.pan.wroc.pl
http://www.uni.opole.pl
http://www.chem.uni.wroc.pl
http://www.chem.uw.edu.plJAK DZISIAJ WYKORZYSTYWANE SĄ OGNIWA?
To jest temat rzeka. Są praktycznie wszędzie. W telefonach komórkowych, w samochodach, w kalkulatorach, w bateriach i akumulatorach. Ułatwiają nam codzienne życie i dają dostęp do wielu udogodnień. Dla niektórych z nas wręcz je umożliwiają.
CZY SĄ BEZPIECZNE DLA ŚRODOWISKA?
Ochrona środowiska to bardzo ważny obecnie temat. Różne formy wykorzystania ogniw są dla niej poważnym problemem. Produkcja i składowanie zużytych ogniw; co robimy z nimi, gdy już nie są nam potrzebne - a co powinniśmy robić; jak to robią inni.
OGNIWA GALWANICZNE
Strona 12
Wyszukiwarka
Podobne podstrony:
ogniwa galwaniczne, Chemia, Prezentacje
ogniwa galwaniczne, ₪₪ CHEMIA
OGNIWA GALWANICZNE SIŁA ELEKTROMOTORYCZNA OGNIW GALWANICZNY
ogniwa galwaniczne, Chemia, Prezentacje
ogniwa galwaniczne, fizyczna, chemia fizyczna, Fizyczna, laborki
Siła elektromotoryczna ogniwa galwanicznego, Studia, Politechnika
Chemiczne źródła energii elektrycznej Ogniwa galwaniczne
Cwiczenie4 chemia ogolna- hydroliza elektroliza ogniwa, Studia, Chemia, Chemia laboratoria
Siła elektromotoryczna ogniwa galwanicznego
8 TERMODYNAMIKA OGNIWA GALWANICZNEGO
37, REAL 37, Galwanometr jest elektrycznym przyrz˙dem pomiarowym, najcz˙˙ciej magnetoelektrycznym,
Ogniwa galwaniczne
Z Ogniwa galwaniczne
Ogniwagal.wzor, Chemia Fizyczna, chemia fizyczna- laborki rozne, Ogniwa
więcej podobnych podstron