Wstęp teoretyczny
Reakcje chemiczne w organizmach żywych zwykle zachodzą w obecności katalizatorów, zwanych enzymami. Pierwszy etap reakcji enzymatycznej to utworzenie kompleksu enzym-substrat [ES]. Substrat wiąże się ze specyficznym miejscem na cząsteczce enzymu, zwanym centrum aktywnym i przekształca się w produkt reakcji. W następnym etapie kompleks [EP] rozpada się z powrotem na wolny enzym i produkt (ew. produkty). Najprostszy schemat reakcji enzymatycznej przedstawia się następująco:
[E] + [S] [ES] [E] + [P]
Miara aktywności enzymu to początkowa szybkość reakcji przez niego katalizowanej, wyliczana z tak zwanej krzywej progresji. Pokazuje ona zależność ilości przetworzonego substratu (Δ[S]) lub powstałego w reakcji produktu (Δ[P]) od czasu jej trwania: [S] = f(t) lub [P] = f(t). Krzywa progresji obrazuje przebieg reakcji enzymatycznej w obecności enzymu o stałym stężeniu ([E] = const) i przy zadanym początkowym stężeniu substratu ([S0] = const). Na początku reakcji krzywa progresji jest funkcją liniową (tzn. Δ[P] i Δ[S] są wprost proporcjonalne do czasu), jednak po dłuższym czasie szybkość reakcji spada. Dlatego też szybkość początkowa reakcji stanowi podstawę do określenia aktywności enzymu i wyprowadzenia jego właściwości kinetycznych.
Charakterystyczną wielkością oznaczoną jako Km jest stała Michaelisa, czyli stężenie substratu, w którym szybkość reakcji równa jest połowie szybkości maksymalnej. Jest to również takie stężenie substratu, przy którym połowa cząsteczek enzymu została związana w kompleks [ES]. Zależność między szybkością reakcji, Vmax, stałą Km i [S] przedstawia równanie Michaelisa-Menten:
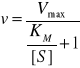
Km obrazuje zdolność wiązania się substratu do danego enzymu, natomiast odwrotność Km liczbowo określa powinowactwo enzymu do substratu i taka zależność to równanie Lineweavera-Burka:
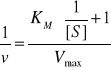
W naszym ćwiczeniu badania kinetyczne prowadzone były na przykładzie reakcji katalizowanej przez enzym INWERTAZĘ (β-fruktofuranozydazę, EC 3.2.1.26). Inwertaza to enzym należący do klasy hydrolaz i podklasy hydrolaz glikozydowych, który hydrolizuje disacharyd sacharozę do cukrów prostych fruktozy i glukozy (rozrywa wiązanie glikozydowe). Sacharoza jest bezbarwnym krystalicznym ciałem stałym, dobrze rozpuszcza się w wodzie i jest składnikiem cukru trzcinowego i buraczanego. Jest również cukrem nieredukującym, natomiast produkty jej hydrolizy to cukry redukujące, w związku z czym aktywność enzymu można obliczyć na podstawie pomiaru ich stężeń.
Inwertazę zwykle uzyskuje się z drożdży piekarniczych, choć znajduje się ona również w komórkach roślinnych (ściana komórkowa) oraz u człowieka, na wewnętrznej powierzchni komórek nabłonka jelita cienkiego. Jest aktywna w szerokim zakresie pH od 4 do 6 z optimum działania w pH około 4,7, natomiast enzym jest nieaktywny przy pH 2 i 9.
Inwertazę stosuje się w przemyśle spożywczym przy produkcji soków, mleka, wina oraz wyrobów cukierniczych. Pełni ona funkcję stabilizatora, zapobiegając krystalizacji cukru i utrzymując odpowiedni poziom wilgotności.
W ćwiczeniu wykorzystany został reaktor okresowy. Taki reaktor charakteryzuje się tym, że wymiana reagentów jest prowadzona cyklicznie (okresowo). Proces w nim zachodzący jest procesem nieustalonym, to znaczy że stężenie zmienia się w czasie, ale jest wyrównane w całej objętości reaktora. Substrat w reaktorze jest dokładnie mieszany, po czym następuje opróżnienie reaktora i proces można zacząć ponownie.
ŹRÓDŁA:
Skrypt do laboratorium z Instytutu Biochemii Politechniki Łódzkiej, ćw. nr 6 „Kinetyka reakcji enzymatycznych
(część II)”J.M.Berg, J.L.Tymoczko, L.Stryer, BIOCHEMIA wydanie piąte, Warszawa 2005, Wydawnictwo Naukowe PWN SA, s. 189-225
Inżynieria Bioreaktorów, prof. Andrzej Noworyta, notatki z wykładu
Cel ćwiczenia
Celem ćwiczenia jest zapoznanie się z procedurą postępowania przy wyznaczaniu stałych kinetycznych równania kinetycznego.
Materiały
inwertaza otrzymana nieodpłatnie z firmy Novozyme;
2 M roztwór sacharozy;
0.1 M bufor octanowy, pH 4.5;
odczynnik do oznaczania stężenia glukozy - odczynnik I (oksydaza glukozowa, peroksydaza, AAP, HBA, bufor fosforanowy)
Aparatura specjalna
spektrofotometr UV-VIS Shimadzu;
termostatowane reaktory mieszalnikowe
Wykonanie ćwiczenia
Pierwszym etapem było przygotowanie roztworów substratu i enzymu, używanych w dalszej części ćwiczenia. Substrat: do cylindra miarowego o pojemności 100 ml wprowadzono 50 ml 2M roztworu sacharozy („roztwór 1”), dodano 50 ml 0,1M roztworu buforu octanowego i dobrze wymieszano („roztwór 2”). Następnie tak utworzony roztwór w ilości 50 ml przelano do kolejnego cylindra i uzupełniono buforem do 100 ml, otrzymując roztwór 2x rozcieńczony od poprzedniego („roztwór 3”). Podobnie postąpiono z roztworami 4 i 5 (dwukrotne rozcieńczenia). Pozostałe 4 roztwory przyrządzono, pobierając 15 ml roztworu sacharozy i 30 ml buforu, rozcieńczając je kolejno trzykrotnie. Enzym: Przygotowano 20 ml roztworu wyjściowego enzymu inwertazy o stężeniu C0 równym 1 mg/ml w 0,1M buforze octanowym, dobrze wymieszano. Poprzez rozcieńczenie, przygotowano 2 osobne roztwory enzymu: do badań kinetycznych (I, stężenie 25x, 2 ml enzymu + 48 ml buforu octanowego) i do procesu w reaktorze okresowym (II, stężenie 4x, 2,5 ml enzymu + 7,5 ml buforu).
Następnie przygotowano test enzymatyczny do oznaczania glukozy. Do czystych, suchych probówek wprowadzono po 1 ml odczynnika do oznaczania glukozy („odczynnik I”). Przygotowano również 4 probówki na standardy glukozowe (3) i kontrolę do zerowania aparatu spektrofotometrycznego (1).
W kolejnej części do termostatowanych reaktorów mieszalnikowych ustawionych na temp.35°C wprowadzono po 20 ml przygotowanych wcześniej roztworów o zadanych stężeniach, zamknięto korkiem i włączono mieszanie. Po 15 min do reaktorów wprowadzono po 4 ml roztworu enzymu (I), jednocześnie włączono stoper i po 15 sek pobierano 10 μl mieszaniny z reaktora i wprowadzano do probówek z 1 ml odczynnika I (50 μl w przypadku reaktorów nr 8 i 9). Probówki mieszano i wstawiano na 5 min do łaźni wodnej (37°C). Kolejne próbki do analiz pobierano w odstępach czasowych: 1, 2, 3, 4 i 5 min oraz 2, 4, 6, 8 i 10 min (dla roztworów 1, 2 i 3). Po inkubacji w łaźni, badano absorbancję próbek przy 500 nm wobec próby kontrolnej (1 ml odczynnika I + 10 ul 0,1 M buforu octowego pH 4,5). Zapisano wyniki.
Wartości absorbancji dla 3 standardów glukozy uśredniono dla każdego reaktora; przyjęto, że średnie stężenie glukozy wynosi 15 mM. Z proporcji policzono stężenie w próbkach badanych (vide tabele).
Wykonano również pomiar stężenia glukozy podczas procesu hydrolizy sacharozy. Do reaktora mieszalnikowego o temp. 35°C wprowadzono 20 ml roztworu nr 5, włączono mieszanie i zatkano korkiem. Po 15 min wprowadzono 4 ml roztworu enzymu (II), jednocześnie włączono stoper. Po 15 sek pobrano 0,1 ml mieszaniny reakcyjnej i dodano do probówki z 0,4 ml 0,1M buforu octanowego o pH 4,5 (5-krotne rozcieńczenie próbek). Zamieszano i pobrano 10 μl, postępując jak opisano wcześniej. Kolejne próbki do analiz pobierano po czasi 5, 10, 15 i 20 min, a następne już co 10 min.
Wyniki i obliczenia
REAKTOR 1 |
(próbka z reaktora V=10ul) |
|||||
Csubstratu = 2000 mM |
||||||
Próbka |
Czas reakcji [min] |
Czas rzecz.reakcji [min] |
Abs500nm |
Cglukozy [mM] |
STANDARD |
Abs500nm |
1 |
0,25 |
0,25 |
0,202 |
3,09 |
1 |
0,986 |
2 |
2 |
2,17 |
0,292 |
4,46 |
2 |
0,963 |
3 |
4 |
4,17 |
0,407 |
6,22 |
3 |
0,996 |
4 |
6 |
6,08 |
0,342 |
5,23 |
średnia |
0,982 |
5 |
8 |
8,05 |
0,474 |
7,24 |
|
|
6 |
10 |
10,03 |
0,451 |
6,89 |
||
Stężenie produktu policzono z proporcji:
15nM standard glukozy - średnia absorbancja (0,982)
stężenie produktu X - absorbancja poszczególnych próbek
np. dla próbki nr 1: ![]()
[mM]
Aby lepiej ukazać liniową zależność stężenia produktu od czasu, usunięto punkty nr 4 i 6. Równanie prostej ma postać: y = 0,533x + 3,3028. Wyraz wolny (b) oznacza początkowe stężenie glukozy (Cglukozy,0).
Reaktor |
Csubstratu,0 [mM] |
Csubstratu,rzecz,0 [mM] |
Cglukozy,0 [mM] |
1 |
2000 |
1663,36 |
3,3028 |
Rzeczywiste stężenie substratu liczone było z zależności:
![]()
Dla reaktora nr 1: ![]()
[mM]
Należało policzyć rzeczywiste stężenie produktu w próbkach:
![]()
Np. dla próbki numer 2: ![]()
[mM]
Policzono również stopień przereagowania α: 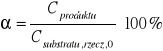
Np. dla próbki numer 2: ![]()
[%]
czas rzecz.reakcji [min] |
Cglukozy,0 [mM] |
Csubstratu,rzecz,0 [mM] |
Cproduktu [mM] |
α [%] |
0,25 |
3,3028 |
1663,36 |
-0,216* |
-0,013 |
2,17 |
|
|
1,159 |
0,070 |
4,17 |
|
|
2,916 |
0,175 |
6,08 |
|
|
1,923 |
0,116 |
8,05 |
|
|
3,94 |
0,237 |
10,03 |
|
|
3,589 |
0,216 |
* punkt nie był brany pod uwagę z racji, że stężenie produktu nie może być ujemne
Z nowego wykresu wyznaczono wartość szybkości reakcji r:
y = 0,309x + 0,3403 r = 0,309
REAKTOR 2 |
(próbka z reaktora V=10ul) |
Cstandardu = 15 mM |
||||
Csubstratu = 1000 mM |
|
|||||
Próbka |
Czas reakcji [min] |
Czas rzecz.reakcji [min] |
Abs500nm |
Cglukozy [mM] |
STANDARD |
Abs500nm |
1 |
0,25 |
0,25 |
0,190 |
3,06 |
1 |
0,935 |
2 |
2 |
2,08 |
0,280 |
4,51 |
2 |
0,924 |
3 |
4 |
4,08 |
0,423 |
6,82 |
3 |
0,932 |
4 |
6 |
6,13 |
0,312 |
5,03 |
średnia |
0,930 |
5 |
8 |
8,17 |
0,496 |
8,00 |
|
|
6 |
10 |
10,25 |
0,608 |
9,80 |
||
Stężenie produktu policzono z proporcji:
15mM standard glukozy - średnia absorbancja (0,930)
stężenie glukozy X - absorbancja poszczególnych próbek
np. dla próbki nr 1: ![]()
[mM]
Aby lepiej ukazać liniową zależność stężenia produktu od czasu, usunięto punkty nr 3 i 4. Równanie prostej ma postać: y = 0,6467x + 2,9896. Wyraz wolny (b) oznacza początkowe stężenie glukozy (Cglukozy,0).
Reaktor |
Csubstratu,0 [mM] |
Csubstratu,rzecz,0 [mM] |
Cglukozy,0 [mM] |
2 |
1000 |
830,34 |
2,9896 |
Rzeczywiste stężenie substratu liczone było z zależności:
![]()
Dla reaktora nr 2: ![]()
[mM]
Należało policzyć rzeczywiste stężenie produktu w próbkach:
![]()
Np. dla próbki numer 1: ![]()
[mM]
Policzono również stopień przereagowania α: 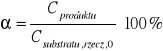
Np. dla próbki numer 1: ![]()
[%]
czas rzecz.reakcji [min] |
Cglukozy,0 [mM] |
Csubstratu,rzecz,0 [mM] |
Cproduktu [mM] |
α [%] |
0,25 |
2,9896 |
830,34 |
0,074 |
0,004 |
2,08 |
|
|
1,525 |
0,092 |
4,08 |
|
|
3,831 |
0,230 |
6,13 |
|
|
2,041 |
0,123 |
8,17 |
|
|
5,008 |
0,301 |
10,25 |
|
|
6,813 |
0,410 |
Z nowego wykresu wyznaczono wartość szybkości reakcji r:
y = 0,6467x + 3E-05 r = 0,6467
REAKTOR 3 |
(próbka z reaktora V=10ul) |
Cstandardu = 15 mM |
||||
Csubstratu = 500 mM |
|
|||||
Próbka |
Czas reakcji [min] |
Czas rzecz.reakcji [min] |
Abs500nm |
Cglukozy [mM] |
STANDARD |
Abs500nm |
1 |
0,25 |
0,33 |
0,135 |
2,10 |
1 |
0,961 |
2 |
2 |
2,17 |
0,217 |
3,38 |
2 |
0,941 |
3 |
4 |
4,17 |
0,359 |
5,59 |
3 |
0,986 |
4 |
6 |
6,08 |
0,320 |
4,99 |
średnia |
0,963 |
5 |
8 |
8,10 |
0,436 |
6,79 |
|
|
6 |
10 |
10,12 |
0,503 |
7,84 |
||
Stężenie produktu policzono z proporcji:
15mM standard glukozy - średnia absorbancja (0,963)
stężenie glukozy X - absorbancja poszczególnych próbek
np. dla próbki nr 1: ![]()
[mM]
Aby lepiej ukazać liniową zależność stężenia produktu od czasu, usunięto punkty nr 3 i 4. Równanie prostej ma postać: y = 0,5829x + 2,01. Wyraz wolny (b) oznacza początkowe stężenie glukozy (Cglukozy,0).
Reaktor |
Csubstratu,0 [mM] |
Csubstratu,rzecz,0 [mM] |
Cglukozy,0 [mM] |
3 |
500 |
414,66 |
2,01 |
Rzeczywiste stężenie substratu liczone było z zależności:
![]()
Dla reaktora nr 3: ![]()
[mM]
Należało policzyć rzeczywiste stężenie produktu w próbkach:
![]()
Np. dla próbki numer 1: ![]()
[mM]
Policzono również stopień przereagowania α: 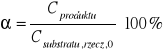
Np. dla próbki numer 1: ![]()
[%]
czas rzecz.reakcji [min] |
Cglukozy,0 [mM] |
Csubstratu,rzecz,0 [mM] |
Cproduktu [mM] |
α [%] |
0,33 |
2,01 |
414,66 |
0,094 |
0,006 |
2,17 |
|
|
1,371 |
0,082 |
4,17 |
|
|
3,584 |
0,215 |
6,08 |
|
|
2,976 |
0,179 |
8,10 |
|
|
4,784 |
0,288 |
10,12 |
|
|
5,828 |
0,350 |
Z nowego wykresu wyznaczono wartość szybkości reakcji r:
y = 0,5829x - 1E-05 r = 0,5829
REAKTOR 4 |
(próbka z reaktora V=10ul) |
Cstandardu = 15 mM |
||||
Csubstratu = 250 mM |
|
|||||
Próbka |
Czas reakcji [min] |
Czas rzecz.reakcji [min] |
Abs500nm |
Cglukozy [mM] |
STANDARD |
Abs500nm |
1 |
0,25 |
0,27 |
0,083 |
1,27 |
1 |
1,193 |
2 |
1 |
1,08 |
0,099 |
1,54 |
2 |
0,861 |
3 |
2 |
2,05 |
0,113 |
1,75 |
3 |
0,859 |
4 |
3 |
3,08 |
0,205 |
3,17 |
średnia |
0,971 |
5 |
4 |
4,15 |
0,249 |
3,84 |
|
|
6 |
5 |
5,00 |
0,274 |
4,24 |
||
Stężenie produktu policzono z proporcji:
15mM standard glukozy - średnia absorbancja (0,971)
stężenie glukozy X - absorbancja poszczególnych próbek
np. dla próbki nr 1: ![]()
[mM]
Aby lepiej ukazać liniową zależność stężenia produktu od czasu, usunięto punkt nr 3. Równanie prostej ma postać: y = 0,6662x + 1,0006. Wyraz wolny (b) oznacza początkowe stężenie glukozy (Cglukozy,0).
Reaktor |
Csubstratu,0 [mM] |
Csubstratu,rzecz,0 [mM] |
Cglukozy,0 [mM] |
4 |
250 |
207,33 |
1,0006 |
Rzeczywiste stężenie substratu liczone było z zależności:
![]()
Dla reaktora nr 4: ![]()
[mM]
Należało policzyć rzeczywiste stężenie produktu w próbkach:
![]()
Np. dla próbki numer 1: ![]()
[mM]
Policzono również stopień przereagowania α: 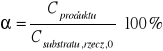
Np. dla próbki numer 1: ![]()
[%]
czas rzecz.reakcji [min] |
Cglukozy,0 [mM] |
Csubstratu,rzecz,0 [mM] |
Cproduktu [mM] |
α [%] |
0,27 |
1,0006 |
207,33 |
0,274 |
0,016 |
1,08 |
|
|
0,535 |
0,032 |
2,05 |
|
|
0,745 |
0,045 |
3,08 |
|
|
2,166 |
0,130 |
4,15 |
|
|
2,838 |
0,171 |
5,00 |
|
|
3,237 |
0,195 |
Z nowego wykresu wyznaczono wartość szybkości reakcji r:
y = 0,6662x + 4E-05 r = 0,6662
REAKTOR 5 |
(próbka z reaktora V=10ul) |
Cstandardu = 15 mM |
||||
Csubstratu = 125 mM |
|
|||||
Próbka |
Czas reakcji [min] |
Czas rzecz.reakcji [min] |
Abs500nm |
Cglukozy [mM] |
STANDARD |
Abs500nm |
1 |
0,25 |
0,27 |
0,030 |
0,46 |
1 |
0,974 |
2 |
1 |
1,03 |
0,082 |
1,25 |
2 |
0,995 |
3 |
2 |
2,02 |
0,139 |
2,11 |
3 |
0,989 |
4 |
3 |
3,02 |
0,143 |
2,18 |
średnia |
0,986 |
5 |
4 |
4,00 |
0,203 |
3,09 |
|
|
6 |
5 |
5,00 |
0,214 |
3,26 |
||
Stężenie produktu policzono z proporcji:
15mM standard glukozy - średnia absorbancja (0,986)
stężenie glukozy X - absorbancja poszczególnych próbek
np. dla próbki nr 1: ![]()
[mM]
Aby lepiej ukazać liniową zależność stężenia produktu od czasu, usunięto punkty nr 4 i 6. Równanie prostej ma postać: y = 0,6896x + 0,4652. Wyraz wolny (b) oznacza początkowe stężenie glukozy (Cglukozy,0).
Reaktor |
Csubstratu,0 [mM] |
Csubstratu,rzecz,0 [mM] |
Cglukozy,0 [mM] |
5 |
125 |
103,7 |
0,4652 |
Rzeczywiste stężenie substratu liczone było z zależności:
![]()
Dla reaktora nr 5: ![]()
[mM]
Należało policzyć rzeczywiste stężenie produktu w próbkach:
![]()
Np. dla próbki numer 2: ![]()
[mM]
Policzono również stopień przereagowania α: 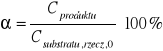
Np. dla próbki numer 2: ![]()
[%]
czas rzecz.reakcji [min] |
Cglukozy,0 [mM] |
Csubstratu,rzecz,0 [mM] |
Cproduktu [mM] |
α [%] |
0,27 |
0,4652 |
103,7 |
-0,009* |
-0,001 |
1,03 |
|
|
0,782 |
0,047 |
2,02 |
|
|
1,649 |
0,099 |
3,02 |
|
|
1,710 |
0,103 |
4,00 |
|
|
2,623 |
0,158 |
5,00 |
|
|
2,790 |
0,168 |
* punkt nie był brany pod uwagę z racji, że stężenie produktu nie może być ujemne
Z nowego wykresu wyznaczono wartość szybkości reakcji r:
y = 0,5028x + 0,396 r = 0,5028
REAKTOR 6 |
(próbka z reaktora V=10ul) |
Cstandardu = 15 mM |
||||
Csubstratu = 41,7 mM |
|
|||||
Próbka |
Czas reakcji [min] |
Czas rzecz.reakcji [min] |
Abs500nm |
Cglukozy [mM] |
STANDARD |
Abs500nm |
1 |
0,25 |
0,30 |
0,025 |
0,25 |
1 |
1,540 |
2 |
1 |
1,02 |
0,073 |
0,73 |
2 |
1,439 |
3 |
2 |
2,03 |
0,127 |
1,26 |
3 |
1,540 |
4 |
3 |
3,02 |
0,211 |
2,10 |
średnia |
1,506 |
5 |
4 |
4,03 |
0,276 |
2,75 |
|
|
6 |
5 |
5,12 |
0,374 |
3,72 |
||
Stężenie produktu policzono z proporcji:
15mM standard glukozy - średnia absorbancja (1,506)
stężenie glukozy X - absorbancja poszczególnych próbek
np. dla próbki nr 1: ![]()
[mM]
Aby ukazać liniową zależność stężenia produktu od czasu, nie było konieczne usuwanie jakichkolwiek punktów. Równanie prostej ma postać: y = 0,7133x - 0,0424. Wyraz wolny (b) oznacza początkowe stężenie glukozy (Cglukozy,0).
Reaktor |
Csubstratu,0 [mM] |
Csubstratu,rzecz,0 [mM] |
Cglukozy,0 [mM] |
6 |
41,7 |
34,75 |
0* |
* Z wykresu odczytano wartość -0,0424, jednak z racji, że stężenie to nie może być ujemne, wstawiono wartość 0.
Rzeczywiste stężenie substratu liczone było z zależności:
![]()
Dla reaktora nr 6: ![]()
[mM]
Należało policzyć rzeczywiste stężenie produktu w próbkach:
![]()
Np. dla próbki numer 1: ![]()
[mM]
Policzono również stopień przereagowania α: 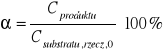
Np. dla próbki numer 1: ![]()
[%]
czas rzecz.reakcji [min] |
Cglukozy,0 [mM] |
Csubstratu,rzecz,0 [mM] |
Cproduktu [mM] |
α [%] |
0,30 |
0 |
34,75 |
0,249 |
0,015 |
1,02 |
|
|
0,727 |
0,044 |
2,03 |
|
|
1,265 |
0,076 |
3,02 |
|
|
2,101 |
0,126 |
4,03 |
|
|
2,748 |
0,165 |
5,12 |
|
|
3,724 |
0,224 |
Z nowego wykresu wyznaczono wartość szybkości reakcji r:
y = 0,7133x - 0,0424 r = 0,7133
REAKTOR 7 |
(próbka z reaktora V=10ul) |
Cstandardu = 15 mM |
||||
Csubstratu = 13,9 mM |
|
|||||
Próbka |
Czas reakcji [min] |
Czas rzecz.reakcji [min] |
Abs500nm |
Cglukozy [mM] |
STANDARD |
Abs500nm |
1 |
0,25 |
0,26 |
0,020 |
0,31 |
1 |
0,950 |
2 |
1 |
1,12 |
0,045 |
0,70 |
2 |
0,952 |
3 |
2 |
2,13 |
0,056 |
0,87 |
3 |
1,003 |
4 |
3 |
3,25 |
0,058 |
0,90 |
średnia |
0,968 |
5 |
4 |
4,08 |
0,061 |
0,94 |
|
|
6 |
5 |
5,12 |
0,085 |
1,32 |
||
Stężenie produktu policzono z proporcji:
15mM standard glukozy - średnia absorbancja (0,968)
stężenie glukozy X - absorbancja poszczególnych próbek
np. dla próbki nr 1: ![]()
[mM]
Aby lepiej ukazać liniową zależność stężenia produktu od czasu, usunięto punkty nr 3 i 4. Równanie prostej ma postać: y = 0,1538x + 0,5309. Wyraz wolny (b) oznacza początkowe stężenie glukozy (Cglukozy,0).
Reaktor |
Csubstratu,0 [mM] |
Csubstratu,rzecz,0 [mM] |
Cglukozy,0 [mM] |
7 |
13,9 |
11,05 |
0,5309 |
Rzeczywiste stężenie substratu liczone było z zależności:
![]()
Dla reaktora nr 7: ![]()
[mM]
Należało policzyć rzeczywiste stężenie produktu w próbkach:
![]()
Np. dla próbki numer 2: ![]()
[mM]
Policzono również stopień przereagowania α: 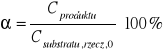
Np. dla próbki numer 2: ![]()
[%]
czas rzecz.reakcji [min] |
Cglukozy,0 [mM] |
Csubstratu,rzecz,0 [mM] |
Cproduktu [mM] |
α [%] |
0,26 |
0,5309 |
11,05 |
-0,221* |
-0,013 |
1,12 |
|
|
0,166 |
0,010 |
2,13 |
|
|
0,337 |
0,020 |
3,25 |
|
|
0,368 |
0,022 |
4,08 |
|
|
0,414 |
0,025 |
5,12 |
|
|
0,786 |
0,047 |
* punkt nie był brany pod uwagę z racji, że stężenie produktu nie może być ujemne
Z nowego wykresu wyznaczono wartość szybkości reakcji r:
y = 0,1538x - 6E-06 r = 0,1538
REAKTOR 8 |
(próbka z reaktora V=50ul) |
Cstandardu = 15 mM |
||||
Csubstratu = 4,6 mM |
|
|||||
Próbka |
Czas reakcji [min] |
Czas rzecz.reakcji [min] |
Abs500nm |
Cglukozy [mM] |
STANDARD |
Abs500nm |
1 |
0,25 |
0,37 |
0,010 |
0,031 |
1 |
0,945 |
2 |
1 |
1,09 |
0,013 |
0,041 |
2 |
0,986 |
3 |
2 |
2,08 |
0,040 |
0,125 |
3 |
0,945 |
4 |
3 |
3,07 |
0,067 |
0,210 |
średnia |
0,959 |
5 |
4 |
4,07 |
0,105 |
0,329 |
|
|
6 |
5 |
5,08 |
0,128 |
0,401 |
||
Stężenie produktu policzono z proporcji, dodatkowo uwzględniając inną objętość pobieranych z reaktora próbek, tj.50 ul zamiast 10ul:
15mM standard glukozy - średnia absorbancja (0,959)
stężenie glukozy X - absorbancja poszczególnych próbek
np. dla próbki nr 1: ![]()
[mM]
Równanie prostej ma postać: y = 0,0839x - 0,0311. Wyraz wolny (b) oznacza początkowe stężenie glukozy (Cglukozy,0).
Reaktor |
Csubstratu,0 [mM] |
Csubstratu,rzecz,0 [mM] |
Cglukozy,0 [mM] |
8 |
4,6 |
3,83 |
0* |
* Z wykresu odczytano wartość -0,0311, jednak z racji, że stężenie to nie może być ujemne, wstawiono wartość 0.
Rzeczywiste stężenie substratu liczone było z zależności:
![]()
Dla reaktora nr 8: ![]()
[mM]
Należało policzyć rzeczywiste stężenie produktu w próbkach:
![]()
Np. dla próbki numer 1: ![]()
[mM]
Policzono również stopień przereagowania α: 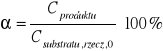
Np. dla próbki numer 1: ![]()
[%]
czas rzecz.reakcji [min] |
Cglukozy,0 [mM] |
Csubstratu,rzecz,0 [mM] |
Cproduktu [mM] |
α [%] |
0,37 |
0 |
3,83 |
0,031 |
0,002 |
1,09 |
|
|
0,041 |
0,002 |
2,08 |
|
|
0,125 |
0,008 |
3,07 |
|
|
0,210 |
0,013 |
4,07 |
|
|
0,329 |
0,020 |
5,08 |
|
|
0,401 |
0,024 |
Z nowego wykresu wyznaczono wartość szybkości reakcji r:
y = 0,0839x - 0,0311 r = 0,0839
REAKTOR 9 |
(próbka z reaktora V=50ul) |
Cstandardu = 15 mM |
||||
Csubstratu = 1,5 mM |
|
|||||
Próbka |
Czas reakcji [min] |
Czas rzecz.reakcji [min] |
Abs500nm |
Cglukozy [mM] |
STANDARD |
Abs500nm |
1 |
0,25 |
0,37 |
0,009 |
0,028 |
1 |
0,971 |
2 |
1 |
1,09 |
0,015 |
0,046 |
2 |
0,968 |
3 |
2 |
2,06 |
0,018 |
0,055 |
3 |
0,980 |
4 |
3 |
3,04 |
0,027 |
0,083 |
średnia |
0,973 |
5 |
4 |
4,05 |
0,037 |
0,114 |
|
|
6 |
5 |
5,06 |
0,043 |
0,133 |
||
Stężenie produktu policzono z proporcji, dodatkowo uwzględniając inną objętość pobieranych z reaktora próbek, tj.50 ul zamiast 10ul:
15mM standard glukozy - średnia absorbancja (0,973)
stężenie glukozy X - absorbancja poszczególnych próbek
np. dla próbki nr 1: ![]()
[mM]
Równanie prostej ma postać: y = 0,0227x + 0,0173. Wyraz wolny (b) oznacza początkowe stężenie glukozy (Cglukozy,0).
Reaktor |
Csubstratu,0 [mM] |
Csubstratu,rzecz,0 [mM] |
Cglukozy,0 [mM] |
9 |
1,5 |
1,23 |
0,0173 |
Rzeczywiste stężenie substratu liczone było z zależności:
![]()
Dla reaktora nr 9: ![]()
[mM]
Należało policzyć rzeczywiste stężenie produktu w próbkach:
![]()
Np. dla próbki numer 1: ![]()
[mM]
Policzono również stopień przereagowania α: 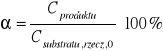
Np. dla próbki numer 1: ![]()
[%]
czas rzecz.reakcji [min] |
Cglukozy,0 [mM] |
Cs,rzecz,0 [mM] |
Cproduktu [mM] |
α [%] |
0,37 |
0,0173 |
1,23 |
0,010 |
0,001 |
1,09 |
|
|
0,029 |
0,002 |
2,06 |
|
|
0,038 |
0,002 |
3,04 |
|
|
0,066 |
0,004 |
4,05 |
|
|
0,097 |
0,006 |
5,06 |
|
|
0,115 |
0,007 |
Z nowego wykresu wyznaczono wartość szybkości reakcji r:
y = 0,0227x + 2E-06 r = 0,0227
ZESTAWIENIE WYNIKÓW Z REAKTORÓW
Reaktor |
Cs,rzecz,0 [mM] |
r [mM/min] |
1/Cs,rzecz,0 [1/mM] |
1/r [min/mM] |
1 |
1663,36 |
0,309 |
0,000601 |
3,236 |
2 |
830,34 |
0,6467 |
0,001204 |
1,546 |
3 |
414,66 |
0,5829 |
0,002412 |
1,716 |
4 |
207,33 |
0,6662 |
0,004823 |
1,501 |
5 |
103,70 |
0,5028 |
0,009643 |
1,989 |
6 |
34,75 |
0,7133 |
0,028777 |
1,402 |
7 |
11,05 |
0,1538 |
0,090498 |
6,502 |
8 |
3,83 |
0,0839 |
0,261097 |
11,919 |
9 |
1,23 |
0,0227 |
0,813008 |
44,053 |
W celu wykreślenia wykresu Lineweavera-Burka, policzono odwrotności szybkości reakcji oraz stężenia rzeczywistego substratu, a wyniki zestawiono w tabeli powyżej.
y = 51,547x + 1,265
Vmax = 1/ 1,265 = 0,79
Km = 51,547 / 1,265 = 40,75
Stężenie glukozy policzone zostało wg. wzoru:
Dla próbki nr 1: 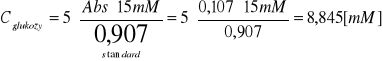
REAKTOR OKRESOWY |
C substratu=125 mM |
C standardu = 15 mM |
|||
Czas reakcji [min] |
Czas rzeczywisty reakcji [min] |
Abs500nm |
Cglukozy [mM] |
STANDARD |
Abs500nm |
0,25 |
0,35* |
0,107 |
8,845 |
1 |
0,959 |
1 |
1,10 |
0,061 |
5,042 |
2 |
0,898 |
2 |
2,10 |
0,072 |
5,952 |
3 |
0,963 |
3 |
3,10 |
0,115 |
9,506 |
4 |
0,853 |
4 |
4,10 |
0,177 |
14,631 |
5 |
0,938 |
5 |
5,10* |
0,375 |
30,997 |
6 |
0,833 |
6 |
6,05 |
0,261 |
21,574 |
średnia |
0,907 |
8 |
8,05 |
0,338 |
27,939 |
|
|
10 |
10,05 |
0,417 |
34,469 |
||
15 |
15,05 |
0,571 |
47,199 |
||
20 |
20,05 |
0,679 |
56,126 |
||
25 |
25,05 |
0,816 |
67,450 |
||
30 |
30,10* |
0,846 |
69,930 |
||
35 |
35,05 |
1,016 |
83,982 |
||
40 |
40,15 |
1,119 |
92,496 |
||
45 |
45,20 |
1,103 |
91,174 |
||
50 |
50,05 |
1,190 |
98,365 |
||
55 |
55,05* |
1,155 |
95,472 |
||
60 |
60,05 |
1,298 |
107,292 |
||
70 |
70,10 |
1,316 |
108,780 |
||
80 |
80,05* |
1,181 |
97,621 |
||
85 |
85,55* |
1,224 |
101,176 |
||
90 |
90,05 |
1,380 |
114,071 |
||
* USUNIĘTE PUNKTY
Sporządzono wykres początkowych warunków reakcji:
t rzecz.reakcji [min] |
Cglukozy [mM] |
Cproduktu [mM] |
Cs,rz,o [mM] |
Cs [mM] |
tmodelowy [min] |
1,10 |
5,042 |
2,392 |
101,516 |
99,124 |
0,600 |
2,10 |
5,952 |
3,301 |
|
98,215 |
0,829 |
3,10 |
9,506 |
6,855 |
|
94,661 |
1,725 |
4,10 |
14,631 |
11,980 |
|
89,536 |
3,024 |
6,05 |
21,574 |
18,924 |
|
82,592 |
4,803 |
8,05 |
27,939 |
25,288 |
|
76,228 |
6,453 |
10,05 |
34,469 |
31,819 |
|
69,698 |
8,173 |
15,05 |
47,199 |
44,548 |
|
56,968 |
11,623 |
20,05 |
56,126 |
53,475 |
|
48,041 |
14,154 |
25,05 |
67,450 |
64,800 |
|
36,716 |
17,574 |
30,10 |
83,982 |
81,332 |
|
20,184 |
23,410 |
35,05 |
92,496 |
89,846 |
|
11,670 |
27,421 |
40,15 |
91,174 |
88,523 |
|
12,993 |
26,704 |
50,05 |
98,365 |
95,715 |
|
5,801 |
31,546 |
60,05 |
107,292 |
104,642 |
|
-3,126 * |
- ** |
70,10 |
108,780 |
106,130 |
|
-4,614 * |
- ** |
90,05 |
114,071 |
111,420 |
|
-9,904 * |
- ** |
* Ujemne wartości wynikają z faktu, że dla tych pomiarów stężenie produktu (Cproduktu) jest większe od początkowe stężenia rzeczywistego substratu (Cs,rz,0).
** Z racji ujemnych wartości stężenia substratu, funkcja nie mogła zostać policzona.
Początkowe rzeczywiste stężenie substratu:
![]()
Stężenie substratu policzone zostało wg. wzoru: ![]()
Dla próbki nr 1: ![]()
[mM]
Wartość Cg,0 odpowiada wyrazowi wolnemu z wykresu funkcji dla r-ra okresowego: 2,6506
Stężenie produktu policzone zostało wg. wzoru: Cproduktu = Cglukozy - Cg,0
Dla próbki nr 1: Cproduktu = 5,042 - 2,6506 = 2,392 [mM]
Do programu Origin Pro 8 wprowadzono wyprowadzone wcześniej wartości Km, Vmax i założone Kis i za pomocą regresji nieliniowej oszacowano nowe wartości. Skorzystano ze wzoru:
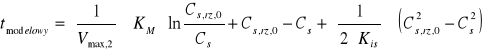
Vmax |
Km |
Kis |
Statistics |
||||
Value |
Error |
Value |
Error |
Value |
Error |
Reduced Chi-Sqr |
Adj. R-Square |
0,81807 |
0,19718 |
21,72886 |
16,18625 |
1515,975 |
1283,12 |
0,01768 |
0,7579 |
Vmax,2 = Vmax * 6,25 = 0,81807 * 6,25 = 5,113
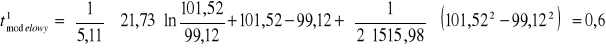
[min]
Wnioski
Dane otrzymane z reaktorów od 1 do 9 poprzez odpowiednie obliczenia pozwoliły na nakreślenie wykresu szybkości reakcji od stężenia substratu. Jednak wykres odbiega od zwykłego modelu Michaelisa-Menten, co sugeruje inhibicję - szybkość reakcji spada dla dużych stężeń substratu (w zwykłym modelu przy wysokich stężeniach, miejsca aktywne enzymu są w pełni wysycane i szybkość nie zależy od stężenia). W naszym przypadku założyliśmy istnienie inhibicji substratowej.
Regresja liniowa wykonana za pomocą programu Microsoft Excel nie dostarcza wyczerpujących informacji na temat parametrów kinetycznych, w związku z czym posłużono się programem Origin Pro 8 , który wykorzystuje regresję nieliniową (Nonlinear Curve Fit). Otrzymano wartości parametrów reakcji: KM, Vmax oraz Kis (stała inhibicji substratowej), które następnie zweryfikowano w reaktorze okresowym, licząc czas modelowy reakcji. Porównanie czasu rzeczywistego i modelowego zobrazowano na wykresie powyżej - widać, że przy wysokich stężeniach substratu czasy pokrywają się, a następnie, w miarę zmniejszania się stężenia, krzywe zaczynają się „rozchodzić”. Oznacza to poprawnie wykonane założenia odnośnie inhibicji substratowej.
Otrzymane wyniki obarczone są jednak znacznym błędem. Wynika to między innymi z niedokładnego pipetowania, odmierzania czasu, sporządzania roztworów jak również faktu, że ćwiczenie wykonywane było przez kilka grup studentów, na które nie mieliśmy wpływu. Niedokładności pomiarowe zaistniałe już w pierwszych etapach wykonywania ćwiczenia rzutują na błędy kolejnych obliczeń i dalej na wynik końcowy. Pomimo tego, po usunięciu punktów znacznie odbiegających od pozostałych, udało się uzyskać sensowne wartości parametrów kinetycznych reakcji.
Sprawozdanie 1. Strona 1 z 23 |
Politechnika Wrocławska Wydział Chemiczny |
Dr hab. Jolanta Bryjak, prof. PWr Pon, godz. 13:15, bud.C6/123A |
Laboratorium Inżynieria Bioreaktorów |
Wyznaczanie stałych równania kinetycznego reakcji hydrolizy sacharozy |
Wojciech Ślęczek 168560 Maciej Duda 168516 |
Wyszukiwarka
Podobne podstrony:
Bryjak, inżynieria bioreaktorów L, reakcja hydrolizy sacharozy katalizowana przez inwertazę
BADANIE KINETYKI REAKCJI HYDROLIZY SACHAROZY KATALIZOWANEJ PRZEZ INWERTAZĘ Z DROŻDŻY
instrukcja kinetyka enzymatyczna - inwertaza, [1] Hydroliza sacharozy
Ćw.4. Otrzymywanie preparatu inwertazy z drożdży i zastosowanie go do hydrolizy sacharozy, biotransf
Biotech enzym Kinetyka reakcji hydrolizy sacharozy katalizowanej przez inwerazę Sprawozdanie gr
HYDROLIZA SACHAROZY – WYZNACZANIE STAŁEJ MICHAELISA
Wyznaczanie stałych równania kinetycznego reakcji hydrolizy sacharozy
Wyznaczanie stałych równania kinetycznego reakcji hydrolizy sacharozy
Inwertaza sprawko
sprawko 2, Hydraulika i Hydrologia, inne
inwersja sacharozy, Farmacja, II rok farmacji, I semstr, fizyczna, Fizyczna, Sprawozdania z fizyczne
wyznaczanie st©ľenia roztworu cukru za pomocą sacharymetru, MIBM WIP PW, fizyka 2, sprawka fiza 2, f
Hydrologia sprawko wisloka
sprawko sacharoza
Hydrologia cwiczenia 9 i 10
11 Stereochemia i podstawowa nomenklatura sacharydów i polisacharydów
Hydrologia Wyklad nr 11
więcej podobnych podstron