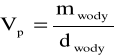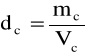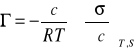Małgorzata Mendel
Chemia II
POMIAR NAPIĘCIA POWIERZCHNIOWEGO ROZTWORÓW - IZOTERMA GIBBSA
DANE DOŚWIADCZALNE:
OBJĘTOŚĆ CH3OH [CM3] |
OBJĘTOŚĆ WODY [CM3] |
|
ILOŚĆ KROPLI |
|||
|
|
PRÓBA I |
PRÓBA II |
PRÓBA III |
ŚREDNIA |
|
13 |
0 |
35 |
35 |
35 |
35 |
|
10 |
3 |
30 |
30 |
30 |
30 |
|
8 |
5 |
28 |
27 |
27 |
27,333333 |
|
7 |
6 |
26 |
26 |
26 |
26 |
|
6 |
7 |
24 |
24 |
24 |
24,00 |
|
5 |
8 |
22 |
22 |
22 |
22 |
|
4 |
9 |
20 |
21 |
21 |
20,666667 |
|
3 |
10 |
19 |
19 |
19 |
19 |
|
2 |
11 |
18 |
17 |
17 |
17,333333 |
|
0 |
13 |
|
13 |
13 |
13 |
13 |
1.Wyznaczam objętości piknometru ze wzoru:
|
Vp = 9,88212g / 0,998 g/cm3=9,901924 [cm3]
masa piknometru z wodą : 18,81230g
masa piknometru: 8,93018g
masa wody: 18,81230-8,93018g = 9,88212g
|
2.Obliczanie gęstości badanych próbek ze wzoru:
Wyliczam gęstości poszczególnych roztworów
Masa piknometru z roztworem= mpc |
Masa badanych próbek=mc |
Gęstość badanych próbek=dc |
Objętość piknometru=mp |
[g] |
[g] |
[g/dm3] |
[cm3] |
16,7452 |
7,81502 |
789,242588 |
9,901924 |
17,48081 |
8,55063 |
863,532191 |
|
17,87259 |
8,94241 |
903,09824 |
|
18,03689 |
9,10671 |
919,690975 |
|
18,18556 |
9,25538 |
934,705229 |
|
18,3055 |
9,37532 |
946,818027 |
|
18,41221 |
9,48203 |
957,594721 |
|
18,51121 |
9,58103 |
967,592778 |
|
18,60482 |
9,67464 |
977,046496 |
|
18,8123 |
9,88212 |
998 |
|
3.Wyliczanie napięcia powierzchniowego ze wzoru:
Napięcie powierzchniowe:
σc=σw(nw*dc)/(nc*dw)
|
gdzie:
σc = napięcie powierzchniowe roztworu
σw = napięcie powierzchniowe wody =0,0728 N/m
nw = liczba kropel cieczy wzorcowej
dc = gęstość badanego roztworu
nc = liczba kropel badanego roztworu
dw = gęstośc cieczy wzorcowej (woda)
Napięcia powierzchniowe poszczególnych roztworów.
Numer roztworu |
Napięcie powierzchniowe [N/m] |
1 |
0,02912 |
2 |
0,03718 |
3 |
0,04267 |
4 |
0,04568 |
5 |
0,05030 |
6 |
0,05558 |
7 |
0,05984 |
8 |
0,06577 |
9 |
0,07280 |
10 |
0,074361251 |
4.Obliczanie stężenia procentowego dla poszczególnych rozcieńczeń ze wzoru:
5. Przeliczam stężenia procentowego na stężenie molowe:
|
Cm. - stężenie molowe [mol/dm3]
Cp - stężenie procentowe [%]
dc - gęstość roztworu [g/m3]
MMETANOLU - masa molowa metanolu [g/mol]
Stężenia procentowe i molowe poszczególnych roztworów.
Numer Zlewki |
Stężenie Procentowe |
Stężenie Molowe |
Log(Cm) |
|
[%] |
[mol/dm3 ] |
|
1 |
100 |
24,66 |
1,392 |
2 |
72,9189099 |
19,68 |
1,294 |
3 |
56,37863259 |
15,91 |
1,202 |
4 |
48,51768885 |
13,94 |
1,144 |
5 |
40,91183692 |
11,95 |
1,077 |
6 |
33,54885826 |
9,93 |
0,997 |
7 |
26,41730239 |
7,91 |
0,898 |
8 |
19,50642749 |
5,90 |
0,771 |
9 |
12,80614641 |
3,91 |
0,592 |
10 |
0 |
0,00 |
|
Zależność napięcia powierzchniowego od logarytmu stężenia molowego.
Zależność napięcia powierzchniowego od stężenia molowego.
6.Nadmiar powierzchniowy wyliczam ze wzoru:
|
gdzie:
Г- nadmiar powierzchniowy, czyli ilość substancji zaadsorbowanej z roztworu, przypadającej na jednostkę powierzchni
c - stężenie molowe roztworu
R - stała gazowa, równa 8,314 J* mol-1*K-1
T - temperatura (tu 294K)
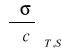
- pochodna wyrażająca zmianę napięcia powierzchniowego wywołaną zmianą stężenia roztworu, w warunkach izotermicznych i przy zachowaniu stałej powierzchni S granicy faz; pochodna ta jest miarą aktywności powierzchniowej substancji w roztworze.
7.Obliczam parachore:
|
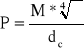
gdzie:
M - masa molowa [g/mol]
σ - napięcie powierzchniowe [N/m]
dc - gęstość badanego roztworu [g/dm3]
wartość parachory P [N*cm3 *m-1*mol-1]
Obliczenia prowadzone dla roztworu 100% metanolu
P= 16,749415
Wartość tablicowa: P=16,5281
5
dwody - gęstość wody = 0,998 g/cm3
mwody - masa wody [g]
dc - gęstość cieczy [g/cm3]
mc - masa cieczy [g] = mpc - mp (dane w tabeli)
Vc - objętość cieczy [cm3]
Wyszukiwarka
Podobne podstrony:
wyklad z czwartku chemia fizycz dnia19 marca
Chemia fizyczna sprawozdanie (6 1) id 112219
Chemia fizyczna wykład 11
chemia fizyczna38
chemia fizyczna07
chromatografia jonowymienna 2, Rok I, chemia fizyczna, chemia fizyczna-protokoły
10.6 poprawione, semestr 4, chemia fizyczna, sprawka laborki, 10.6
Pojęcia na egzamin z metali, Chemia Fizyczna, chemia fizyczna- laborki rozne, Rozne
Tabelka pomiarowa do 21, BIOTECHNOLOGIA POLITECHNIKA ŁÓDZKA, CHEMIA FIZYCZNA
CHEMIA FIZYCZNA- spektrografia sc, Ochrona Środowiska pliki uczelniane, Chemia
Kolokwium nr 2 (2), Technologia chemiczna, Chemia fizyczna, 3 semestr, fizyczna paczi
Chemia fizyczna 18, chemia fizyczna, chemia, FIZYCZNA - raporty
mmgg, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczna cz II sprawka
Pytania z wejściówek, analityka medyczna UMP 2014, chemia fizyczna, ćwiczenia
raport5.2, UMK, Chemia fizyczna
Chemia fizyczna - sprawozdanie 2-1, Chemia Fizyczna
więcej podobnych podstron