Mateusz Komada III rok chemia informatyczna
ĆWICZENIE 40b
WYZNACZANIE RZĘDU REAKCJI METODĄ CAŁKOWĄ
CEL
Celem ćwiczenia jest wyznaczenie przy pomocy metody całkowej rzędu reakcji utleniania jonów Fe2+ jonami ClO3- w środowisku kawśnym.
Światło widzialne białe składa się z fal elektromagnetycznych o długościach ok. 380 nm - ok. 780 nm. Barwa ciała świadczy o tym, że przepuszcza ono lub absorbuje promieniowanie z zakresu widzialnego w sposób zróżnicowany, selektywny.
Obserwowane zabarwienie ciała jest dopełnieniem barwy promieniowania i odwrotnie.
Optyczną charakterystykę substancji stanowi jej krzywa absorbcji, czyli wykres pokazujący zależność absorbcji od długości fali.
Warunkiem absorbcji promieniowania przez daną substancję jest odpowiedniość energii padającego promieniowania i zmian energii możliwych do wywołania w cząsteczce danej substancji.
Prawa Bouguer'a - Lamberta i Beer'a stanowią podstawę spektrofotometrii absorbcyjnej.
Bouguer i Lambert wykazali, że między natężeniem światła przepuszczonego I1 a grubością warstwy roztworu l istnieje następująca zależność:
I1 = I0 · e -kl
gdzie:
I0 - oznacza natężenie światła padającego
k - współczynnik absorbcji
Po zamianie logarytmów naturalnych na dziesiętne mamy:
I1 = I0 · 10 -Kl ![]()
Wielkość K nazywa się współczynnikiem ekstynkcji.
Beer stwierdził w 1852 roku że współczynnik ekstynkcji roztworu jest proporcjonalny do stężenia substancji absorbującej światło:
K = K1 · C
Po połączeniu obu praw otrzymujemy zależność wyrażającą prawo Bouguer'a - Lambert'a i Beer'a :
I1 = I0 · 10-KCl
lub
![]()
= K· C · l = A
![]()
gdzie:
![]()
A - absorbancja.
Odstępstwa od prawa Lambert'a - Beer'a mogą być spowodowane albo zmianami chemicznymi zachodzącymi w miarę zmian stężenia albo warunkami pomiaru wykonanego za pomocą nie dość dokładnego przyrządu.
OPRACOWANIE WYNIKÓW
nr kolbki |
c Fe+3 [mol/dm3] * 10-5 |
0,001 M. Fe+3 v[cm3] |
A |
|
1 |
2 |
0,5 |
0,197 |
|
2 |
4 |
1 |
0,333 |
|
3 |
6 |
1,5 |
0,553 |
|
4 |
8 |
2 |
0,705 |
|
5 |
10 |
2,5 |
0,07 |
|
6 |
12 |
3 |
1,088 |
|
a = 9041,43 b = -0,0024 |
||||
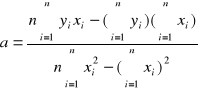
b = 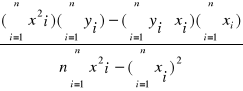
Niech cFe+3 będzie x a A będzie y, a n = 6.
![]()
0,00042 ![]()
3,783 ![]()
0,0003281 ![]()
0,0000000364
|
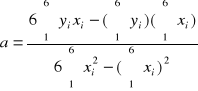
= 9041,43 b = 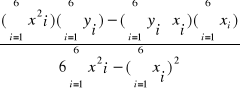
=-0,0024
Otrzymujemy zależność:
y = 9041,43x -0,0024
1)
t [s] |
A |
cFe+3 [mol/dm3] |
cFe+2 [mol/dm3] |
1/c |
60 120 180 240 300 360 420 480 540 600 660 720 780 840 900 960 1020 1080 1140 1200 1260 1320 1380 1440 1500 1560 1620 1680 1740 |
0,053 0,077 0,106 0,136 0,166 0,198 0,227 0,259 0,282 0,326 0,358 0,393 0,423 0,463 0,498 0,534 0,570 0,606 0,644 0,680 0,717 0,754 0,791 0,829 0,867 0,905 0,943 0,981 1,020 |
|
2,5*10-3 |
|
Aby znaleźć kolejne stężenia cFe+3 podstawiamy badane wartości do wzoru i wyliczamy. Następnie wykreślić musimy zależność 1/c od czasu. W tym celu liczymy wartość c z wzoru:
c = c0 - cFe+3
gdzie:
c0 - wartość początkowa stężenia jonów Fe+3
c - stężenie substratu po czasie t [s]
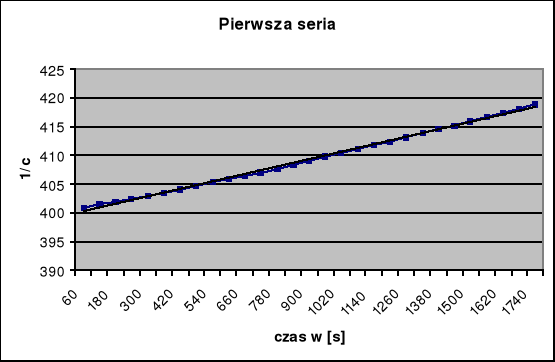
otrzymany wykres jest linią prostą spełniającą zależność:
![]()
Wartość k znajdujemy metodą najmniejszych kwadratów.
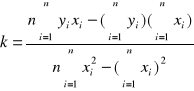
gdzie:
![]()
- y
t - x
![]()
26100 ![]()
11871,63 ![]()
10763414 ![]()
30798000
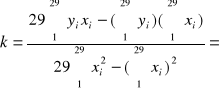
0,010803
Wartość współczynnika k wynosi 0,010803.
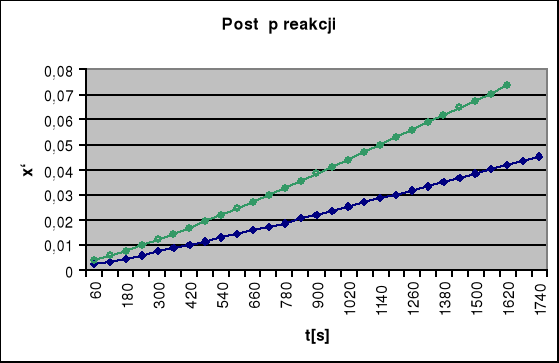
Aby wyznaczyć rząd reakcji kreślimy zależność postępu reakcji x` od czasu t[s]. Liczba postępu reakcji x` jest to stosunek stężenia przereagowanych jonów Fe +2 (x - w naszym przypadku jest ono równe stężeniu powstałych w wyniku reakcji jonów Fe+3) do stężenia początkowego substratu (c0):
![]()
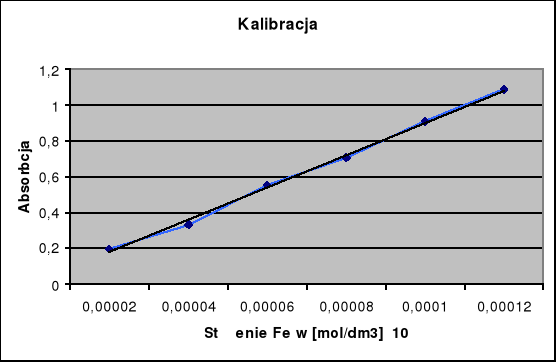
Stężenie przereagowanych jonów Fe+2 jest równe stężenie powstałych jonów Fe+3, które możemy oznaczyć na podstawie krzywej kalibracyjnej.
Z wykresu x`= f(t) dla obu stężeń początkowych (wykresy umieszczone są na jednym układzie współrzędnych) odczytujemy wartość t1 i t2 dla dowolnej wartości liczby postępu reakcji i wstawiamy je do równania określającego rząd reakcji:
![]()
gdzie: c01,c02 - stężenie początkowe substratu dla 1 i 2 serii pomiarowej,
t1, t2 - czas dla danej liczby postępu reakcji dla serii pomiarowej 1 i 2.
2)
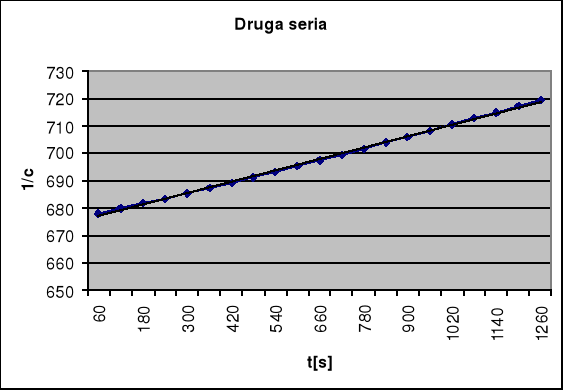
Dla drugiej serii pomiarowej przeprowadzam taką samą procedurę obliczeniową, korzystając z wykreślonej wcześniej krzywej kalibracji. Wyniki umieszczam w tabeli
t [s] |
A |
cFe+3 [mol/dm3] |
cFe+2 [mol/dm3] |
1/c |
60 120 180 240 300 360 420 480 540 600 660 720 780 840 900 960 1020 1080 1140 1200 1260 1320 1380 1440 1500 1560 1620 |
0,053 0,077 0,106 0,136 0,166 0,198 0,227 0,259 0,282 0,326 0,358 0,393 0,423 0,463 0,498 0,534 0,570 0,606 0,644 0,680 0,717 0,754 0,791 0,829 0,867 0,905 0,943 |
|
1,5*10-3 |
|
Obliczam rząd reakcji n:
![]()
Dla dowolnie wybranego punktu wartości x`, np.: 0,02 otrzymujemy wartości czasów
t1 = 827,88; t2 = 496,73
możemy obliczyć rząd reakcji
n = 1 + log(t1:t2)/log(c02:c01)
n =1+ log(1,666)/log(0,6)
n =1+ 0,99991
n =1,99991 ![]()
2
Reakcja jest niewątpliwie rzędu drugiego.
Wyszukiwarka
Podobne podstrony:
fiz 40b, Chemia fizyczna
wyklad z czwartku chemia fizycz dnia19 marca
Chemia fizyczna sprawozdanie (6 1) id 112219
Chemia fizyczna wykład 11
chemia fizyczna38
chemia fizyczna07
chromatografia jonowymienna 2, Rok I, chemia fizyczna, chemia fizyczna-protokoły
10.6 poprawione, semestr 4, chemia fizyczna, sprawka laborki, 10.6
Pojęcia na egzamin z metali, Chemia Fizyczna, chemia fizyczna- laborki rozne, Rozne
Tabelka pomiarowa do 21, BIOTECHNOLOGIA POLITECHNIKA ŁÓDZKA, CHEMIA FIZYCZNA
CHEMIA FIZYCZNA- spektrografia sc, Ochrona Środowiska pliki uczelniane, Chemia
Kolokwium nr 2 (2), Technologia chemiczna, Chemia fizyczna, 3 semestr, fizyczna paczi
Chemia fizyczna 18, chemia fizyczna, chemia, FIZYCZNA - raporty
mmgg, Studia PŁ, Ochrona Środowiska, Chemia, fizyczna, laborki, wszy, chemia fizyczna cz II sprawka
Pytania z wejściówek, analityka medyczna UMP 2014, chemia fizyczna, ćwiczenia
raport5.2, UMK, Chemia fizyczna
więcej podobnych podstron