AMINOKWASY
20 podstawowych aminokwasów, z których zbudowane są białka, to α- aminokwasy (oznacza to, że grupa aminowa każdego z nich jest podstawnikiem na atomie C- α).
19 z 20 aminokwasów podstawowych to aminy pierwszorzędowe (RNH2 ), jedynie PROLINA jest drugorzędowa.
Poza GLICYNĄ u aminokwasów podstawowych α- atomy węgla są centrami stereogenicznymi. Dla każdego z nich są więc możliwe dwie formy enancjomerów. Przyroda do budowy białek używa jednak jedynie form α, często zwanych także
L-aminokwasami. W projekcji Fischera grupę -COOH umieszczamy zawsze na górze, a - NH2 po jej lewej stronie.
COOH
C
H2N R
H
Aminokwasy wykazują czynność optyczną i skręcalność.
SKRĘCALNOŚĆ, skręcalność optyczna, właściwość substancji optycznie czynnej, polegająca na skręcaniu płaszczyzny polaryzacji światła podczas przechodzenia światła spolaryzowanego przez tę substancję; skręcalność właściwa — skręcenie (w stopniach) płaszczyzny polaryzacji światła monochromatycznego podczas przechodzenia przez 10-centymetrową warstwę roztworu związku optycznie czynnego zawierającego 1 g tego związku w 1 cm3; skręcalność molowa — iloczyn skręcalności właściwej i 1/100 masy molowej związku optycznie czynnego; kąt skręcenia (mierzony w odpowiednich warunkach, zwykle w temp. 20°C) płaszczyzny polaryzacji światła monochromatycznego charakteryzuje daną substancję — jest jej indywidualną cechą, w przypadku roztworów związków optycznie czynnych — zależy także od stężenia; pomiaru kąta skręcenia płaszczyzny polaryzacji światła (w aparatach zw. polarymetrami) dokonuje się w analizie chem. (polarymetria), gł. ilościowej, do oznaczania m.in.: sacharozy, glukozy, fruktozy, laktozy, chininy, kwasu winowego; metody polarymetryczne są wykorzystywane zwł. w przemyśle cukry. do pomiaru zawartości sacharozy (produkuje się polarymetry, które podają jej zawartość procentową) w soku buraczanym, syropach, cukrze białym; metody polarymetryczne są też wykorzystywane w badaniach stereochemicznych.
OPTYCZNIE CZYNNE SUBSTANCJE, substancje wykazujące czynność opt. (aktywność optyczna), czyli skręcające płaszczyznę polaryzacji światła spolaryzowanego liniowo o pewien, charakterystyczny dla danej substancji kąt w prawo lub w lewo. Właściwość tę wykazują niektóre związki chem. w stanie gazowym, ciekłym i w roztworach, a także kryształy, tzw. kryształy optycznie czynne; jest ona wynikiem specyficznej budowy cząsteczek związków lub szczególnego rozmieszczenia atomów (cząsteczek, jonów) w komórkach elementarnych kryształów; cząsteczki i kryształy opt. czynne nie mają zwykle żadnych elementów symetrii (mogą mieć jedynie właściwą oś symetrii, chiralność). Substancje optycznie czynne występują w 2 odmianach: prawo- i lewoskrętnej, skręcających płaszczyznę polaryzacji odpowiednio w prawo lub w lewo o taki sam kąt; odmiany te, tzw. izomery opt. (enancjomery w wypadku cząsteczek, odmiany polimorficzne w wypadku kryształów), mają się do siebie jak przedmiot do swego odbicia w płaskim zwierciadle. W nazwach związków optycznie czynnych izomery lewoskrętne oznacza się znakiem (-) umieszczanym przed nazwą, prawoskrętne — znakiem (+), np. kwas (+)mlekowy (dawniej stosowano oznaczenia literowe, odpowiednio l i d). Równocząsteczkowa mieszanina postaci lewo- i prawoskrętnej (racemat) jest optycznie nieczynna i oznaczana znakiem (±), np. kwas (±)mlekowy. Aktywność opt. wykazują m.in. niektóre związki org. — jej przyczyną jest często obecność jednego lub kilku asymetrycznych atomów węgla lub helikalna budowa cząsteczki, np. biopolimerów; większość związków pochodzenia biol. — białka, enzymy, aminokwasy — należy do substancji optycznie czynnych. Reakcja syntezy produktów optycznie czynnych (chiralnych) z substratów nieczynnych optycznie nosi nazwę syntezy asymetrycznej.
Aktywność opt. kryształów wynika bądź z budowy cząsteczek, z których się składają (kryształy kwasu winowego, glukozy), bądź ułożenia atomów w sieci krystal., np. w kryształach tworzących odmiany enancjomeryczne (enancjomorfizm), m.in. kwarc-α, cynober.
ogólny wzór aminokwasu: H2N- R- COOH
ogólny wzór aminokwasu tworzącego białka (występującego w organizmach żywych):
R-CH COOH
NH2
Większość znanych aminokwasów (około 150) nie tworzy białek, na przykład:
ornityna
cytrulina
GABA (kwas gamma amino masłowy)
tyroksyna, etc.
Jeśli jednak chodzi o częstość występowania (ilość), to większość stanowią aminokwasy, tworzące białka.
TAURYNA- aminokwas niebiałkowy; składnik kwasów żółciowych, ulegający redukcji; jako osmolit występuje także w nerkach i mózgu (gdzie działa jako ochrona przed zmianami ciśnienia):
H2N- CH2 -CH2 -SO32-
Istnieją aminokwasy, występujące w białkach, które nie są kodowane przez żaden triplet, np.: hydroksyprolina
Ponieważ aminokwasy zawierają zarówno grupę kwasową, jak i zasadową, ulegają wewnątrzcząsteczkowej reakcji kwas- zasada i występują głównie w formie jonu dipolowego albo obojnaczego, inaczej zwitterjonu. Jony te charakteryzują się wieloma właściwościami fizycznymi typowymi dla soli:
mają duże momenty dipolowe
są rozpuszczalne w wodzie
nierozpuszczalne w węglowodorach
są substancjami krystalicznymi o wysokich temperaturach topnienia
są amfoteryczne (zależnie od warunków reagują jak kwasy albo zasady; przyłącza lub traci proton)
W roztworze kwaśnym, przy małym pH, cząsteczka aminokwasu jest protonowana i występuje głównie jako kation. W roztworze zasadowym przy dużym pH, aminokwas traci proton i występuje głównie jako anion. Punkt pośredni, czyli takie pH, w którym istnieje dokładna równowaga między forma kationową i anionową aminokwasu i gdy jest on obojętnym, dipolowym jonem obojnaczym nazywamy punktem izoelektrycznym aminokwasu.
R-CH-COOH R- CH- COO- R- CH- COO-
NH3+ NH3+ NH2
HA H+ + A-
K= [H+][A-]/ [HA]
Kiedy połowa jest zdysocjowana: K=[ H+]
A zatem z równania Hendersona- Hasselbalcha pK= pH
pK to taka wartość pH, przy której kwas jest zdysocjowany w połowie.
Punkt izoelektryczny= (pK1 + pK2 )/2
AMINOKWASY
POLARNE
A/ SIARKOWE
Metionina (Met) [M]
CH3 SCH2 CH2 CH COOH
NH2
B/ AROMATYCZNE
Fenyloalanina (Phe) [F]
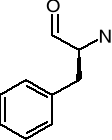
Tryptofan (Trp) [W]
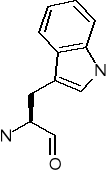
C/ ALIFATYCZNE
Alanina (Ala) [A]
CH3 CH COOH
NH2
Walina (Val) [V]
CH3
CH3 CH CH COOH
NH2
Leucyna (Leu) [L]
CH3
CH3 CH CH2 CH COOH
NH2
Izoleucyna (Ile) [I]
CH3
CH3 CH2 CH CH COOH
NH2
Prolina (Pro) [P]
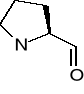
Treonina (Thr) [T]
OH
CH3 CH CH COOH
NH2
Poza klasyfikacją:
Glicyna (Gly) [G]
CH2 COOH
NH2
NIEPOLARNE
A/ KWAŚNE
Kwas asparaginowy (Asp) [D]
O
HOC CH2 CH COOH
NH2
Kwas glutaminowy (Glu) [E]
O
HOC CH2 CH2 CH COOH
NH2
B/ ZASADOWE
Arginina (Arg) [R]
NH
H2NCNHCH2 CH2 CH2 CH COOH
NH2
Histydyna (His) [H]
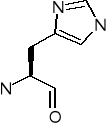
Lizyna (Lys) [K]
H2NCH2 CH2 CH2 CH2 CH COOH
NH2
C/ AMIDOWE
Glutamina (Gln) [Q]
O
H2NC CH2 CH2 CH COOH
NH2
Asparagina (Asn) [N]
O
H2NC CH2 CH COOH
NH2
D/ TIOLOWE
Cysteina (Cys) [C]
HSCH2 CH COOH
NH2
E/ HYDROKSYLOWE
Tyrozyna (Tyr) [Y]
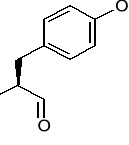
Seryna (Ser) [S]
HOCH2 CH COOH
NH2
CUKROWCE = WĘGLOWODANY
Węglowodany występują w każdym żywym organizmie, pełniąc zarówno funkcje energetyczne jak i strukturalne.
Polihydroksyaldehydy (aldozy) i polihydroksyketony (ketozy)
Właściwości węglowodanów:
krystaliczne
białe
dobrze rozpuszczalne w rozpuszczalnikach polarnych
źle rozpuszczalne w rozpuszczalnikach niepolarnych
słodki smak, który zawdzięczają grupom hydroksylowym
Cukrowce mogą wykazywać czynność optyczną:
IZOMERIA [gr.], zjawisko polegające na występowaniu cząsteczek (o takim samym składzie atom.) różniących się sposobem lub kolejnością powiązania atomów albo rozmieszczeniem atomów w przestrzeni. Cząsteczki takie, zw. izomerami, wykazują zazwyczaj różne, wynikające z odmienności ich budowy, właściwości fiz. i chemiczne.
Izomeria konstytucyjna jest związana z różnym sposobem i kolejnością powiązania atomów w cząsteczkach izomerów; rozróżnia się: izomerię łańcuchową — różnica w układzie wiązań w łańcuchu atomów, np. w związku C4H10:
CH3-CH2-CH2-CH3
butan
metylopropan (izobutan)
izomerię pierścieniową — różnica w układzie wiązań między atomami w pierścieniu, np. w związku C4H8:
cyklobutan
metylocyklopropan
izomerię funkcyjną — obecność w cząsteczkach różnych grup funkcyjnych, np. w związku C3H6O:
CH2=CH-CH2-OH;
alkohol allilowy
aldehyd propionowy
izomerię pozycyjną — różne rozmieszczenie tych samych grup funkcyjnych w podstawowym szkielecie, np. w związku C6H6O2N2. Izomeria przestrzenna stereoizomeria jest związana z różnym przestrzennym rozmieszczeniem atomów (lub grup atomów) i układem wiązań w cząsteczce. Według klas. podziału stereoizomeria obejmuje izomerię geometryczną i izomerię optyczną. Cząsteczki stereoizomerów geom. różnią się położeniem atomów (lub grup atomów) względem wybranej płaszczyzny, przy czym atomy te są lub mogą być uznane za część sztywnego układu, tzn. nie mają możliwości swobodnego obrotu wokół wiązania podwójnego C=C (C=N, N=N) lub — w związkach cyklicznych — wokół wiązania pojedynczego C-C; izomery, w których takie same lub wyróżnione atomy albo grupy atomów) znajdują się po tej samej stronie podwójnego wiązania są nazywane odmianami cis, po przeciwnych stronach — odmianami trans:
trans-1,2-dichloroeten
cis-1,2-dichloroeten
Cząsteczki izomerów opt., tj. izomerów skręcających w różny sposób płaszczyznę polaryzacji światła (optycznie czynne substancje), są chiralne, tzn. nieidentyczne ze swymi odbiciami lustrzanymi. Niektóre izomery geom. mogą jednocześnie być izomerami optycznymi. Według innego podziału stereoizomerii rozróżnia się izomerię konformacyjną oraz izomerię konfiguracyjną. Izomery konformacyjne różnią się przestrzennym rozmieszczeniem atomów (lub grup atomów) wynikającym z obrotu wokół wiązań, zwykle pojedynczych wiązań C-C (konformacja). Izomery konfiguracyjne różnią się ustawieniem atomów (lub grup atomów) w taki sposób, że ich wzajemne przekształcanie wymaga rozrywania wiązań chem. i ponownego ich tworzenia (konfiguracja). Najbardziej ogólna i jednoznaczna jest klasyfikacja stereoizomerów na podstawie cech ich symetrii. Stereoizomery stanowiące wzajemne odbicia lustrzane są nazywane enancjomerami, nie będące zaś wzajemnymi odbiciami noszą nazwę diastereoizomerów; enancjomery zawsze są związkami chiralnymi, z czego wynika ich aktywność opt., diastereoizomery zaś mogą zawierać elementy chiralne lub być związkami achiralnymi. Nazwę i.izomeria wprowadził 1831 szwedz. chemik i mineralog J.J. Berzelius.
ENANCJOMERY [gr.], stereoizomery, których cząsteczki mają się do siebie jak przedmiot do swego odbicia lustrzanego w zwierciadle płaskim; oznaczane symbolami D i L; cząsteczki e. są chiralne; w przeciwieństwie do diastereoizomerów mają takie same właściwości fiz. i chem., różnią się jedynie kierunkiem skręcania płaszczyzny polaryzacji światła spolaryzowanego liniowo (odmiany lewoskrętne oznaczane symbolem (-) i prawoskrętne (+)); zachowują się odmiennie w środowisku chiralnym, np. w organizmach żywych; dawniej zw. antypodami optycznymi.
DIASTEREOIZOMERY, stereoizomery, których cząsteczki nie mają się do siebie jak przedmiot do swego odbicia lustrzanego; cząsteczki diastereoizomerów różnią się konfiguracją; przy niektórych z kilku centrów chiralności; diastereoizomery tworzą związki mające co najmniej 2 centra chiralności, tj. 2 asymetryczne atomy, najczęściej węgla, w cząsteczce, np. kwas chlorojabłkowy tworzy 4 stereoizomery, z których I jest d. form III i IV, natomiast stereoizomery I i II są parą enancjomerów:
Diastereoizomerami są także izomery geom., np.:
D. różnią się właściwościami chem. i fiz. (temp. topn., temp. wrz., rozpuszczalnością, kątem skręcenia płaszczyzny światła spolaryzowanego liniowo itp.).
ANOMERY, związki izomeryczne o różnych ułożeniach grupy -OH i -H przy C1 w aldozach i C2 w ketozach. Określamy je jako a- i b- izomery (patrz mutarotacja glikozy)
MUTAROTACJA Zjawisko zmiany w czasie (muta.. ) wielkości kąta skręcenia (..rotacja ) płaszczyzny światła spolaryzowanego przez roztwór a-glukozy bądź b-glukozy.
Cząsteczka glukozy (cukier gronowy) w formie pierścieniowej może występować w dwóch konfiguracjach (zwanych a i b, formy anomeryczne). W roztworach wodnych następuje przejście części cząsteczek o konfiguracji a w cząsteczki o konfiguracji b. Podobnie po rozpuszczeniu formy b przechodzi ona częściowo w formę a. Tak więc, bez względu na to czy stworzymy roztwór a-glukozy (skręcalność właściwa +111°) czy b-glukozy (skręcalność właściwa +19°) po pewnym czasie w roztworze ustali się równowaga między tymi formami i roztwór będzie wykazywał skręcalność pośrednią między skręcalnością a-glukozy a b-glukozy. Nastąpi więc zmiana skręcalności (mutarotacja ) roztworu.
EPIMERY są to pary diastereoizomerycznych aldoz różniące się konfiguracją wokół atomu C-2. Epimery w reakcji z fenylohydrazyną C6H5-NH-NH2 tworzą identyczne osazony. Konfiguracja na węglach C-3, C-4 i C-5 jest identyczna, stąd po podstawieniu węgli C-1 i C-2 otrzymujemy tę sama substancję.
TAUTOMERY Szczególny przypadek izomerii, gdy jeden izomer łatwo i spontanicznie przechodzi w drugi nosi nazwę tautomerii. Między tymi izomerami ustala się stan równowagi, mieszaninę równowagową izomerów nazywa się mieszaniną allelotropową. Róznica między L i D. Wyróżniamy następujące rodzaje tautomerii:
keto-enolowa dla związków karbonylowych
łańcuchowo-pierścieniowa w przypadku węglowodanów
nitro-izonitrowa (nitro-aci)
nitrozo-izonitrozowa (nitrozo-oksymowa)
amido-imidolowa
imino-enaminowa-
walencyjna
Równowagi tautomeryczne w których następuje migracja protonu noszą nazwę tautomerii prototropowej lub przemiany prototropowej (wszystkie wymienione oprócz ostatniej). Niekiedy jeden tautomer przechodzi tak wolno w drugi (mała szybkość przemiany), że można je rozdzielić. Taki przypadek tautomerii nosi nazwę desmotropii, a poszczególne izomery (tautomery) nazywają się desmotropami.
Tworzenie się pierścienia z wiązaniem półacetalowym:
Jeśli zamknięcie pierścienia następuje na 5 węglu mamy do czynienia z układem piranozowym. Jeśli natomiast zamyka się węglem 4, to nazywamy go furanozowym (najmniejszy możliwy pierścień).
Klasyfikacja cukrowców:
LIPIDY
Związki nierozpuszczalne lub słabo rozpuszczalne w wodzie i dobrze rozpuszczalne w rozpuszczalnikach organicznych
ACYLOLIPIDY mają elongacyjnie dodane reszty acylowe z acetylo- CoA (kiedy występuje rozgałęzienie, nazywamy je grupami prenylowymi).
Podział acylolipidów:
ACYLOLIPIDY
Proste Złożone
- nie poddają się hydrolizie.
Są to na przykład kwasy tłuszczowe.
Woski Estry kwasów Sfingolipidy
tłuszczowych
A/ ceramidy
-estry wielowęglowych kwasów A/ z glicerolem= GLICEROLIPIDY B/ sfingofosfolipidy
tłuszczowych, np.: lanolina (ester np: mono-, di- i triacyloglicerole C/sfingoglikolipidy
lanosterolu), mirystyna (kwasu - odkładają się w tkance tłuszczowej, a) gangliozydy
mirystynowego- występuje w wosku na ich obróbkę potrzeba mniej b) cerebrozydy
pszczelim), olbrot (pozyskiwany z energii ponieważ są hydrofobowe,
kaszalota; kwas palmitynowy) występują w błonach.
B/ FOSFOLIPIDY
C/ GLIKOLIPIDY
Kwasy tłuszczowe pozwalają odróżnić zwierzęta od roślin. Zwierzęta nie potrafią jednak syntetyzować wielonienasyconych kwasów tłuszczowych, takich jak np.: witamina F.
W błonach komórkowych wiele lipidów pełni funkcje strukturalne, ponieważ są to związki błonogenne:
micelle
błony
Lipidy uplastyczniają błony ponieważ wielokrotne nienasycone wiązania cis- wykrzywiają cząsteczki.
Przykłady:
A/
KT
KT
PO4 2- Jest to fosfolipid należący do kwasów fosfatydowych, zawierający wiązanie fosfoestrowe. Taka cząsteczka może przyłączać drobnocząsteczkowe aminokwasy, np.:
fosfatydyloseryna
KT
KT
Reszta kwasu ortofosforowego + seryna
lub 2) cholina
KT
KT
O- P - O- C- C=
O2 N (CH3)3+
B/ Do reszt kwasów tłuszczowych mogą być także doczepione cząsteczki galaktozy, poprzez wiązanie glikozydowe 1-6; taki układ występuje w błonach plastydowych.
KT
KT
Gal- Gal
Ceramid= KT+ sfingozyna (za pomocą wiązania amidowego); zarówno cerebrozydy jak i gangliozydy zawierają dużo cukrów.
OH-
OH-
pH
OH
pK1=3,1
pK2=6,1
pi=4,6
OHH HHHHH
O
Jeśli półacetalowy tlen jest po prawe stronie, gdy grupa CH2 OH jest nad pierścieniem, to mamy do czynienia z formą D.
OH
Jeśli grupa -OH znajduje się z prawej strony pod pierścieniem, to mamy do czynienia z formą α.
Wyszukiwarka
Podobne podstrony:
Makro ćwiczenia sem1
Źródła napięciowe i prądowe, Energetyka I stopień PŚk, sem1 Elektrotechnika, ćwiczenia elektrotechni
cwiczenia na zaliczenie sem1 j Nieznany
3 ćwiczenia BADANIE asfaltów
Ćwiczenie7
Cwiczenia 2
Ćwiczenia V
metody redukcji odpadów miejskich ćwiczenia
Ćwiczenia1 Elektroforeza
cwiczenia 9 kryzys
Ćwiczenia 1, cz 1
Ćwiczenie 8
9 ćwiczenie 2014
Cwiczenie 1
więcej podobnych podstron