enzymy25

Sekcja C - Enzymy)
jkcja C - Enzymy
I świec wartość Km nie zmie-p iies: działanie pepstatyny
Bi. łatwo rozpoznać na wy-fe > tedy wzrost nachylenia Bu.:, miejsce jej punktu prze-ale punkt jej przecięcia L pozostaje stała) (rys. 4c).
- inhibitor niekompetycyjny
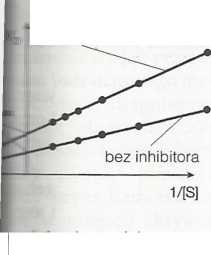
miąae się w miejscu 'inhibitor niekompetycyjny, fc mśnkrotnościami V i [S]
P martość Km oraz Vmax
Regulacja przez sprzężenie zwrotne
Enzymy
allosteryczne
Odwracalne r. ody fikać je i: walencyjne
Szybkości reakcji katalizowanych w układach biologicznych przez enzymy są zmieniane przez aktywatory i inhibitory, nazywane łącznie cząsteczkami efektorowymi (efektorami). W szlakach metabolicznych produkt końcowy często hamuje w drodze sprzężenia zwrotnego decydujący etap, który wcześniej występuje w tym samym szlaku, ma to na celu przeciwdziałanie nagromadzaniu się produktów pośrednich i niepotrzebnemu zużywaniu metabolitów oraz energii.
W rozgałęzionych szlakach metabolicznych często działa proces inhibicji w drodze sekwencyjnego sprzężenia zwrotnego.
Wykres zależności V0 od [S] dla enzymów allosterycznych ma kształt krzywej sigmoidalnej. Enzymy allosteryczne mają często więcej niż jedno miejsce aktywne, które to miejsca kooperatywnie wiążą cząsteczki substratu, dzięki czemu związanie substratu w jednym miejscu aktywnym indukuje w enzymie zmianę konformacyjną, zmieniającą powinowactwo do substratu w innych miejscach aktywnych. Enzymy allosteryczne są często białkami złożonymi z wielu podjednostek, z których każda ma miejsce aktywne. W celu wyjaśnienia działania enzymu allosterycznego zaproponowano dwa modele; model jednoprzejściowy lub symetryczny i model sekwencyjny. Poza tym enzymy allosteryczne mogą być kontrolowane przez cząsteczki efektorowe (aktywatory lub inhibitory), które 'mażą się do miejsc innych niż miejsca aktywne i zmieniają szybkość aktywności enzymatycznej. Karbamoilotransferaza asparaginianowa jest enzymem allosterycznym, katalizującym decydujący etap w biosyntezie pirymidyn. Enzym ten składa się z sześciu podjednostek katalitycznych, z których każda ma miejsce aktywne, oraz z sześciu podjednostek regulatorowych, do których wiążą się efektory allosteryczne: cytydynotrifosforan (CTP) oraz ATP. Karbamoilotransr--raza asparaginianowa jest hamowana w drodze sprzężenia zwrotnego przez końcowy produkt szlaku, CTP, działający jako inhibitor allosteryczny. Natomiast ATP, będący produktem pośrednim pojawiającym się w szlaku wcześniej, działa jako aktywator allosteryczny.
Aktywność wielu enzymów jest zmieniana przez odwracalne tworzenie i rozrywanie wiązania kowalencyjnego między enzymem a małą grupą niebiałkową. Najczęściej występującą modyfikacją es: dodawanie i usuwanie grupy fosforanowej, a więc odpowiednie, fosforylacja i defosforylacja. Fosforylacja jest katalizowana przez kinazy białkowe, często używające ATP jako donora grupy fosforanowej, natomiast defosforylacja jest katalizowana przez fosfatazy białkowe.
Wyszukiwarka
Podobne podstrony:
enzymy24 118 Sekcja C - EnzywJB , Italia C-Enzy*^__ enzymu do substratu pozostaje niezmienione, a wi
enzymy18 - 112 Sekcja C - Enzym) inne tyka enzymów Wartość pH miczną cząsteczek substratu. To powodu
skanowanie0015 Znaczenie wartości Km i Vmax. Dane doświadczalne wskazują, jjg ty przjpadkji wieluenż
LastScan3 (4) WŁAŚCIWOŚCI KINETYCZNE ENZYMÓW MODEL MICHAELISA - MENTENWYZNACZANIE WARTOŚCI KM ORAZ V
13791 zad16 Przykład 3.3. Dla n prób Bemoulliego wyznaczyć najbardziej prawdopodobną wartość km, dla
146 M. WILK, A. B. WOJTCZAK 16] jeden kompleks enzymatyczny. Wartości Km dla poszczególnych
[7] CYKL NUKLEOTYD0W PURYNOWYCH 175 ność wartości Km enzymów z różnych gatunków i różnych tkane
/ otrzymuje się wartość: Km = [5], co pozwala zdefiniować stałąKm jako takie stężenie substrafu (w m
LastScan3(2) WŁAŚCIWOŚCI KINETYCZNE ENZYMÓW MODEL MICHAELISA - MENTENWYZNACZANIE WARTOŚCI KM ORAZ Vm
DSC00309 2 Znając szybkość Vmax i wartość Km można obliczyć szybkość reakcji przy dowolnym stęż
więcej podobnych podstron