skrypt wzory i prawa z objasnieniami65

128
Entropia
■ Dugą zasadę termodynamiki można sformułować poprzez wielkość fizyczną zwaną entropią:
Dla każdego układu izolowanego .sinieje taka funkcja stanu lego układu nazyur.na entropią i oznaczana przez S, że we wszystkich możliwych procesach wartość entropii nie może maleć"
ASżO.
Znak równości odnosi się do procesów odwracalnych, wtedy entropia jest siała natomiast wzrasta w trakcie procesów nieodwracalnych. Tak więc we wszystkich procesach rzeczywistych obserwuje się stały wzrost entropii, gdyż są to procesy nieodwracalne.
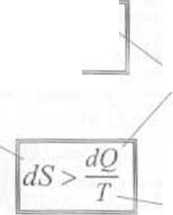
■ Entropię w termodynamice określa się następująco: jeżeli w danym procesie odwracalnym, ciało pobrało ciepło dQ w temperaturze Z, to przyrost entropii tego ciała wynosi dS =ÓQ!T.
■ Zmiana entropii układu w odwracalnym procesie przejścia ze sianu A da 8 (wykres pV po prawej stronic) nie zależy od rodzaju procesu. Zmiana ta jest całkowicie określona przez początkowy i końcowy stan układu A więc entropio układu, podobnie jak energia wewnętrzna, jest jednoznaczną funkcją jego stanu ■ Ze wzoru dS =dQ/T n ożna obliczyć entropię gazu doskonałego. Zakładamy źe ciepło doprowadzono w sposób odwracalny. Z pierwszej zasady termodynamiki dla n moli gazu mamy dQ=dU~<\W. Ponieważ dH - t*j; j &U-nCydT% otrzymujemy
d<2 = nC\dT~pdV.
Podstawiając d£ do wzoru na dS otrzymujemy
Ciśnienie p możxmy policzyć z równania Ciapeyrona
p = nRW.
Otrzymujemy
óS=nCv*f-rnR*jf.
Całkujemy i dostajemy
S = nCy In T+nR In V-.%,
gdzie Sa jest stałą całkowania równą entropii gazu doskonałego w stanic początkowym. Czyli znając przebieg przemiany gazu doskonałego można jedynie wyliczyć zmianę entropii AS = S-Sq w :cj przemianie Korzystając ze związków R = Cp - Cy oraz? = Cp'Cy możemy całej przekształcić wzór na entropie:
5- /iCj-lnT-f wyC; In V-nCyln F+5’q = nCyinfjThT"*} + $o
Ponieważ w procesie adiabatycznym odwracalnym =const. więc entropia
w tym przypadku jest stała.
Termodynamika
129
67. Entropia
przyrost entropii ciała* w procesie odwracalnym \ ^ UQ
przyrost er.tropu ciała *• procesie nieodwracalnym
V
ciepło pobrane przez ciało > przy nieskończenie małej zmianie stanu

• temperatura bezwzględna, przy której zachodzi proces
dwa różne odwracalne procesy przejścia układu ze stanu -I do stanu li
zmmna entropii układu przy przejściu zc stanu AĆoB
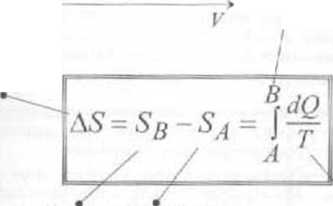
entropia układu entropia układu
w stanie B w stanie A
całkowanie przebiega f wzdłuż dowolnej krzywej ( łączącej siany A i B
temperatura bezw zględna
Wyszukiwarka
Podobne podstrony:
skrypt wzory i prawa z objasnieniami70 138 Entropia. Interpretacja statystyczna ■ Makroskopowy stan
skrypt wzory i prawa z objasnieniami55 108 Interwał czasoprzestrzenny ■ Ze wzoru =
skrypt wzory i prawa z objasnieniami59 116 Pojącia podstawowe. Ciepło Termodynamika117 H Podstaw owe
skrypt wzory i prawa z objasnieniami29 Zasada zachowania pędu 56
skrypt wzory i prawa z objasnieniami03 4 Układy współrzędnych ■ Układem odniesienia nazywamy ciało,
skrypt wzory i prawa z objasnieniami05 8 Prędkość ■ Tor jest to krzywa opisywana w przestrzeni przez
skrypt wzory i prawa z objasnieniami24 46 Pole grawitacyjne ■ Pole grawitacyjne przy powierzchni Zie
skrypt wzory i prawa z objasnieniami25 Pole sił zachowawczych (potencjalnych) ■ Jeśli w każdym punkc
skrypt wzory i prawa z objasnieniami37 72Moment bezwładności ■ Moment bezwładności
skrypt wzory i prawa z objasnieniami38 74 Ruch obrotowy ciała ■ Jak wynika z własności iloczynu wekt
skrypt wzory i prawa z objasnieniami49 96 Składanie drgań ■ Przy składaniu drgań o
skrypt wzory i prawa z objasnieniami50 ■ W naszym przypadku częstości drgań wzajemnie prostopadłych
więcej podobnych podstron