biiol5

/
gruboziarnistych (np. tuszu chińskiego), z którym miesza się zawiesinę bakterii i rozprowadza ją na szkiełku. Preparat suszy się (nie utrwala!) i następnie zabarwia komórki właściwym barwnikiem, najczęściej fuksyną przez 30 s. Przykładem tego barwienia jest barwienie otoczek metodą Burri-Ginsa. Wykonuje się je w następujący sposób:
» na odtłuszczone szkiełko przedmiotowe nanieść kroplę zawiesiny bakteryjnej (Cl. perfringens) i kroplę roztworu 10% nigrozyny;
* wykonać rozmaz za pomocą drugiego szkiełka podstawowego;
* wysuszyć na powietrzu i utrwalić preparat w płomieniu palnika;
15 utrwalony preparat barwić fuksyną fenolową przez 1-2 min;
* barwnik spłukać wodą, wysuszyć bibułą i obejrzeć pod mikroskopem.
Komórki barwią się na kolor czerwony, otoczki pozostają jasne, nie zabarwione, a tło wybarwia się na kolor brunatnoczerwony (rys. 3.2).
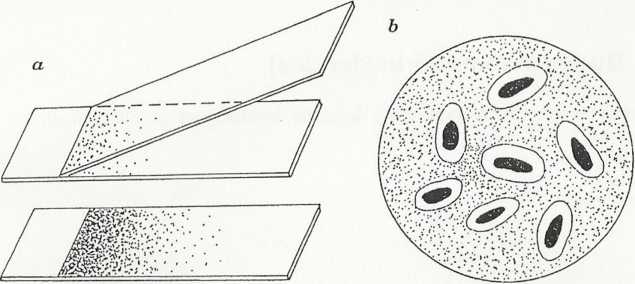
Rys. 3.2. Barwienie negatywno-pozytywne metodą Burri-Ginsa: a - sporządzanie rozmazu, b - obraz mikroskopowy
Barwienię metodą^ Grama:.. Jest barwieniem złożonym i ma podstawowe znaczenie taksonomiczne i diagnostyczne. Zastosowanie metody w praktyce doprowadziło do podziału wszystkich bakterii na Gram-dodat-nie i Gram-ujemne, różniące się budową ściany komórkowej, a także wieloma cechami fizjologicznymi i właściwościami biochemicznymi.
Utrwalony preparat barwimy, stosując kolejno:
0 roztwór fioletu krystalicznego 2-3 min;
0 płyn Lugola 2 min;
0 etanol (70%) do odbarwienia 30 s;
15 fuksynę fenolową (dobarwianie) 20 s.
Wszystkie etapy barwienia przedziela spłukiwanie preparatu wodą destylowaną. Po wysuszeniu oglądamy pod mikroskopem.
Efekt barwienia: komórki zabarwione na kolor fioletowy oznaczamy jako Gram-dodatnie, a zabarwione na kolor czerwony - jako Gram-ujemne.
Barwienie przetrwalników metodą Wiirtza w modyfikacji Scha-effera-Fultona
Utrwalony preparat barwimy:
• stosujemy zieleń malachitową (5% roztwór wodny) 30-60 s, podgrzewając trzykrotnie do ukazania się pary;
• spłukujemy wodą wodociągową przez 30 s;
• stosujemy safraninę (0,5% roztwór wodny);
• spłukujemy wodą;
• po wysuszeniu oglądamy pod mikroskopem;
• przetrwalniki barwią się na kolor zielony, a komórki wegetatywne na kolor czerwony.
Wykonanie ćwiczenia
Sporządzanie preparatów i metody barwienia
• Materiały: hodowle szczepów bakteryjnych: E. coli, Str. faecalis, B. sub-tilis, Cl. perfringens.
• Aparatura: mikroskopy świetlne.
• Szkło: szkiełka przedmiotowe, Lindnera i nakrywkowe.
• Odczynniki: błękit metylenowy, 10% roztwór nigrozyny, safranina, zieleń malachitowa, fiolet krystaliczny, fuksyna zasadowa, płyn Lugola, alkohol etylowy.
• Wykonanie:
- wykonać preparat barwiony metodą prostą, pozytywną Lfflera, używając szczepu E. coli;
- wykonać preparat barwiony metodą prostą, negatywną, stosując nigro-zynę i szczep bakteryjny Cl. perfringens;
- wykonać preparaty barwione metodą Grama, używając dwóch szczepów bakteryjnych: E. coli i Str. Faecalis;
- wykonać preparat barwiony metodą Wiirtza, stosując szczep B. subtilis;
- wszystkie wykonane preparaty oglądać pod mikroskopem przy powiększeniu 400 i 1 000 razy;
- poczynione obserwacje mikroskopowe zapisać w zeszycie.
4. MORFOLOGIA BAKTERII
4.1. Bakterie jako organizmy;prokaryotyczne
Bakterie ze względu na swą prymitywną i prostą budowę ciała należą do Prokaryota (bezjądrowych). Są to małe, jednokomórkowe organizmy, o wymiarach najczęściej 0,5-5,0 pm. Charakteryzują się różnorodnymi, aczkolwiek mało skomplikowanymi kształtami, które są cechą genetyczną danego gatunku. Wśród bakterii występują komórki o kształtach kulistych (tzw.
31
Wyszukiwarka
Podobne podstrony:
skanuj0024 154 Marcel Mauss nostki i opiekuje się nią w duchu, w którym miesza się poczucie przysług
skanuj0019 5 COLOURS - KOLORY Znajdź szczegóły, którymi różnią się oba jabłka. Pokoloruj jabłka na
przez Aliantów system konwojów, którymi broniono się przed atakami lodzi podwodnych, na szeroką skal
25988 SCAN0083 Znaidź 3 szczegóły, którymi różnią się obrazki. Różnice zakres! kółkiem na dolnym obr
Streszczenie Praca podejmuje problem metodologiczny, z którym borykają się nauki społeczne. Polega o
Filtracja Filtracja jest procesem, w którym z mieszaniny cieczy z cząstkami stałymi usuwa się część
Samobojstwa 7 stanu przeciwnego, Ij. stanu, w którym ja nie należy do siebie, miesza się z czymś, co
Proksemika dystans publiczny - obszar, w którym kontaktujemy się z osobami publicznymi (np. ministre
Zanieczyszczenia płynne mogą należeć do mieszających się z wodą (np. główna masa płynnych
CCF20091231�013 tać”. A nasz wyraz „radio”, którym posługujemy się obecnie w takich np. wypowiedziac
Małowodzie jpeg Rokowanie- Na rokowanie wpływają choroby matki lub płodu, z którymi trze się wielowo
W obwodzie anodowym mieszacza znajduje się rezonansowy filtr pasmowy, na którym wydziela się napięci
się dowiedzieć paru ciekawych rzeczy o relacjach np. japońsko-chińskich gdyż prowadzący niewątpliwie
Scan0075 (12) Zasady pisowni i wymowy hiszpańskiejPeru - kraj, w którym tradycja miesza się z nowocz
więcej podobnych podstron