skanuj0047 (Kopiowanie)
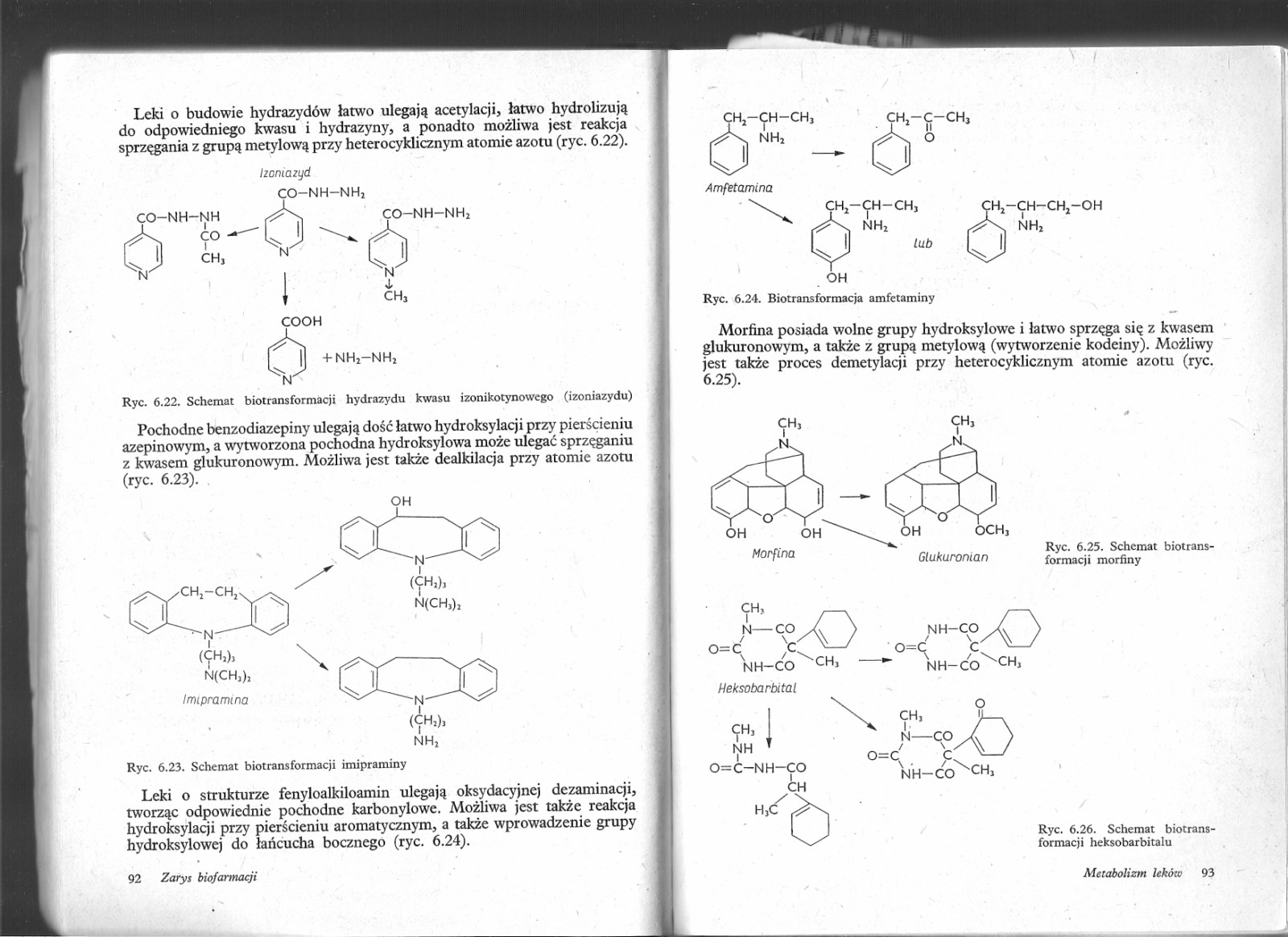
Leki o budowie hydrazydów łatwo ulegają acetylacji, łatwo hydrolizują do odpowiedniego kwasu i hydrazyny, a ponadto możliwa jest reakcja sprzęgania z grupą metylową przy heterocyklicznym atomie azotu (ryc. 6.22).
Izcma zyd
Ryc. 6.22. Schemat biotransformacji hydrazydu kwasu izonikotynowego (izoniazydu)
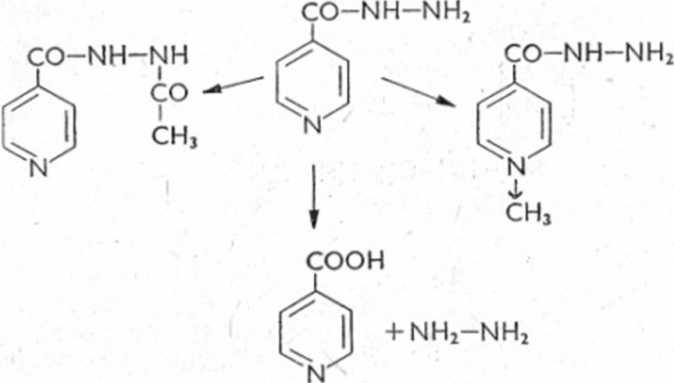
Pochodne benzodiazepiny ulegają dość łatwo hydroksylacji przy pierścieniu azepinowym, a wytworzona pochodna hydroksylowa może ulegać sprzęganiu z kwasem glukuronowym. Możliwa jest także dealkilacja przy atomie azotu (ryc. 6.23). .
OH
Ryc. 6.23. Schemat biotransformacji imipraminy
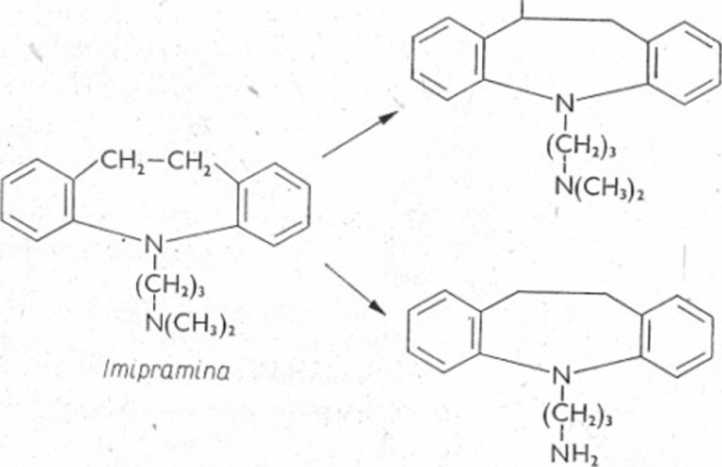
Leki o strukturze fenyloalkiloamin ulegają oksydacyjnej dezaminacji, tworząc odpowiednie pochodne karbonylowe. Możliwa jest także reakcja hydroksylacji przy pierścieniu aromatycznym, a także wprowadzenie grupy hydroksylowej do łańcucha bocznego (ryc. 6.24).
92 Zarys biofarmacji
CH2—CH—CHj 1 2 I
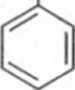
Amfetamina
nh2
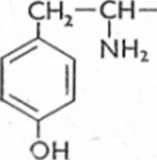
lub
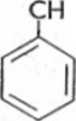
2-ch-ch2-oh nh2
Ryc. 6.24. Biotransformacja amfetaminy
Morfina posiada wolne grupy hydroksylowe i łatwo sprzęga się z kwasem glukuronowym, a także z grupą metylową (wytworzenie kodeiny). Możliwy jest także proces demetylacji przy heterocyklicznym atomie azotu (ryc. 6.25).
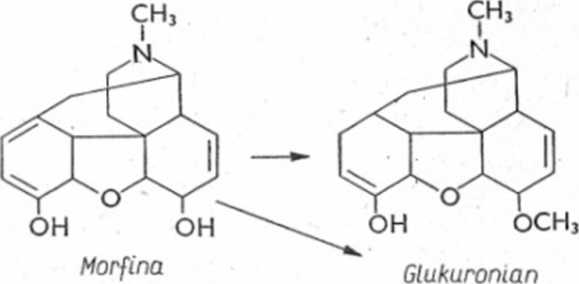
*
Ryc. 6.25. Schemat biotransformacji morfiny
CH,
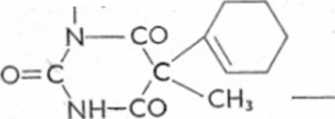
• o=c c
*■ NH-CO^CH>
Heksobarbital
NH-CO
/ \
ch,
NH
0=C-NH-CO
i
\
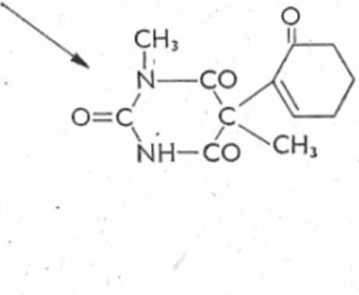
Ryc. 6.26. Schemat biotransformacji heksobarbitalu
Metabolizm leków 93
Wyszukiwarka
Podobne podstrony:
skanuj0045 (Kopiowanie) CH3COOH + ATP+ CoASH CH3-CO-S-CoA + AMP * PP Acetylo-CoA &/ (aktywny oct
skanuj0048 (Kopiowanie) Barbiturany łatwo hydrolizują, co prowadzi do degradacji układu heterocyklic
skanuj0052 (Kopiowanie) 7.6. Wydalanie substancji leczniczych z potem Nabłonek gruczołów potowych sz
skanuj0108 (Kopiowanie) 9.10. Leki podawane do ucha 9.10.1. Anatomia, fizjologia i elementy patofizj
skanuj0131 (Kopiowanie) wyższa przez obkurczanie naczyń. Te 2 leki działają przez swoje własne recep
skanuj0135 (Kopiowanie) się pojawiać u pacjentów, którzy samowolnie zażywają leki zawierające czynne
skanuj0048 (5) Zarówno MelIPO.,. jak i MedPQ4b łatwo rozpuszczają się w rozcieńczonych kwasach miner
skanuj0052 (30) MS Modernizacja MS Modernizacja ulegają warunki, w których jednostka działa, środki,
skanuj0070 (Kopiowanie) w którym stałe B i A są określone równaniami: FD (9.8) FD . _ TTe (9.9)
skanuj0006 (241)
skanuj0001 (Kopiowanie) Biblioteka Akademii Medycznej w Białymstoku tś i? AM B0020826 ■ -m W.
więcej podobnych podstron