096

A HibUl. IM1U.1 ,Vv»« .•»•»»«. :u, r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >«}
3 ELEKTRONOWA STRUKTURA ATOMU
Wypadkowa liczba kwantowa L jest wektorową sumą orbitalnych liczb kwantowych / poszczególnych elektronów Dla dwóch elektronów o liczbach kwantowych 1/ i h może ona przyjmować wartości całkowite od |/| +/j) do (/, —/2). jeśli /, > l2. Na przykład dla elektronu />(/;— I) i elektronu d (/( = 2) I. może przyjąć wartości 3, 2 i 1. W analogu do oznaczania liczby kwantowej I symbolami literowymi s. />. d, f... również wartości wypadkowej liczby kwantowej /. oznaczamy literami
5 gdy
F
D
F
O
H
L = 0 L = 1 L = 2 L = 3 / 4
L = 5 itd.
(z pominięciem litery J).
Sumowanie wypadkowego spinowego momentu pędu. i wypadkowego orbitalnego momentu, , wszystkich elektronów prowadzi do uzyskania całkowitego momentu pędu wszystkich elektronów w atomie, charakteryzującego się liczbą kwantowa J i wynoszącego
A/l5* - yJJU + 1)^ (3.40)
Sumaryczna liczba kwantowa J jest sumą wektorową liczb kwantowych L i 5 Dla L > S może przyjąć wszystkie wartości różniące się o 1 od L + S do L - S (lub też od 5 -f L do 5 — /.. jeżeli S > L).
Jak z przytoczonych tutaj rozważań wynika, momenty pędu spinowe i orbitalne mogą w danym atomie sumować się na różne sposoby Różnym stanom charakteryzującym się różnymi liczbami kwantowymi S. L i J odpowiadają różne wartości energii. Poszczególne stany energetyczne atomów charakteryzujące się określonymi wartościami liczb kwantowych 5 i /. nazywamy termami atomowymi. Symbol termu atomowego podajemy w postaci:
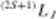
Wyszukiwarka
Podobne podstrony:
A HibUl. IM1U.1 .Vv»« r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >«} 3 ELEK
A HibUl. IM1U.1 ,Vv»« r ), buui :uO ISBN D4H1II S-7. © l>. »N TOS >*} 3 ELEK
A HibUl. IM1U.1 ,Vv»« :i>, r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >«
A HibUl. IM1U.1 .Vv»« r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >*} 6
A HibUl. IM1U.1 ,Vv»« :u, r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >«} 1
A HibUl. IM1U.1 ,Vv». r ), buui :uO ISBN D4H1II t-7. © l>. »N TOS >*} 22 2 J
A HibUl. IM1U.1 ,Vv». -u, r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >«} 26
A HibUl. IM1U.1 ,Vv»« .«»•»». :u, r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >«} 33 2 7 PROST
A HibUl. IM1U.1 ,Vv»« --u, r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS »*} 2 JĄ
A HibUl. IM1U.1 ,Vv»« --u, r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >«} 3
A HibUl. IM1U.1 ,Vv»« r ), buui :uO ISBN D4H1II f- © l>. »N TOS >«} 50 3
A HibUl. IM1U.1 ,Vv». -u, r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >«} S5
A HibUl. IM1U.1 .Vv»« r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >«} 59 3 4
A HibUl. IM1U.1 ,Vv»« --u, r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >*} 6
A HibUl. IM1U.1 ,Vv»« r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >«} 74 3
A HibUl. IM1U.1 ,Vv.i r.», r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >*} 3
A HibUl. IM1U.1 ,Vv»« --u, r I, buui :uO ISBN D4H1II ł-7. © l>. »N TOS >*} 3
A HibUl. IM1U.1 ,Vv»« r.», r I, buui :uO ISBN D4H1II ł-7. © l>. »N TOS >*} 3
więcej podobnych podstron