142

A HibUl. IM1U.1 ,Vv»« :u, r ), buui :uO
ISBN D4H1II ł-7. © l>. »N TOS >*}
142 4 BUOOWA CZĄSTECZKI
wistości stwierdza się jednak, jak już powiedziano, że wszystkie wiązania mają takie same właściwości, są żalem równoccnne. Po drugie, wiązania utworzone przez orbitale 2/>,<•* 2/>v.c ' -/K.c powinny tworzyć pomiędzy sobą kąty 90 . gdyż osie wymienionych orbitali są do siebie prostopadle. W rzeczywistej cząsteczce wszystkie kąty są jednakowe i wynoszą 109 28'.
Wyniki zgodne z doświadczeniem uzyskuje się po wprowadzeniu orbitali zhybrydy-zowanych, czyli obliczeniu orbitali cząsteczkowych nic z prostych orbitali atomowych węgla: 2s(-. 2p,,ę. 2py.c < 2p:,ę, lecz z funkcji stanowiących liniową kombinację tych orbitali. Są to funkcje:
/i « ^(2.vc + 2pt.c + 2p,.c + 2pj.cl h ~ jf2Je + 2p,.ę — 2p,.c — 2p. c) r, = 3 (2rc - 2/>,.c + 2/>,.c - 2p..c)
/4 = j(2sc - 2pt.c — 2p,.c + 2pr.cl
Tego rodzaju funkcje ..mieszane" noszą właśnie nazwę orbitali zhybrydyzowanych
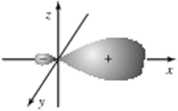
K>s. 4.10. Kontury otbtialu zhybrydyzowanego
Wszystkie cztery orbitale zhybrydyzowane mają taki sam kształt. Wykres części kątowej takiego orbitalu pokazano na rys. 4.10. Rysunek ten wskazuje, że orbital zhybrydy-zowany nic jest symetryczny w stosunku do początku układu współrzędnych. Pow^nfuje to. że po jednej stronic początku układu (odpowiadającej dodatnim wartościom orbitalu) prawdopodobieństwo napotkania elektronu jest większe niż po drugiej stronie (odpowia dającej ujemnym wartościom orbitalu). Odpowiednio do tego wiązania utworzone przez nakładanie części dodatniej orbitalu zhybrydyzowanego z orbitalcm sąsiedniego atomu jest silniejsze niż w przypadku użycia oibitalu niezhybrydyzowanego.
Jak wskazują obliczenia, orbitale zhybrydyzowane h.h- h i U są tak rozmieszczone w przestrzeni, że kąty pomiędzy ich osiami wynoszą 109 28'. Inaczej mówiąc, są one Skierowane ku narożom czworościanu foremnego, w którego środku znajduje się jądro atomu węgla (rys. 4.11). Wszystkim czterem orbitalom zhybrydyzowanym odpowiada taka sama energia. Orbitale cząsteczkowe będziemy teraz tworzyć z orbitalu zhybrydyzowanego r, atomu węgla i z orbitalu l.<n.i. atomu wodoru I, z oibitalu r< atomu węgla i orbitalu 1%. atomu wodom 2 itd. Warunkiem, który musi być spełniony, aby można było obliczać efektywne orbitale cząsteczkowe, jest m in nakładanie orbitali f| i Istu,
Wyszukiwarka
Podobne podstrony:
A HibUl. IM1U.1 ,Vv»« :i>, r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >«
A HibUl. IM1U.1 .Vv»« r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >*} 6
A HibUl. IM1U.1 ,Vv»« :u, r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >«} 1
A HibUl. IM1U.1 ,Vv». r ), buui :uO ISBN D4H1II t-7. © l>. »N TOS >*} 22 2 J
A HibUl. IM1U.1 ,Vv». -u, r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >«} 26
A HibUl. IM1U.1 ,Vv»« .«»•»». :u, r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >«} 33 2 7 PROST
A HibUl. IM1U.1 ,Vv»« --u, r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS »*} 2 JĄ
A HibUl. IM1U.1 ,Vv»« --u, r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >«} 3
A HibUl. IM1U.1 ,Vv»« r ), buui :uO ISBN D4H1II f- © l>. »N TOS >«} 50 3
A HibUl. IM1U.1 ,Vv». -u, r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >«} S5
A HibUl. IM1U.1 .Vv»« r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >«} 59 3 4
A HibUl. IM1U.1 ,Vv»« --u, r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >*} 6
A HibUl. IM1U.1 .Vv»« r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >«} 3 ELEK
A HibUl. IM1U.1 ,Vv»« r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >«} 74 3
A HibUl. IM1U.1 ,Vv.i r.», r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >*} 3
A HibUl. IM1U.1 ,Vv»« r ), buui :uO ISBN D4H1II S-7. © l>. »N TOS >*} 3 ELEK
A HibUl. IM1U.1 ,Vv»« --u, r I, buui :uO ISBN D4H1II ł-7. © l>. »N TOS >*} 3
A HibUl. IM1U.1 ,Vv»« r.», r I, buui :uO ISBN D4H1II ł-7. © l>. »N TOS >*} 3
więcej podobnych podstron