225

A HibUl. IM1U.1 ,Vv»« --u, r ), buui :uO
ISBN D4H1II *Z. © l>. »N TOS >«}
7.11 ENERGIA SIECIOWA KRYSZTAŁÓW JONOWYCH 225
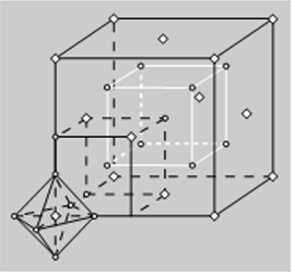
Rys. 7.16. Sieć przestrzenna cliloropUiynianu potasu
rodzaju sieci przestrzennej podajemy na rys. 7.1ń sieć przestrzenną K:|PtCUl Jest to sieć typu antyfluorytu. tj. sieć Huorytu. w której miejsce anionów F zajmują kationy K‘. miejsce kationów Ca’’ — aniony (PtCl„): .
W sieciach przestrzennych krzemianów znajdują się aniony zlozonc z tctracdrycznych grap [SiOa], które mogą występować albo w postaci pojedynczych jonów kwasu ot to* krzemowego |SiO.|)‘“. albo w zespołach zawierających ograniczoną lub nieograniczoną liczbę tych jonów W tym ostatnim przypadku powstają aniony o budow ie łańcuchowej, wstęgowej, warstwowej lub szkieletowej (p. 22.15). Dwie łączące się z sobą ictracdrycznc grapy (SiOłl mają jeden atom tlenu wspólny. Wiązanie Si—O ma charakter pośłedni między wiązaniem jonowym a kowalencyjnym. Między anionami krzemianowymi a kationami metalicznymi w sieci działają natomiast siły kulombowskie.
Na zakończenie należy wspomnieć, ze znane są sieci krystaliczne, których elementy łączą się z sobą za pomocą wiązań wodorowych. Do tego rodzaju substancji krystalicznych należą m. in.: lód (p. 26.2). kwas borowy (p. 24.25). diaspor HAIO-. Wiązania takie tworzą się również pomiędzy anionami wodorosoli. jak NaHCOi, NajHPOł itd.
7.11. ENERGIA SIECIOWA KRYSZTAŁÓW JONOWYCH
Mówiąc o kryształach jonowych, mamy na myśli najczęściej takie substancje, jak CsF. NaCI. NaF itd Wyjątkowo prosta struktura sieci tych związków pozwala na stosunkowa łatwe obliczenie ich energii sieciowej, tj. ilości energii, której należy dostarczyć, by 1 mol cząsteczek danej substancji rozłożyć na jony znajdujące się w nieskończenie dużych odległościach od siebie. Wielkość ta wyraża całkowitą energię potencjalną kryształu. Zalezą od niej takie jego właściwości, jak temperatura topnienia, rozpuszczalność, lotność, a nawet w pewnym stopniu twardość.
Wyszukiwarka
Podobne podstrony:
A HibUl. IM1U.1 ,Vv»« :i>, r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >«
A HibUl. IM1U.1 .Vv»« r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >*} 6
A HibUl. IM1U.1 ,Vv»« :u, r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >«} 1
A HibUl. IM1U.1 ,Vv». r ), buui :uO ISBN D4H1II t-7. © l>. »N TOS >*} 22 2 J
A HibUl. IM1U.1 ,Vv»« .«»•»». :u, r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >«} 33 2 7 PROST
A HibUl. IM1U.1 ,Vv»« --u, r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS »*} 2 JĄ
A HibUl. IM1U.1 ,Vv»« --u, r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >«} 3
A HibUl. IM1U.1 ,Vv»« r ), buui :uO ISBN D4H1II f- © l>. »N TOS >«} 50 3
A HibUl. IM1U.1 ,Vv». -u, r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >«} S5
A HibUl. IM1U.1 .Vv»« r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >«} 59 3 4
A HibUl. IM1U.1 ,Vv»« --u, r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >*} 6
A HibUl. IM1U.1 .Vv»« r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >«} 3 ELEK
A HibUl. IM1U.1 ,Vv»« r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >«} 74 3
A HibUl. IM1U.1 ,Vv.i r.», r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >*} 3
A HibUl. IM1U.1 ,Vv»« r ), buui :uO ISBN D4H1II S-7. © l>. »N TOS >*} 3 ELEK
więcej podobnych podstron