344

A r ź. (Uimm 2U&
KW rmhni v>. o ty un rws w:
344
I RÓWNOWAGI W ROZTWORACH ELEKTROLITÓW KWASY I ZASADY
metylowy w roztworach o pH < 3.1 ma barwę czerwoną, w roztworach o pH > 4.4 — barwę żółtą, w roztworach o pH pomiędzy 3.1 a 4,4 przybiera barwy pośrednie pomiędzy barwą żółtą a czerwoną. Błękit bromolymolowy w roztworach kwaśnych o pH < 6.0 jest żółty, w roztworach zasadowych o pił > 7.6 — niebieski: w zakresie pił pomiędzy 6,0 a 7.6 przybiera różne odcienie barwy zielonej, pośrednie pomiędzy barwą żółtą a niebieską. Właściwości niektórych wskaźników zestawiono w labl. 11.3. Przez dodanie do kolejnych próbek badanego roztworu niewielkich ilości wskaźników możemy w przybliżony sposób określić pH Jeśli na przykład roztwór barwi się na niebiesko po dodaniu błękitu broinołymolowcgo, lecz pozostaje bezbarwny po dodaniu roztworu fcnoloftaleiny. to wnioskujemy, że wartość pH zawarta jest pomiędzy 7.6 a 8.3. Jeśli ponadto czerwień obojętna przybiera w tym roztworze barwę bursztynową, to pił > 8.0. Możemy więc powiedzieć, że pil zawiera się w granicach od 8.0 do 8,3.
11.5. DYSOCJACJA KWASÓW I ZASAD W ROZTWORACH WODNYCH 11.5.1. ZASTOSOWANIE PRAWA DZIAŁANIA MAS DO DYSOCJACJI KWASÓW I ZASAD
Kwas nazywamy kwasem mocnym, jeżeli w roztworze wodnym ulega bardzo daleko posuniętej dysocjacji. a kwasem słabym, gdy dysocjuje tylko mała jego część. Porównując moc dwóch różnych kwasów musimy uwzględnić, ze ich dysocjacja w roztworach wodnych zależy od dwóch czynników : od tendencji cząsteczek kwasu do oddawania protonów oraz od stężenia kwasu. Wielkością, która dobrze charakteryzuje indywidualne właściwości cząsteczek i która nic zależy od stężenia, jest stała dysocjacji. Aby uzyskać wyrażenie opisujące tę wielkość, rozważmy dysocjację kwasu HX w roztworze wodnym:
IIX+ 11,0^ 11,0*-X
Jeżeli roztwór jest rozcieńczony, a kwas jest slaby, można do równowagi, jaka się ustala, zastosować prawo działania mas:
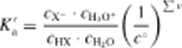
111.4>
W roztworze rozcieńczonym stężenie wody cn,o można przyjąć za stale i napisać równanie (11.4) w postaci lub tez w postaci uproszczonej z pominięciem symbolu c
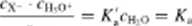
(11-5>
Wyszukiwarka
Podobne podstrony:
A r ). (Uimm 2U& KW rmhni v>. o ty un rws w: 16 1 PODSTAW
A r J. (Uimm 2U& KW rmhni v>. o ty un rws w: 10z 3 ELfKTR
A r ). (Uimm 2U& KW rmhni v>. o ty un rws w: 4 4 HCWOJĄDRCrtE CZĄSTECZKI DW
A r J. (Uimm 2U& KW rmhni v>. o ty un rws w: 4 7 WIĄZANIA POŚREDNIE POMIĘDZ
A r ). (Uimm 2U& KW rmhni v>. o ty un rws w: 224 7 CIAŁO
A r ). (Uimm 2U& KW rmhni v>. o ty un rws w: 9 TERMOCHEMIA Odejmując strona
A r ). (Uimm 2U& KW rmhni v>. o ty un rws w: 378 12 UTLEN
A r ). (Uimm 2U& KW rmhni v>. o ty un rws w: 3% 13 zjawis
A r ). (Uimm 2U& KW rmhni v>. o ty un rws w: 408 13 ZJAWI
A r ). (Uimm 2U& KW rmhni v>. o ty un rws w: 14 2 PROSTE REAKCJE JEDNO-, DW
A r ). (Uimm 2U& KW rmhni v>. o ty un rws w: 418 U KINETY
A r /. (Uimm 2U& KW rmhni v>. o ty un rws w: 468 15 ZWIĄZ
A r ). (Uimm :t«u KW rmhni v>. o ty un rws w: 3 U 10 RÓWNOWAG
A r ). (Uimm :t«u KW rmhni v>. o ty un rws w: 340 11 RÓWNOWAG
A r J. (Uimm :t«u KW rmhni v>. o ty un rws w: 4 1 PODSTAWOWE
A r ). (Uimm :t«u KW rmhni v>. o ty un rws w: 8 1 PODSTAWOWE
A r ). (Uimm :t«u KW rmhni v>. o ty un rws w: U 1 PODSTAWOWE
A r J. (Uimm :t«u KW rmhni v>. o ty un rws w: 24 2 iĄDRO ATOMOWE W podobny spos
więcej podobnych podstron