393

A HibUl. IM1U.1 ,Vv»« --u, r ), buui :uO
ISBN D4H1II ł-7. © l>. »N TOS »*}
12 8 DIAGRAMY PROSTA I E8SW0RTMA
U)
(mi
Mn+ 211,0 MniOHl; + H. Mn(OH), + JH; * Mn(OH)j + H:0 Mn(OH), ^ MnO, + H O + iH2
MnO] + H: MnO, + 20H
MnO, + iH; ^ MnO;' + H*
Reakcje te możemy przeprowadzić w ogniwach o następujących schematach:
Mn|Mn(OHhl|H*|H:.Pt
Pi. H. | II* || Mn<OH)2.Mn(OH), | Pi
(0
Pi | Mn(OH)». MnO-11H' |H Pt Pt. Hi Itr || MnO;. MnO;" | Pt Pt. H; | H* II MnO;-. MnO; | Pt
W tych ogniwach jednym z pólogniw jest standardowa elektroda wodorowa, drugim elektroda redoks*. w której aktywności jonów manganu znajdujących się w roztworze przyjmiemy, podobnie jak i poprzednio, za równe jedności Są to, jak już wspomniano, roztwory alkaliczne zawierające jony Ol 1 o aktywności również równej jedności.
Silę elektromotoryczną tych ogniw obliczamy analogicznie jak w przypadku związków manganu w roztworach kwaśnych, posługując się danymi z tabl. 12.3:
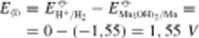
AGj a -299.1 kJ mol
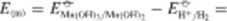
AG,;, = -19.3 kJ mol'1
■ 0.2-0-0.2 V
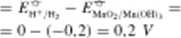
f — f" - y" —
'-0'
ACZ = -19.3 kJ mol '
AG; — -115.8 kJ mol
= 0.60 - 0 = 0.60 V
AGZ - -56.0 kJ mol 1
r
ch*/h,
-0.58-0-0.58 V
Przyjmując, że entalpia swobodna manganu metalicznego jest równa zeru, znajdujemy kolejne wartości entalpii swobodnej w roztworach alkalicznych dla Mn(OH>2. Mn(OH),. MnO», MnO;- i MnOj jako równe odpowiednio: -299.1, —279.8, -299,1, -183.3 oraz —128.0 kJ • mol Wyniki tc zostały przedstawione na diagramie na rys. 12.4.
(o) MnO; + 2H:0 + 2c' * MnO. + aOH' te) MiyO; +1 =MnO|
‘N'a elektrodach redoks zachodzą odwracalne reakcje:
MntOHl: + 2c" m Mn + 20H-(m) MniOH), i c =MmOHi: i OH <n) MnO; + 2H-0 +c «* MntOH), + OH
Wyszukiwarka
Podobne podstrony:
A HibUl. IM1U.1 ,Vv»« r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >*} 12.2 S
A HibUl. IM1U.1 .Vv»« r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >«} 12 4 E
A HibUl. IM1U.1 ,Vv»« :i>, r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >*
A HibUl. IM1U.1 .Vvo r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >«} 12 8 DI
A HibUl. IM1U.1 ,Vv»« :i>, r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >«
A HibUl. IM1U.1 .Vv»« r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >*} 6
A HibUl. IM1U.1 ,Vv»« :u, r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >«} 1
A HibUl. IM1U.1 ,Vv». r ), buui :uO ISBN D4H1II t-7. © l>. »N TOS >*} 22 2 J
A HibUl. IM1U.1 ,Vv». -u, r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >«} 26
A HibUl. IM1U.1 ,Vv»« .«»•»». :u, r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >«} 33 2 7 PROST
A HibUl. IM1U.1 ,Vv»« --u, r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS »*} 2 JĄ
A HibUl. IM1U.1 ,Vv»« --u, r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >«} 3
A HibUl. IM1U.1 ,Vv»« r ), buui :uO ISBN D4H1II f- © l>. »N TOS >«} 50 3
A HibUl. IM1U.1 ,Vv». -u, r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >«} S5
A HibUl. IM1U.1 .Vv»« r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >«} 59 3 4
A HibUl. IM1U.1 ,Vv»« --u, r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >*} 6
A HibUl. IM1U.1 .Vv»« r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >«} 3 ELEK
A HibUl. IM1U.1 ,Vv»« r ), buui :uO ISBN D4H1II ł-7. © l>. »N TOS >«} 74 3
więcej podobnych podstron