skan0071

74 Termodynamika chemiczna
Tak więc
ASuk = ASl + AS2 = 3,48 J • K"1.
Wynik ten jest ilustracją faktu, że w procesie nieodwracalnym zachodzącym w układzie izolowanym całkowita zmiana entropii układu jest większa od zera. ■
Entropia jest funkcją stanu, która jest bardzo czuła na zmianę objętości lub ciśnienia gazów. Wynikające stąd zmiany entropii obliczamy przez całkowanie wyrażeń (3.44) bądź (3.48), z uwzględnieniem odpowiednich równań stanu.
Dla gazu idealnego w stałej temperaturze
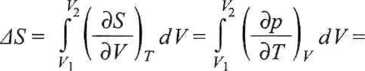
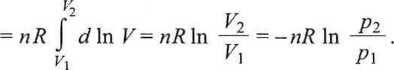
(3.49)
Dla procesów, w których zmieniają się wszystkie trzy parametry {p, T, V), łączną zmianę entropii przy przejściu od stanu 1 do stanu 2 obliczamy, korzystając z właściwości funkcji stanu (zob. rys. 3.11):
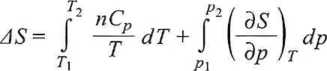
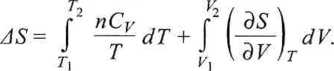
(3.50)
lub
(3.51)
i
p lub V
2
T
Rys. 3.11
Wyszukiwarka
Podobne podstrony:
skan0059 (2) 62 Termodynamika chemiczna Tak oszacowana wartość AH298 ciekłej gliceryny w niewielkim
skan0063 (2) 66 Termodynamika chemiczna Przykład 3.11. Obliczyć entalpię parowania toluenu w 25°C, k
skan0099 102 Termodynamika chemiczna na podstawie standardowych entalpii tworzenia
skan0233 236 Kinetyka chemiczna Tak więc, po drobnych przekształceniach mamy 236 Kinetyka chemiczna
74354 skan0089 92 Termodynamika chemiczna Tabela
skan0053 (2) 56 Termodynamika chemiczna W tab. 3.2 zestawiono wyrażenia, za których pomocą możemy ob
skan0055 58 Termodynamika chemiczna a) Z równania stanu (2.9) obliczamy ciśnienie
skan0057 60 Termodynamika chemiczna zbiorach symbol AH298 oznaczał standardową wartość entalpii twor
skan0061 64 Termodynamika chemiczna zostanie zużyte w całości na ogrzanie produktów tej reakcji do t
skan0079 (2) 82 Termodynamika chemiczna Ciepło reakcji w T= 323,15 K możemy obliczyć z prawa Kirchho
skan0091 (2) 94 Termodynamika chemiczna wynosi AG?9S = żfG$98(NH3) + 4GS98(HC1) - ^G198(NH4C1) = = -
skan0093 (2) 96 Termodynamika chemiczna Po podstawieniu AHj- do relacji Van’t Hoffa (3.85) i scałkow
więcej podobnych podstron