Grupa |
Zespół |
Ćwiczenie |
Data |
Ocena |
22 |
4 |
6 |
24.03.2010 |
|
Imię i nazwisko |
Temat ćwiczenia |
|||
Rafał Simko Janusz Rogulski Łukasz Maziarski |
Wyznaczanie zależności przewodnictwa słabych i mocnych elektrolitów od stężenia. |
|||
1. Wstęp teoretyczny
Przewodnictwem nazywamy zdolność do przewodzenia prądu elektrycznego, a ciała, które tę zdolność posiadają, nazywamy przewodnikami. Rozróżniamy 2 typy przewodników: I rodzaju (przewodzą prąd elektronowo) i II rodzaju (przewodzą prąd za pośrednictwem jonów). Przewodnictwo II rodzaju nazywamy przewodnictwem elektrolitycznym. Uporządkowany ruch jonów, zwany migracją jonów, pozwala na przenoszenie ładunku poprzez elektrolit.
Szybkość poruszania się jonów w polu elektrycznym zależy od:
rodzaju i stężenia jonów
lepkości ośrodka i temperatury
spadku napięcia
Szybkość poruszania się jonów nazywana jest ruchliwością jonów. Wyróżniamy ruchliwość względną i bezwzględną. Bezwzględna szybkość wędrówki jonu (ruchliwość) jest to szybkość w cm/s jakiej nabiera jon w polu elektrycznym o spadku potencjału 1 V/cm. W rozcieńczeniu nieskończenie wielkim ruchliwość osiąga wartość maksymalną dla danej temperatury i rozpuszczalnika i nazywana jest ruchliwością graniczną. Ruchliwość względna (liczba przenoszenia jonów) wskazuje jaka część ogólnego ładunku, który przepłynął przez obwód podczas elektrolizy została przeniesiona przez kationy, a jaka przez aniony. Oblicza się ją z wzoru:
![]()
![]()
,
gdzie u+, u- - bezwzględne szybkości wędrówki kationu i anionu, nK, nA - liczby przenoszenia kationu i anionu. Należy pamiętać, że nK + nA = 1.
Przewodzenie prądu przez przewodniki I i II rodzaju podlega prawu Ohma, zatem:
![]()
,
gdzie i - natężenie prądu, V - różnica potencjałów między końcami przewodnika, R - opór przewodnika.
Odwrotność oporu nazywamy przewodnictwem. Opór zależy od długości l i przekroju s przewodnika:
![]()
Współczynnik ρ nazywa się oporem właściwym. Z kolei odwrotność oporu właściwego nazywa się przewodnictwem właściwym i oznacza:
![]()
Gdy w objętości V cm3 rozpuszczalnika rozpuszczony jest 1 gramorównoważnik chemiczny substancji, wówczas zmierzone przewodnictwo elektrolityczne nazywamy przewodnictwem równoważnikowym λ. Zależność pomiędzy przewodnictwem właściwym, a równoważnikowym wyraża równanie:
![]()
,
gdzie c - stężenie w gramorównoważnikach na dm3.
W roztworach mocnych elektrolitów, które są całkowicie zdysocjowane na jony, przewodnictwo równoważnikowe wzrasta ze zmniejszaniem stężenia c aż do wartości granicznej ![]()
osiąganej przy rozcieńczeniu nieskończenie wielkim. Dla elektrolitów słabych, których stopień dysocjacji wzrasta wraz z rozcieńczeniem roztworu, przewodnictwo graniczne odpowiada momentowi, w którym wszystkie cząsteczki znajdujące się w roztworze są zdysocjowane. Natomiast przewodnictwo równoważnikowe λ odpowiada tylko częściowej dysocjacji elektrolitu. Przyjmując przewodnictwo równoważnikowe za wielkość proporcjonalną do stopnia dysocjacji, mamy:
λ=kα
gdy α=1, otrzymujemy:
![]()
= k
Z tego wynika że:
![]()
Równanie to pozwala obliczyć stopień dysocjacji elektrolitu w danym rozcieńczeniu, jeżeli znana jest wartość jego przewodnictwa równoważnikowego w tym rozcieńczeniu i w rozcieńczeniu granicznym.
Na podstawie prawa niezależnej wędrówki jonów Kohlrauscha otrzymamy:
![]()
=![]()
+![]()
Dzięki otrzymanym zależnościom możemy obliczać stałą oraz stopień dysocjacji danego elektrolitu na podstawie pomiarów przewodnictwa.
2. Cel ćwiczenia
Wyznaczenie zależności przewodnictwa molowego od pierwiastka stężenia dla słabych i mocnych elektrolitów, oraz wyznaczenie stałej i stopnia dysocjacji dla słabych elektrolitów oraz sprawdzenie zakresu stosowalności równania empirycznego Kohlrauscha.
3. Wykonanie ćwiczenia
Przygotowujemy roztwory 0,1-molowe (C0) kwasu octowego, octanu sodowego, chlorku sodu oraz kwasu solnego. Roztwory te rozcieńczamy otrzymując stężenia C0/2, C0/4, C0/8, C0/16, C0/32. Każdy z otrzymanych roztworów badamy pod kątem przewodnictwa, za pomocą miernika.
4. Opracowanie wyników
Stała naczynka k = 0,48
Przewodnictwo właściwe rozpuszczalnika (woda) = 6,73μS
W tabeli zostały przedstawione wartości przewodnictwa właściwego dla badanych roztworów elektrolitów o różnych stężeniach bez odejmowania przewodnictwa właściwego rozpuszczalnika.
|
Stężenie [mol/dm3] |
Przewodnictwo właściwe [mS] |
|||
|
|
NaCl |
HCl |
CH3COOH |
CH3COONa |
c0 |
0,01 |
1,090 |
2,640 |
0,146 |
0,592 |
c0/2 |
0,005 |
0,570 |
1,360 |
0,109 |
0,291 |
c0/4 |
0,0025 |
0,270 |
0,700 |
0,075 |
0,135 |
c0/8 |
0,00125 |
0,130 |
0,360 |
0,052 |
0,070 |
c0/16 |
0,000625 |
0,068 |
0,187 |
0,036 |
0,037 |
c0/32 |
0,0003125 |
0,034 |
0,099 |
0,022 |
0,020 |
Wartości zmierzonego przewodnictwa właściwego badanych roztworów o różnych stężeniach po odjęciu przewodnictwa właściwego rozpuszczalnika.
|
Stężenie [mol/dm3] |
Przewodnictwo właściwe [mS] |
|||
|
|
NaCl |
HCl |
CH3COOH |
CH3COONa |
c0 |
0,01 |
1,08999 |
2,63999 |
0,14599 |
0,59199 |
c0/2 |
0,005 |
0,56999 |
1,35999 |
0,10899 |
0,29099 |
c0/4 |
0,0025 |
0,26999 |
0,66999 |
0,07499 |
0,13499 |
c0/8 |
0,00125 |
0,12999 |
0,35999 |
0,05199 |
0,06999 |
c0/16 |
0,000625 |
0,06799 |
0,17999 |
0,03599 |
0,03699 |
c0/32 |
0,0003125 |
0,03399 |
0,08899 |
0,02199 |
0,01999 |
Wartość przewodnictwa właściwego rozpuszczalnika jest tak mała, że do dalszych obliczeń wykorzystamy wartości bez odejmowania przewodnictwa właściwego rozpuszczalnika, gdyż nie ma to właściwie wpływu na wynik końcowy.
Wyliczenie danych potrzebnych do narysowania wykresu zależności przewodnictwa molowego od ![]()
|
Stężenie [mol/dm3] |
NaCl |
||
|
|
|
κ |
Λ = κ/c |
c0 |
0,01 |
0,1000 |
1,090 |
109 |
c0/2 |
0,005 |
0,0707 |
0,570 |
114 |
c0/4 |
0,0025 |
0,0500 |
0,270 |
108 |
c0/8 |
0,00125 |
0,0354 |
0,130 |
104 |
c0/16 |
0,000625 |
0,0250 |
0,068 |
108,8 |
c0/32 |
0,0003125 |
0,0177 |
0,034 |
108,8 |
|
Stężenie [mol/dm3] |
HCl |
||
|
|
|
κ |
Λ = κ/c |
c0 |
0,01 |
0,1000 |
2,640 |
264 |
c0/2 |
0,005 |
0,0707 |
1,360 |
272 |
c0/4 |
0,0025 |
0,0500 |
0,700 |
280 |
c0/8 |
0,00125 |
0,0354 |
0,360 |
288 |
c0/16 |
0,000625 |
0,0250 |
0,187 |
299 |
c0/32 |
0,0003125 |
0,0177 |
0,099 |
317 |
|
Stężenie [mol/dm3] |
CH3COOH |
||
|
|
|
κ |
Λ = κ/c |
c0 |
0,01 |
0,1000 |
0,146 |
14,6 |
c0/2 |
0,005 |
0,0707 |
0,109 |
21,8 |
c0/4 |
0,0025 |
0,0500 |
0,075 |
30 |
c0/8 |
0,00125 |
0,0354 |
0,052 |
41,6 |
c0/16 |
0,000625 |
0,0250 |
0,036 |
57,6 |
c0/32 |
0,0003125 |
0,0177 |
0,022 |
70,4 |
|
Stężenie [mol/dm3] |
CH3COONa |
||
|
|
|
κ |
Λ = κ/c |
c0 |
0,01 |
0,1000 |
0,592 |
59,2 |
c0/2 |
0,005 |
0,0707 |
0,291 |
58,2 |
c0/4 |
0,0025 |
0,0500 |
0,135 |
54 |
c0/8 |
0,00125 |
0,0354 |
0,070 |
56 |
c0/16 |
0,000625 |
0,0250 |
0,037 |
59,2 |
c0/32 |
0,0003125 |
0,0177 |
0,020 |
64 |
Obliczenie granicznego przewodnictwa molowego dla kwasu octowego.
Wartości granicznych przewodnictw molowych odczytane z wykresów:
![]()
![]()
![]()
![]()
![]()
= 378 ![]()
Obliczenie stopnia i stałej dysocjacji dla kwasu octowego:
![]()
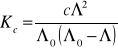
|
Stężenie [mol/dm3] |
CH3COOH |
||||
|
|
|
κ |
Λ |
α |
K |
C0 |
0,01 |
0,1000 |
0,146 |
14,6 |
0,0386 |
1,55178E-5 |
C0/2 |
0,005 |
0,0707 |
0,109 |
21,8 |
0,0577 |
1,76481E-5 |
C0/4 |
0,0025 |
0,0500 |
0,075 |
30,0 |
0,0794 |
1,71045E-5 |
C0/8 |
0,00125 |
0,0354 |
0,052 |
41,6 |
0,1101 |
1,70117E-5 |
C0/16 |
0,000625 |
0,0250 |
0,036 |
57,6 |
0,1524 |
1,71215E-5 |
C0/32 |
0,0003125 |
0,0177 |
0,022 |
70,4 |
0,1862 |
1,33204E-5 |
Średnia dla KCH3COOH = ![]()
Wartości tablicowe dla
KCH3COOH = ![]()
5. Wnioski
Otrzymane wyniki pomiarów oraz ich zestawienie na wykresie potwierdza fakt, iż przewodnictwo równoważnikowe rośnie wraz z rozcieńczeniem roztworu. Różnice pomiędzy wartościami tablicowymi, a doświadczalnymi mogą wynikać z warunków w jakich dokonywano pomiarów (naczynia mogły być zanieczyszczone, konduktometr niedokładnie opłukany itp.). Ćwiczenie pozwoliło na bezpośrednią obserwację zmiany przewodnictwa w zależności od stężenia elektrolitu.
Wyszukiwarka
Podobne podstrony:
Przewodnik metodyczny dla nauczyciela, grupa wiekowa 5,6 latki, zajecia wakacyjne
Grupa rowiesnicza kurs przewodnikowski
Wpływ AUN na przewód pokarmowy
3 Przewodnictwo elektryczne
Patologia przewodu pokarmowego CM UMK 2009
Wpływ stresu na motorykę przewodu pokarmowego ready
Krwawienie z przewodu pokarmowego lub zagrażające powikłania oraz dyskomfort pacjenta w zakresie hig
przewoz drogowy po nowelizacji adr
przewodnictwo synapsy
Choroby przewodu pokarmowego
Budowa przewodu pokarmowego
10 Przewody i kable
10 Patofizjologia przewodu pokarmowego
Choroby przewodu pokarmowego 4
więcej podobnych podstron