16889 skan0047 (2)

50 Termodynamika chemiczna
Przykład 3.1. Współczynniki wirialnego równania stanu (2.25) argonu w 273 K wynoszą: B = -21,7 cm3 • mor1 i C = 1200 cm6 • mol-2. Obliczyć pracę izotermicznego rozprężania 1 mola argonu w tej temperaturze od objętości 500 cm3 do objętości 1000 cm3: a) w sposób odwracalny, b) w sposób nieodwracalny, przeciwko stałemu ciśnieniu równemu ciśnieniu końcowemu w przemianie odwracalnej, c) w sposób odwTacalny przy założeniu, iż argon zachowuje się jak gaz idealny.
Rozwiązanie, a) Zgodnie z równaniem (2.25) mamy PV=nRT(1 +y+£),
skąd
( 1 B C \ „ ,
P = ^[T+~(2.25a)
Wyrażenie to wstawiamy do równania (3.3), otrzymując
I 1 B C \
Ki = -pdV = -nRT(y + +
Po jego scałkowaniu otrzymujemy
W = -nRT


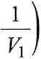
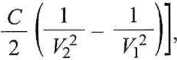
(3.3a)
a wstawiając wartości liczbowe mamy
W= -1-8,314 -273-
ln
1000
500
+ 21,7
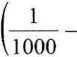
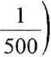
1200 /_1_
2 llOOO2

-1528,1 J.
Na ry's. 3.1 pokazano strzałką wzdłuż izotermy przebieg odwracalnej przemiany izotermicznej od stanu 1 do stanu 2. Miarą pracy, wykonanej przez układ, jest pole Vrl-2-V2.
b) Podczas izotermicznej przemiany 1-2 przeciwko stałemu ciśnieniu układ wykonuje pracę
W=-p7XV2-Vx\ (3.3b)
gdzie p7 jest ciśnieniem zewnętrznym, równym ciśnieniu gazu w 273 K dla V2 = 1 • 10-3 m3. Aby je obliczyć, skorzystamy z (2.25a)
nRT B
|l ^---h ->
V V2
V
C\ 1-8,314-273
1 • 10“3
1-
21,7 1200 \
1000 + 10002/
= 22,23-105 Pa.
Wyszukiwarka
Podobne podstrony:
skan0063 (2) 66 Termodynamika chemiczna Przykład 3.11. Obliczyć entalpię parowania toluenu w 25°C, k
skan0099 102 Termodynamika chemiczna na podstawie standardowych entalpii tworzenia
64780 skan0066 (2) Termodynamika chemiczna 69 puje powrót do stanu początkowego poprzez rozprężanie
74354 skan0089 92 Termodynamika chemiczna Tabela
skan0053 (2) 56 Termodynamika chemiczna W tab. 3.2 zestawiono wyrażenia, za których pomocą możemy ob
skan0055 58 Termodynamika chemiczna a) Z równania stanu (2.9) obliczamy ciśnienie
skan0057 60 Termodynamika chemiczna zbiorach symbol AH298 oznaczał standardową wartość entalpii twor
skan0059 (2) 62 Termodynamika chemiczna Tak oszacowana wartość AH298 ciekłej gliceryny w niewielkim
skan0061 64 Termodynamika chemiczna zostanie zużyte w całości na ogrzanie produktów tej reakcji do t
skan0079 (2) 82 Termodynamika chemiczna Ciepło reakcji w T= 323,15 K możemy obliczyć z prawa Kirchho
skan0091 (2) 94 Termodynamika chemiczna wynosi AG?9S = żfG$98(NH3) + 4GS98(HC1) - ^G198(NH4C1) = = -
skan0093 (2) 96 Termodynamika chemiczna Po podstawieniu AHj- do relacji Van’t Hoffa (3.85) i scałkow
więcej podobnych podstron