35665 skan0173 (2)

176 Roztwory i równowagi fazowe
Pionowa linia g-f przy w = 44,09%, kończąca się w 32,38°C oznacza sól glauberską. Gotowy wykres, z naniesionymi krzywymi rozpuszczalności, łączącymi punkty E i P oraz P i W, pokazano na rys. 4.26. Widoczne na nim 8 obszarów fazowych zostało opisane w tab. 4.14.
Tabela 4.14
|
Obszar |
P |
Fazy w równowadze |
|
1 |
2 |
lód + sól glauberska |
|
2 |
2 |
lód + roztwór nasycony Na2S04 |
|
3 |
2 |
roztwór nasycony + sól glauberska |
|
4 |
1 |
roztwór nienasycony Na2S04 |
|
5 |
2 |
para wodna + roztwór nasycony Na2S04 |
|
6 |
2 |
para wodna + Na2S04 (rombowy) |
|
7 |
2 |
roztwór nasycony + Na2S04 (rombowy) |
|
8 |
? |
sól glauberska + Na2S04 (rombowy) |
Układ ma 3 punkty potrójne: eutektyczny E, perytektyczny P i wrzenia W. Z przebiegu łączących je linii wynika, że cząstkowe(7) ciepło rozpuszczania Na2S04 • 10H2O będzie dodatnie, natomiast dla bezwodnego siarczanu sodu jest ono ujemne (reguła przekory).
b) Układ złożony z 35% Na2S04 i 65% H20, w temperaturze 60°C, przedstawia na rys. 4.26 punkt b. Leży on w obszarze 7 (dwufazowym), gdzie w równowadze ze stałym Na2S04 (punkt c) znajduje się roztwór nasycony (punkt a), zawierający 31,18% siarczanu. Z reguły dźwigni (4.45) możemy obliczyć masę roztworu ma oraz masę nie rozpuszczonej soli bezwodnej mc. Ponieważ masa całkowita układu m wynosi 100 g, wdęc
ma = m
c - b c - a
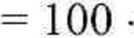
100-35
100-31,18
94,45 g.
Stąd mc = 5,55 g, tak więc reszta z 35 g Na2S04, czyli 29,45 g znajduje się w roztworze a.
c) Zgodnie z regułą faz dw>uskładnikowy układ wr obszarze 2-fazowym - ma tylko jeden stopień swobody. Podczas obniżania temperatury układu b skład roztworu zmienia się wzdłuż linii a-P (rys. 4.26). Wzrasta rozpuszczalność, toteż część kryształków soli ulegnie rozpuszczeniu. W momencie osiągnięcia temperatury perytcktycznej układ znajdzie się w punkcie //, a masa kryształków mh wyniesie
(n Zgodnie z definicją (4.26) cząstkowe ciepło rozpuszczania Na2S04 dla roztworu nasyconego jest ciepłem wymienionym z otoczeniem, gdy siarczan sodu rozpuszcza się w roztworze prawie nasyconym, z utworzeniem roztworu nasyconego.
Wyszukiwarka
Podobne podstrony:
skan0173 (2) 176 Roztwory i równowagi fazowe Pionowa linia g-f przy w = 44,09%, kończąca się w 32,38
skan0137 140 Roztwory i równowagi fazowe Równanie (4.24) jest nazywane prawem Van’t Hoffa. Dla roztw
skan0155 158 Roztwory i równowagi fazowe Po podstawieniu odpowiednich wartości z tab. 4.9 dostaniemy
skan0167 170 Roztwory i równowagi fazowe Rys. 4.20. Równowaga w układzie dwuskładnikowym, ciało stał
skan0171 (2) 174 Roztwory i równowagi fazowe Przykład 4.16. W tab. 4.12 zestawiono dla ciśnienia 760
skan0195 198 Roztwory i równowagi fazowe Temperatury wrzenia benzenu i toluenu pod ciśnieniem 400 mm
12851 skan0127 130 Roztwory i równowagi fazowe wego w wodzie c i ksylenie c" wynosiły odpowiedn
skan0125 128 Roztwory i równowagi fazowe Zatem 0,343 0,343 + 5,11 0,0629; x} = 1 -x2 = 0,937. c) Stę
skan0133 136 Roztwory i równowagi fazowe Temperatura krzepnięcia roztworu Tk, zawierającego nielotną
skan0135 138 Roztwory i równowagi fazowe Rozwiązanie. Do obliczeń y2 wykorzystamy wzór (4.20) 0- 1 m
skan0139 142 Roztwory i równowagi fazoweym = Y n + n2 - X] Yy + x2Y2. (4.28) Różniczkując (4.27) otr
skan0177 180 Roztwory i równowagi fazowe Hz0 (0) % wagowe N
skan0181 184 Roztwory i równowagi fazowe 4c:l. W 25°C prężność pary wodnej wynosi 23,76 mm Hg. Oblic
skan0183 186 Roztwory i równowagi fazowe 4d:3. Obliczyć stężenie roztworu glukozy izotonicznego z ro
47266 skan0165 (2) 168 Roztwory i równowagi fazowe Można stąd określić graficznie bądź obliczyć z ró
więcej podobnych podstron