414 [1024x768]

NIEKTÓRE RÓWNOWAGI W ROZTWORACH ELEKTROLITÓW 423
Punkt
RÓWNOWAŹNIKO-
W punkcie równoważnikowym mamy a = b i układ jest równoważny roztworowi soli słabego kwasu i mocnej zasady, sól ta hydrolizuje dając (H4) równe:
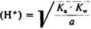
gdzie Km jest iloczynem jonowym wody.
Przykłady takich krzywych przedstawiono na rys. 5.19.
Elektrolity amfoteryczne — amfolity
Przez elektrolity amfoteryczne rozumiemy substancje mogące wykazywać wlaści- AMrourY wości zarówno kwasowe jak i zasadowe; należą tu woda, alkohole, rozpuszczalniki amfiprotonowe lub niektóre wodorotlenki metali jak np. Al(OH)3. Właściwości amfoteryczne tych związków zależą na ogół od jednej grupy wodorotlenowej — OH, która w zależności od warunków może zachowywać się jak grupa kwasowa lub zasadowa.
Tutaj zajmować będziemy się jednak tylko takimi amfolitami, które grupę kwasową i zasadową mają w jednej cząsteczce. Najważniejszym typem takich amfolitów są aminokwasy NH2RC02H. Początkowo przyjmowano, że aminokwasy w stanie obojętnym mają budowę przedstawioną powyższym wzorem i przyjmowano, że dodatek kwasu prowadzi do zobojętnienia grupy aminowej — NH2:
NHjRCOOH + H4 ę* 4NH3RCOOH
zaś mocna zasada miała jakoby reagować z grupą karboksylową -COOH: NHjRCOOH + OH" ^ NH2RCOO‘ + H20
Późniejsze badania wykazały, że roztwór aminokwasu oprócz niewielkiej ilości cząsteczek NH2RCOOH zawiera przeważnie jony dwubiegunowe (om- amfuony fijony), typu *NH3RCOO". Jony takie są oczywiście elektrycznie obojętne, jednakże mechanizm ich reakcji z kwasami i zasadami jest inny, aniżeli przyjmowano to poprzednio. Dodatek kwasu do glicyny składającej się w roztworze przeważnie z jonów +NH3CH2COO", prowadzi do reakcji:
♦nh3ch2coo- + H* = *NH3CH2COOH
zaś dodatek zasady do reakcji:
♦NH3CH2COO- -t- OH- = NH2CH2COO- + h2o
Wyszukiwarka
Podobne podstrony:
395 [1024x768] Niektóre równowagi w roztworach elektrolitówRównowagi dysocjacji Dysocjację prostych
396 [1024x768] NIEKTÓRE RÓWNOWAGI W ROZTWORACH ELEKTROLITÓW 405 « 10" 5. W tym przypadku można
402 [1024x768] NIEKTÓRE RÓWNOWAGI W ROZTWORACH ELEKTROLITÓW (OH-)-
406 [1024x768] NIEKTÓRE RÓWNOWAGI W ROZTWORACH ELEKTROLITÓW 41$ Tabela 5.8 Skład typowych roztworów
408 [1024x768] NIEKTÓRE RÓWNOWAGI W ROZTWORACH ELEKTROLITÓW 417 Przypomnimy wpierw krótko równania n
410 [1024x768] NIEKTÓRE RÓWNOWAGI W ROZTWORACH ELEKTROLITÓW zatem stopień hydrolizy równa się: (5.17
412 [1024x768] niektóre równowagi w roztworach elektrolitów zaś z warunku elektroobojętności wynika,
418 [1024x768] NIEKTÓRE RÓWNOWAGI W ROZTWORACH ELEKTROLITÓW 427
308 [1024x768] 317 WŁAŚCIWOŚCI ROZTWORÓW ELEKTROLITÓW Tabela 5.1 Przewodnictwa równoważnikowe wodnyc
400 [1024x768] NIEKTÓRE RÓWNOWAGI W ROZTWORACH Et.EKTROUJeżeli w miejsce aktywności kwasu i zasady (
346 [1024x768] TEORIA PRZEWODNICTWA ROZTWORÓW ELEKTROLITÓW 355 wykonuje tylko bardzo niewielkie drga
398 [1024x768] 407 NIEKTÓRE RÓWNOWAGI W ROZTWORACH ELEKTROLITÓWRównowagi kwasowo-zasadowe Istnieją d
404 [1024x768] 413 NIEKTÓRE RÓWNOWAGI W ROZTWORACH ELEKTROLITÓW Z równań tych wynika, ic przy długoś
416 [1024x768] 425 NIEKTÓRE RÓWNOWAGI W ROZTWORACH ELEKTROLITÓW Stałe dysocjacji aminokwasów Oznaczm
więcej podobnych podstron