DSC00155 (24)
Wykonanie
Do 6 probówek odmierzyć po około 1 cm3: do 1 - glicyny, do 2 -cysteiny, do 3 - proliny, do 4 - roztworu białka, do 5 - żelatyny, a do 6 - roztworu badanego. Następnie do każdej probówki dodać po około 1 cm3 roztworu ninhydryny i ogrzewać przez 1 minutę we wrzącej łaźni wodnej. Obserwować zabarwienie.
1.2. Reakacja biuretowa
Reakcja służy do identyfikacji wiązania peptydowego. Jest pozytywna już dla tripeptydów, nie dają jej aminokwsy i dipeptydy. Białka tworzą kompleksy z miedzią, natomiast aminokwasy,z miedzią wytwarzają kompleksy chelatowe.
Produkty reakcji peptydów z siarczanem miedzi w środowisku zasadowym dają barwę różową, białka - fioletowoczerwoną lub fioletowo-niebieską, a aminokwasy-jasnoniebieską.
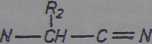
11 ł I
C-0 0 CH—/?,
I \ / I 5
—CH .Cu. C—0~
! U II
-N
-OOC-HĆ'
ł
R
Wykonanie
Do 4 probówek odmierzyć po około 1 cm3: do 1 - glicyny, do 2 -roztworu białka jaja, do 3 - żelatyny, do 4 - roztworu badanego. Do każdej probówki dodać po 2 cm3_20% NaOH i po 1 kropli 0,5 cm3 roztworu CuS04. Obserwować zabarwienie.
1.3. Reakcja z fluorodinitrobenzenem (FDNB)
Odczynnik Sangera, czyli 1-fluoro-2,4—dinitrobenzen (FDNB), łączy się w środowisku zasadowym z grupą a- aminową aminokwasów, peptydów i białek. W wyniku reakcji otrzymujemy pochodne aminokwasów (DNP-aminokwasy).
Rozdziału DNP-aminokwasów można dokonać chromatograficznie. Reakcja ta służy również do oznaczania N-końcowych aminokwasów w białkach.
Wykonanie
Do 4 probówek odmierzyć po 1cm3: do 1- glicyny, do 2 - białka jaja kurzego, do 3 - żelatyny, do 4 - roztworu badanego. Następnie zawartość probówek zalkalizować do pH 84-9. Kontrolę pH przeprowadzić papierkiem wskaźnikowym. Do każdej probówki dodać po 0,2 cm3 fluorodinitrobenzenu, zamieszać i wstawić na 10 minut do łaźni o temperaturze 40°C. Obserwować zabarwienie.
R H
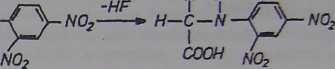
DNP - aminokwas
H-C-NH2 * F-COOH
2. Reakcje charakterystyczne aminokwasów
2.1. Reakcje aminokwasów aromatycznych V

2.7.7. Keakcja ksantoproteinowa
Aminokwasy z pierścieniem aromatycznym wolne, jak i związane w białkach, ogrzewane ze stężonym kwasem azotowym, dają żółte zabarwienie, a po alkalizacji - pomarańczowe. W tej reakcji nitrowaniu ulega tyrozyna i tryptofan. Nitrowanie fenyloalaniny zachodzi pod wpływem mieszaniny nitrującej (HN03+ H2S04).
HOOC-CH-ChL\ ~ HOOC—CH—C NO,
l AA _____S i I - ____
NH,
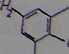
NO,
* 2HN03-- /l/u
OH
•2H,0
tyrozyna
żółto zabarwiona pochodna nitrowa tyrozyny
149
Wyszukiwarka
Podobne podstrony:
DSC00233 (19) Wykonanie £Do 4 probówek odmierzyć po 1 cm3: do 1 - glukozy, do 2 -sacharozy^, do 3 -
DSC00163 (29) Wykonanie li * -cti. r^.^Do 4 probówek odmierzyć po 1 cm3: do 1 i gl
DSC00156 (25) Wykonanie Do 4 probówek wlać po 1 cm3: do 1 - żelatyny, do 2 1 białka, do 3 - tryptofa
DSC00164 (22) Wykonanie Do 4 probówek wlewa się po 2 cm3: do 1 - rybozy, do 2 -arabinozy, do 3 - glu
Oznaczanie aktywności fosfatazy kwaśne). Do dwóch probówek odmierzyć po 1 mi 4-nitrofenylofosforanu
testy, zielone str 77 23. Do trzech probówek zawierających po ok. 1 cm3 wody bromowej dodano (kolejn
DSC00106 (24) 27. Do Diblastica nie należa: al gąbki, b/ stułbiopławy, c/ wirki, d
Egzamin maturalny z chemii Arkusz IIZadanie 30. (2 pkt) Do czterech probówek wlano po kilka cm3 wody
img245 112 Sposób wykonania oznaczenia - W dwóch probówkach umieścić po 10 cm3 wod
24 (517) Zawartość probówek wymieszać, po 5 minutach zmierzyć absor-bancję próby badanej i wzorcowej
chemia zywnosci 20 Wybrane zagadnienia z chemii żywności Wykonanie oznaczenia W kolbach przygotować
CCF20081011�014 (2) Do 3 probówek wirówkowych odmierzyć po 1 cmJ roztworu Taka-diastazy, do pierwsze
DSC00162 (25) Następnie do wszystkich probówek dodaje się po 1 cm3 mleka i miesza zawartość probówek
DSC00169 (22) hydrolizie.^ W probówce z wolnym kwasem tłuszczowym następuje odbarwienie roztworu. Wy
img102 (22) Rozpuszczalność tłuszczu w rozpuszczalnikach Do 4 probówek odmierzyć kolejno po 2 cm3 wo
więcej podobnych podstron