DSCN6187 (Kopiowanie)
172 Białonia - rypcn torium dla kandydatów aa akademie
Inhibitorami enzymów jest większość trucizn, np. duszące gazy bojowe, a także kurant (z*^ te blokują enzym acctylócholinoestcrazę w synapsach nerwowych).


OH
c—o 'ot
fot
fc
r
i-o
OH
kwas bursztynowy kwasmalono/iy
Ryc. 5 - 9. Blokowanie enzymu przez inhibitor; Ryc. 5 - 10. Struktura kwasu bursztynowego i c.a. - centrum aktywne enzymu: li - enzym; I - inhibitor malonowego
5.1.5. Inne czynniki wpływające na czynność enzymów
Większość czynników, które wpływają na metabolizm, oddziałuje nań właśnie poprzez reguł** czynności enzymów. Sprawie tej poświęcimy osobny podrozdział, już po omówieniu procesój metabolicznych, tu ograniczymy się do przedstawienia kilku determinant aktywności enzymatyczny Temperatura. W zasadzie wzrost temperatury przyspiesza reakcję (większa częstość i energia interakcji molekuł). Ta sama reakcja szybciej przebiega w temperaturze 309 K (36°C) niż w temperaturze 273 K (0°C). Szybkość reakcji podwaja się przy wzroście temperatury o każde 10 K. Temperaturę, w której procesy katalizowane przez enzymy zachodzą najszybciej, nazywam
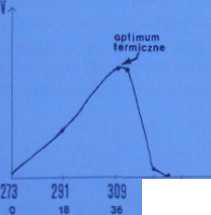
323 333°K I
Ryc. 5-11. Krzywa przebiegu reakcji rozkładu H;0, przez enzym katalizę wyizolowany z komórek wątroby ssaka (pH ■ 7,35). V - tempo reakcji; T - temperatura (JD).
optimum termicznym działania enzymu (ryc 5-11) Infcą w temperaturze 323-330 K większość enzymów traci aktywność: pod wpływem ciepła ich białko ulega denaturacji, czyli nieodwracalnej zmianie swojej struktury trzeciorzędowej. Denaturacja enzymów sprawia, że komórki nie są w stanie prowadzić procesów metabolicznych. Fakt ten tłumaczy nam. dlaczego w wysokiej temperaturze większość organizmów ginie. Od dawna zjawisko to wykorzystywane jest praktycznie podczas gotowania bądź pasteryzowania potraw, które nu na celu zabijanie drobnoustrojów. Jak zawsze w przyrodzie, są wyjątki od tej reguły. Na przykład niektóre sinice żyją w gorących źródłach w temperaturze osiągającej 373 K (Park Narodowy Yellowstone w USA). Pewne gatunki bakterii rozwijają się na dnie morza w pobliżu gorących źródeł o temperaturze wody do 370 K (prawie IOO°C). Odczyn. Podobnie jak optimum termiczne, dla każdego enzymu istnieje pewne optymalne pH Środowiska zbyt kwaśne lub zbyt zasadowe hamują reakcję. Na przykład pepsyna (enzym wydzielany przez komórki żołądka, trawiący białko) działa jedynie w środowisku kwaśnym (optymalne pH 2). Natomiast proteolityczny enzym trzustki trypsyna katalizuje reakcję w środowisku zasadowym, optymalnie przy pH 8,5. Większość enzymów dla optymalnego katalizowania reakcji wymaga środowiska obojętnego, zaś silne kwasy i zasady powodują ich denaturację.
Utrwalacze. Inhibitorami enzymów są również związki organiczne, np. alkohole (zwłaszcza metylowy i etylowy), aldehydy (np. formaldehyd, glutaraldehyd), a także sole metali ciężkich Substancje te powodują denaturację enzymów i wraz z kwasami, takimi jak kwas octowy cn k»»
pH • ujemny logatylm dziesiętny ze stężenia jonów wodorowych (protonów). Liczbowo wyraża się od 0 4) 1 U* - odczyn kwaśny (maleje); 7 - odczyn obojętny; K-14 odczyn zasadowy (narasta).
Wyszukiwarka
Podobne podstrony:
DSCN6102 (Kopiowanie) 88 88 Biologią - repetytorium dla kandydatów na akademie ntedyn^ przestrzenna
DSCN6165 (Kopiowanie) Białonia - repetytorium dla kandydatów aa akademie m. erytrocyt Ryc. 4 - 24. N
DSCN6113 (Kopiowanie) 98 98 I Biologia - repetytorium dla kandydata* Zgodnie z tą teorią, wzajemne o
DSCN6116 (Kopiowanie) Biologia - repetytorium dla kandydatów na akademie Związek chemiczny jest to j
DSCN6147 (Kopiowanie) 130_ — ■ - rtrfH-t Vtar mm dla kan
DSCN6151 (Kopiowanie) 134 Biologia - repet) ytorium dla kandydatów na akadenu edycfr. tu cnzvmv L,Uk
DSCN6187 (Kopiowanie) 172 nialngia - repetytorium dla katulydiitów na akademie ■mm- Inhibitorami enz
DSCN6078 (Kopiowanie) 66 66 Btotogb repetytorium dla kandydahw na akademie medyaat pajęczakiem, klóf
DSCN6205 (Kopiowanie) 188 Biologia - rr/fctylorium dla kandydatów na akademi0 mv,iv< 188 glikogon
DSCN6327 (Kopiowanie) Biologio * repetytorium dla kandydatów aa akademie Typ nomen fclatoryczny to t
DSCN6407 (Kopiowanie) 114 Biologia - repetytorium dla kandydatów aa akademie wafafl (piamiazyal. będ
DSCN6455 (Kopiowanie) 162 Biologia ■ repetytorium dla kandydatów na akademie matyaii widzenia jest j
DSCN6506 (Kopiowanie) 216 Biologia - repetytorium dla kandydatów aa akademie medyczną mięśni (lyc. 7
DSCN6100 (Kopiowanie) Biologią . repetytorium dla kandydatów na akademie medto Biologią . repetytori
DSCN6100 (Kopiowanie) ■ —---- --- Biologia - repetytorium dla kandydatów na akadem
DSCN6102 (Kopiowanie) Biologia - repetytorium dla kandydatów na akademie medycy przestrzenna (antyge
DSCN6104 (Kopiowanie) Biologia - repetytorium dla kandydatów na akademie Oba tc stwierdzenia porusza
DSCN6104 (Kopiowanie) — _ Biologia - repetytorium dla kandydatów na akademie medyr
DSCN6113 (Kopiowanie) 1 Biologia - repetytorium dla kandydatów na akademie medy^ Zgodnie Z tą teorią
więcej podobnych podstron