5. Wyznaczanie zmiany entalpii układu
Zakres zagadnień: pojęcie entalpii (definicja, wzór, jednostka), I zasada termodynamiki, procesy izobaryczne, izochoryczne, izotermiczne i adiabatyczne; reakcje egzo- i endotermiczne, pojęcie funkcji stanu oraz wszystkie zagadnienia, wzory, wielkości fizyczne ich jednostki występujące w instrukcji.
Celem ćwiczenia jest wyznaczenie zmiany entalpii układu, w którym następuje rozpuszczanie ciała stałego w cieczy. Proces ten można uznać za izobaryczny. Należy zwrócić uwagę na to, że ciepło Q, jakie jest pobierane lub oddawane przez układ, zależy od temperatury, w jakiej zachodzi proces oraz od stężenia roztworu. Mamy zatem: i qi, gdzie i - jest liczbą całkowitą określającą kolejną porcję ciepła. Suma tych cząstkowych zmian jest całkowitą zmianą entalpii rozpatrywanego procesu:
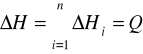
,
gdzie n - jest liczbą całkowitą równą liczbie porcji ciała rozpuszczonego.
Jeśli badany układ składa się z rozpuszczalnika, substancji rozpuszczanej i termosu, to cząstkowe zmiany entalpii można obliczyć ze wzoru:
![]()
gdzie:
mw - masa rozpuszczalnika, mi - masa i-tej porcji ciała rozpuszczanego,
cri - ciepło właściwe roztworu, pk - pojemność cieplna termosu,
Tki - temperatura końcowa roztworu, Tpi - temperatura początkowa roztworu.
Ciepło właściwe roztworu cri zależy od stężenia procentowego ki badanego roztworu określonego wzorem:
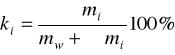
.
1. Przebieg czynności:
Odważyć 5 porcji substancji badanej po 5 g każda.
Wlać do termosu wodę w ilości 400 ml.
Zmierzyć temperaturę początkową wody.
Wsypać do termosu 1 porcję odważonej substancji i po rozpuszczeniu jej w wodzie, zmierzyć temperaturę mieszaniny.
Rozpuszczając kolejno pozostałe porcje przygotowanej substancji, zmierzyć każdorazowo temperaturę roztworu Tki po całkowitym rozpuszczeniu substancji. Temperatura końcowa Tki po rozpuszczeniu się wsypanej i - tej porcji substancji jest jednocześnie temperaturą początkową Tpi+1 procesu rozpuszczania się następnej porcji.
Każda z osób biorących udział w doświadczeniu ma je przeprowadzić dla jednej z badanych substancji.
Przykładowa tabela wyników:
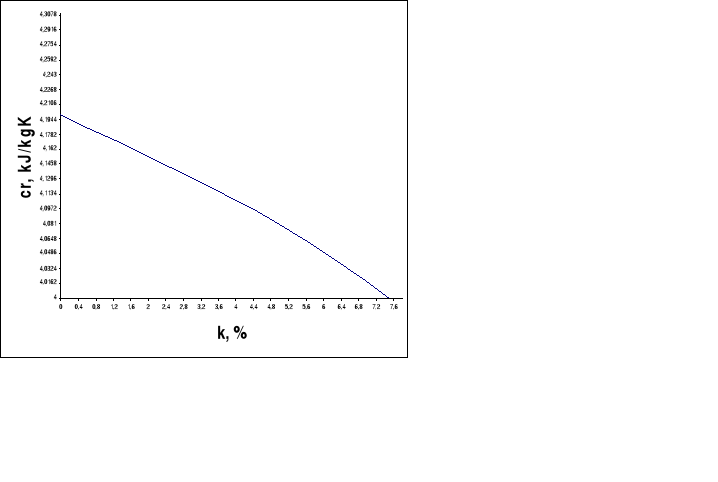
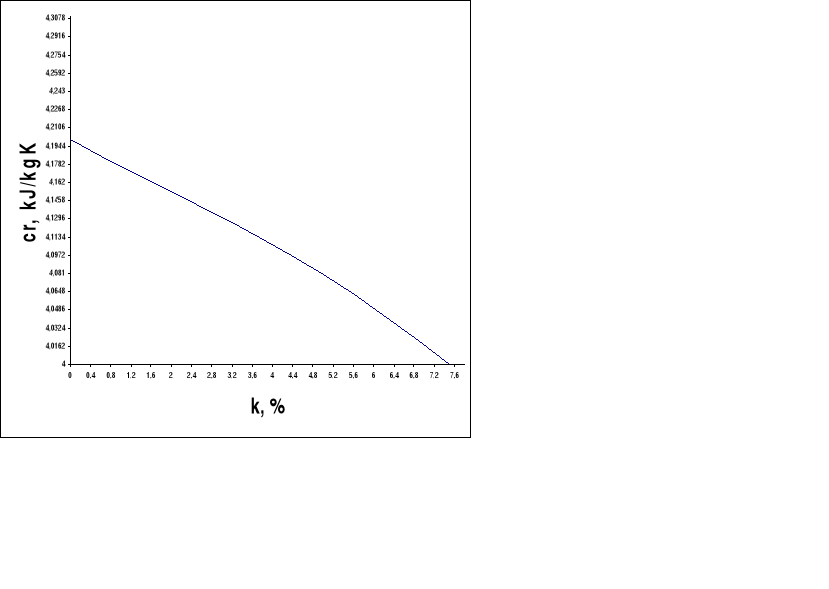
Oblicz cząstkowe zmiany entalpii układu Hi. Wartość ciepła właściwego roztworu cri należy odczytać z wykresu. Wartość stężeń ki obliczamy ze wzoru.
Oblicz całkowitą zmianę entalpii układu H.
Obliczyć błąd końcowy H metodą różniczki zupełnej.
Obliczyć wartości średnie i odchylenia standardowe dla pomiaru masy substancji oraz przeprowadź dyskusję błędów.
l.p. |
mi, g |
mi, kg |
Tpi, oC |
Tpi, K |
Tki,oC |
Tki, K |
wielkości stałe |
||||
1. |
|
|
|
|
|
|
pojemność cieplna termosu, pk [J/K] |
280 |
|||
2. |
|
|
|
|
|
|
błędy systematyczne pomiaru |
||||
3. |
|
|
|
|
|
|
mi |
|
kg |
||
4. |
|
|
|
|
|
|
T |
|
K |
||
5. |
|
|
|
|
|
|
V |
|
m3 |
||
|
|
|
|
|
|
|
objętość wody |
400 ml |
m3 |
||
|
Σ = |
Σ = |
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
||
5. Przedstaw graficznie zależność temperatury roztworu od jego stężenia: T = f(k) dla wszystkich badanych substancji.
Wyszukiwarka
Podobne podstrony:
biznesplan - opracowanie teoretyczne, biznesplan
Bibliografia opracowań teoretycznoliterackich
cw6 cw7, OPRACOWANIE TEORETYCZNE
cw6 cw7, OPRACOWANIE TEORETYCZNE
Multicast Routing opracowanie teoretyczne i przyk
32 Stirling opracowanie teoretyczne
cw3 cw4 cw1, OPRACOWANIE TEORETYCZNE
równowaga kwasowo zasadowa, Opracowanie teoretyczne RKZ, RÓWNOWAGA KWASOWO-ZASADOWA
biznesplan - opracowanie teoretyczne, biznesplan
24. Wyka 3, Filologia Polska, Teoria literatury, TEORIA LITERATURY - OPRACOWANIE KONKRETNYCH TEKSTÓW
Dziedziny wychowania, opracowane tematy na teoretyczne podstawy wychowania
TEORETYCZNE PODSTAWY FILOZOFII I ETYKI OPRACOWANE
cw5-adsorpcja, OPR wyn, OPRACOWANIE WYNIKÓW
Temat 4 różne koncepcje pedagogiczne, opracowane tematy na teoretyczne podstawy wychowania
48. Balcerzan, Filologia Polska, Teoria literatury, TEORIA LITERATURY - OPRACOWANIE KONKRETNYCH TEKS
opracowanie kolokwium ksztalcenie, Teoretyczne podstawy kształcenia
więcej podobnych podstron