
1
1
Zamiast wstępu ...
Trochę informacji ogólnych
2
CHEMIA (Podstawy chemii)
Wykładowca:
Prof. dr hab. Stanisław Komornicki
A-0, III p. 305 (na razie), tel (12) (617) 24-88
E-mail:
komornik@agh.edu.pl
Maile czytam prawie zawsze rano, czasem wieczorem,
odpowiadam zwykle nie później niż następnego dnia
Strona www:
http://galaxy.uci.agh.edu.pl/~komornik/
konsultacje – poniedziałek 8,45 – 10, a także e-mailem
3
Podstawy chemii (2)
Wykład – 3 godz./tydzień – poniedziałek 12,15 – 14,30
Ć
wiczenia 4 godz./tydzień – 2 x w tygodniu
– na początku Elementy chemii (15 godz. chemii –
pierwsze 4 tygodnie zajęć)
– ćwiczenia rachunkowe (45 godzin)
Egzamin pisemny na końcu semestru – ze wszystkiego
– czyli z wykładów i ćwiczeń!
Ocena końcowa przedmiotu = 0,4•OC + 0,6•OE
Chemia ma charakter przedmiotu selekcyjnego, co
oznacza, że jego zaliczenie warunkuje dalsze studia.
Jest też wiele kolejnych przedmiotów, do których
Chemia – Podstawy chemii są niezbędne ...
Szczegóły na stronie
http://syllabuskrk.agh.edu.pl/pl
i
podstronie WIMiC/Technologia Chemiczna
4
Podstawy chemii (3)
Do czego służą wykłady i jak się zdaje egzamin ?
Program wykładów i ćwiczeń odpowiada dokładnie
zawartości egzaminu, a to, co jest w podręcznikach
niekoniecznie (zwykle jest dużo więcej).
Egzamin jest pisemny, ale jeszcze nie wiem jaki ...
raczej nie będzie to test ...
ż
eby do niego przystąpić, trzeba zaliczyć ćwiczenia
(trzy szanse – praca w semestrze i dwa kolokwia
zaliczeniowe)
każdy ma prawo zdawać egzamin trzykrotnie, ale brak
zaliczenia w terminie egzaminu powoduje jego utratę
(patrz Regulamin Studiów)
5
Podstawy chemii (4)
Czy można „dać sobie radę” jeśli się „nic nie
pamięta” z chemii ?
Odpowiedź brzmi „tak, ale ...”
zaczynamy „prawie od zera” i na wykładzie i na
„elementach”
solidna praca pozwala uzyskać zaliczenie w pierwszym
terminie i zdać całkiem nieźle egzamin
Po zakończeniu semestru argument „miałem
zaległości z chemii, bo jej się nigdy nie uczyłem”
nie będzie brany pod uwagę ...
6
Najważniejsze
podręczniki
* A.Bielański -
Chemia ogólna i nieorganiczna
* A.Bielański -
Podstawy chemii nieorganicznej
* F.A.Cotton, G. Wilkinson, P.L.Gaus -
Chemia
nieorganiczna. Podstawy.
* J.D.Lee -
Zwięzła chemia nieorganiczna
* P.A. Cox –
Chemia nieorganiczna. Krótkie wykłady
* dla bardziej ambitnych:
* R.G.Wells -
Strukturalna chemia nieorganiczna
* L. Jones, P. Atkins –
Chemia ogólna
* Wszelkie inne podręczniki mające w nazwie – chemia
ogólna, chemia fizyczna lub chemia nieorganiczna
.... ale cytaty w czasie wykładów pochodzą tylko z trzech
książek, których na liście brak ...

2
Moje cytaty
7
8
Wykłady i prezentacje
* Prezentacje z wykładów, podobnie, jak same
wykłady mają charakter autorski;
* Co oznacza, że chcąc je zobaczyć wraz ze
wszystkimi animacjami i koniecznym
komentarzem, trzeba uczestniczyć w wykładach;
* Zawartość wykładów podlega corocznej
modyfikacji;
* Być może, część materiałów będzie udostępniona na
mojej stronie;
* Małe ostrzeżenie – osoby, które uważają, że
ś
wietnie opanowały chemię w szkole średniej, a
nawet zdawały ją na maturze i to w trybie
rozszerzonym, nie powinny spocząć na laurach ...
bo w styczniu będzie trochę za późno ...
9
Prezentacje z wykładów
* Jeśli nie zostało to inaczej określone, źródłem
sporej części ilustracji jest Wikipedia – w innych
przypadkach, zgodnie z obyczajami, cytuję
ź
ródła;
* Zdarzają się również ilustracje mojego autorstwa;
* Wykłady nie są obowiązkowe – choć czasami
sprawdzam obecność – ale od ich uczestników
oczekuję pewnej dyscypliny – czyli np.
powstrzywania się od używania telefonów
komórkowych, rozmów, jedzenia i picia, itp.;
* Jestem natomiast otwarty na pytania – także w
czasie trwania wykładu i zwracanie uwagi na
błędy w prezentacjach (ciągle się zdarzają !)
10
A teraz do rzeczy ...
Czas na trochę prawdziwej chemii
11
Chemia jest nauką przyrodniczą
• Definicja:
– Chemia jest nauką, która zajmuje się składem,
strukturą i właściwościami substancji oraz reakcjami, w
których jedna substancja zmienia się w inną
• Zasady nowoczesnej chemii:
– poszukiwanie prawidłowości w zachowaniu się różnych
substancji;
– poszukiwanie modeli, które tłumaczą obserwacje;
– modele powinny tłumaczyć zachowanie innych
substancji i jeśli to możliwe obejmować relacje
ilościowe;
(cytat)
– modele powinny dać się weryfikować doświadczalnie
(relacje ilościowe prowadzą do wniosków jakościowych)
.
12
Jednostki miar w układzie SI
Wielkość
Symbol
Jednostka
Masa
m
kg (g)
Długość
l
m
(powierzchnia
S
[
m
2
],
objętość
V
[
m
3
])
Czas
t
s
Prąd elektryczny
I
A
Temperatura
T
K
Ilość materii
n
mol
Natężenie światła
I
v
cd

3
13
Inne jednostki (pochodne)
Energia
J
kg m
2
s
-2
Częstość
Hz
s
-1
Siła
N
kg m s
-2
Ciśnienie
Pa
kg m
-1
s
-2
Ładunek elektryczny
C
A s
Pojemność elektryczna
F
A
2
s
4
kg
-1
m
-2
Potencjał elektryczny
V
kg m
2
s
-3
A
-1
Opór elektryczny
Ώ
kg m
2
s
-3
A
-2
14
Przedrostki wielokrotności jednostek
• mniejsze niż jednostka podstawowa
– m
- mili 10
-3
=0,001
– µ
- mikro 10
-6
= 0,000001
– n
- nano 10
-9
– p
- piko 10
-12
– f
- femto 10
-15
• większe
– k
- kilo 10
3
=1000
– M
- mega 10
6
= 1 000 000
– G
- giga 10
9
– T
- tera 10
12
15
Liczby w zapisie wykładniczym
• zapis wykładniczy:
– 0,002 m = 2 mm = 2·10
-3
m
– 0,0355 g = 3,55 mg = 3,55·10
-2
g = 3,55·10
-5
kg
– 32 MW = 3,2·10
4
kW =3,2·10
7
W
– 1 255 000 kg = 1255 Mg = 1,255·10
6
kg =1,255·10
9
g
–
• działania na liczbach w zapisie wykładniczym:
– 0,01 + 1,3·10
-5
= 1·10
-2
+1,3·10
-5
=1,0013·10
-2
≈
1·10
-2
– 0,01·2·10
-3
= 1·10
-2
·2·10
-3
= 2·10
-5
– 2·10
-3
·3·10
5
= 6·10
2
= 600 ...
– ... itd
16
Materia jest wieczna (?)
• Anaksagoras z Kladzomen (Klazomenaj)
(ok. 500 – ok. 428 p.n.e.)
– nic się nie rodzi ani nie ginie, lecz rzeczy
istniejące łączą się, a później znów się
oddzielają ...
17
Materia jest zbudowana z atomów (1)
• Demokryt z Abdery
(ok. 460 – ok. 370 p.n.e.)
– natura jest ciągłym ruchem
materialnych, niepodzielnych
i wiecznych cząstek (atomów),
których połączenie daje w efekcie
różnorodne ciała
– jako zwolennik determinizmu
uważał, że wszystko ma swoją
przyczynę
18
Materia jest zbudowana z atomów (2)
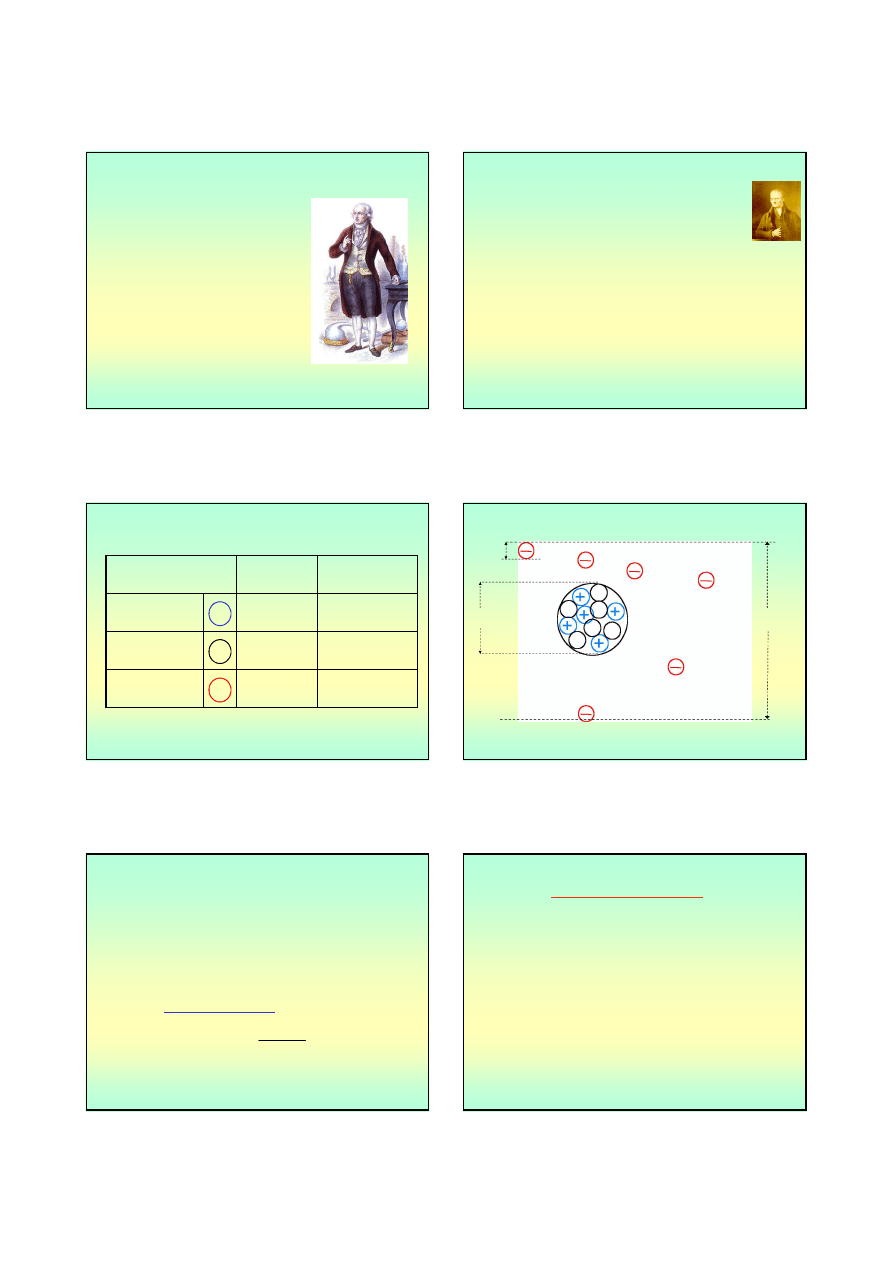
– obalił teorię flogistonu, wykazując,
ż
e spalanie jest łączeniem substancji
z zawartym w powietrzu
pierwiastkiem, który nazwał
oxygenium, czyli tlenem. Drugi
składnik powietrza nazwał azotem;
– opracował podstawy nomenklatury
chemicznej i napisał pierwszy
podręcznik chemii – Traité
élémentaire de chimie (1789);
– pierwiastek – wedle Lavoisiera – to
substancja, której nie da się już dalej
rozłożyć metodami analizy
chemicznej
Antoine de Lavoisier (1743 – 1794)
4
19
Materia jest zbudowana z atomów (3)
• Wcześniej za pierwiastki
uważano:
– ziemię, powietrze, wodę i ogień
• Pierwiastki wg Lavoisiera:
– tlen, wodór, azot, fosfor, rtęć,
siarka, światło i ciepło;
• Lavoisier ma w swoim dorobku
udział we wprowadzeniu
systemu metrycznego, reformy
prawa, a także metod
nawożenia w rolnictwie
• Niestety rewolucji francuskiej
nie byli potrzebni uczeni ...
20
Materia jest zbudowana z atomów (4)
• John Dalton (1803):
– materia składa się z niepodzielnych i
niezniszczalnych atomów;
– wszystkie atomy jednego pierwiastka są
identyczne;
– atomy różnych pierwiastków mają różne masy
i właściwości chemiczne;
– atomy jednego pierwiastka łączą się z
atomami innego pierwiastka tworząc związek
chemiczny; ten sam związek chemiczny ma
zawsze taką samą liczbę atomów danego
pierwiastka (względem innych atomów);
– atomy nie mogą zostać stworzone lub
zniszczone. Jeśli związek ulega rozkładowi lub
innym przemianom, atomy pozostają
niezmienione.
(1766 - 1844)
21
Atom jest podzielny (XIX w.)
Składa się z cząstek elementarnych
e = 1,602
@
10
-19
C
MASA
ŁADUNEK
PROTON
1,66·10
-24
g
+e
NEUTRON
1,66·10
-24
g
0
ELEKTRON
9,11·10
-29
g
– e
+
-
22
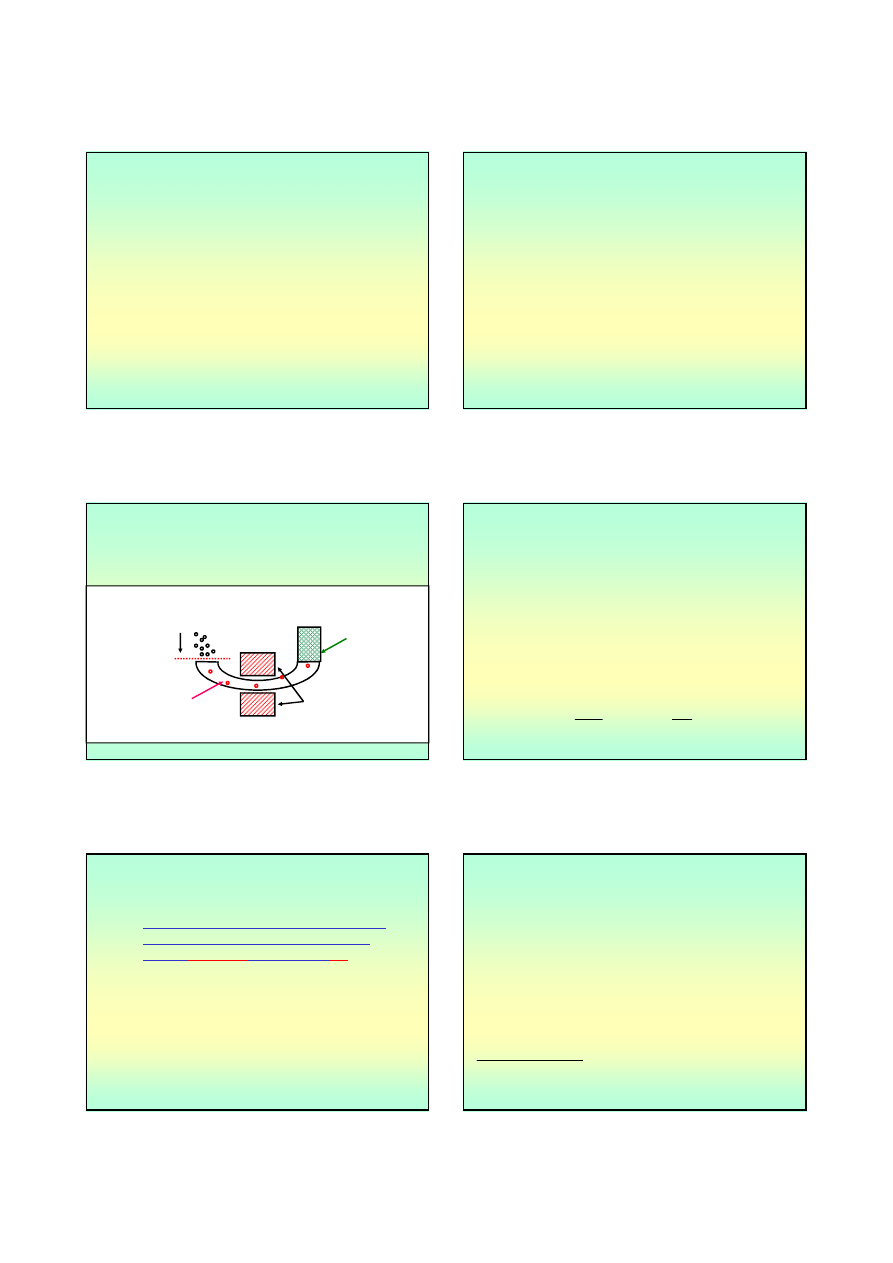
ATOM
~ 10
-10
m
Jądro =>
~ 10
-17
m
~ 10
-18
m
rysunek własny
23
Oddziaływania w atomie
• Oddziaływania natury elektrostatycznej:
– proton
-
elektron
-
przyciąganie
– proton
-
proton
-
odpychanie
– elektron
-
elektron -
odpychanie
F ~
q q
r
1
2
2
⋅
Prawo Coulomba:
24
Identyczność atomów
• Atomy
tego samego pierwiastka
mają taką
samą liczbę protonów w jądrze i taką samą
liczbę elektronów krążących wokół niego;
– Jeśli różnią się liczbą neutronów, to mamy do
czynienia z
izotopami
tego samego pierwiastka;
– Jeśli suma ładunków elektrycznych protonów w
jądrze i elektronów „na zewnątrz” jest różna od
zera, to mamy do czynienia z
jonami
pochodzącymi od danego pierwiastka;
• Każdy pierwiastek ma przyporządkowany
odpowiedni 1-2 literowy symbol, związany
z jego łacińską nazwą
5
25
Pierwiastki i ich izotopy
X
³
symbol nuklidu
liczba masowa
(protony + neutrony)
º
A
liczba atomowa
º
Z
(protony)
Liczba neutronów =
A - Z
26
Pierwiastki „czyste” i „mieszane”
Przykład – Siarka – ma 4 różne naturalne izotopy:
%
0,014
-
S
%,
4,22
-
S
%,
0,76
-
S
%,
95,0
-
S
36
16
34
16
33
16
32
16
Niektóre pierwiastki (22) mają w stanie naturalnym
tylko jeden nuklid (izotop), np.:
...
P,
Al,
Na,
F,
Be,
31
15
27
13
23
11
19
9
9
4
itd.
Inne pierwiastki występują w przyrodzie jako mieszanina
dwóch lub więcej izotopów – naturalna cyna składa się z
dziesięciu różnych nuklidów. Skład izotopowy jest stały (z
pewną dokładnością)
27
Jak określić masę atomów i rozdzielać
izotopy ? (1)
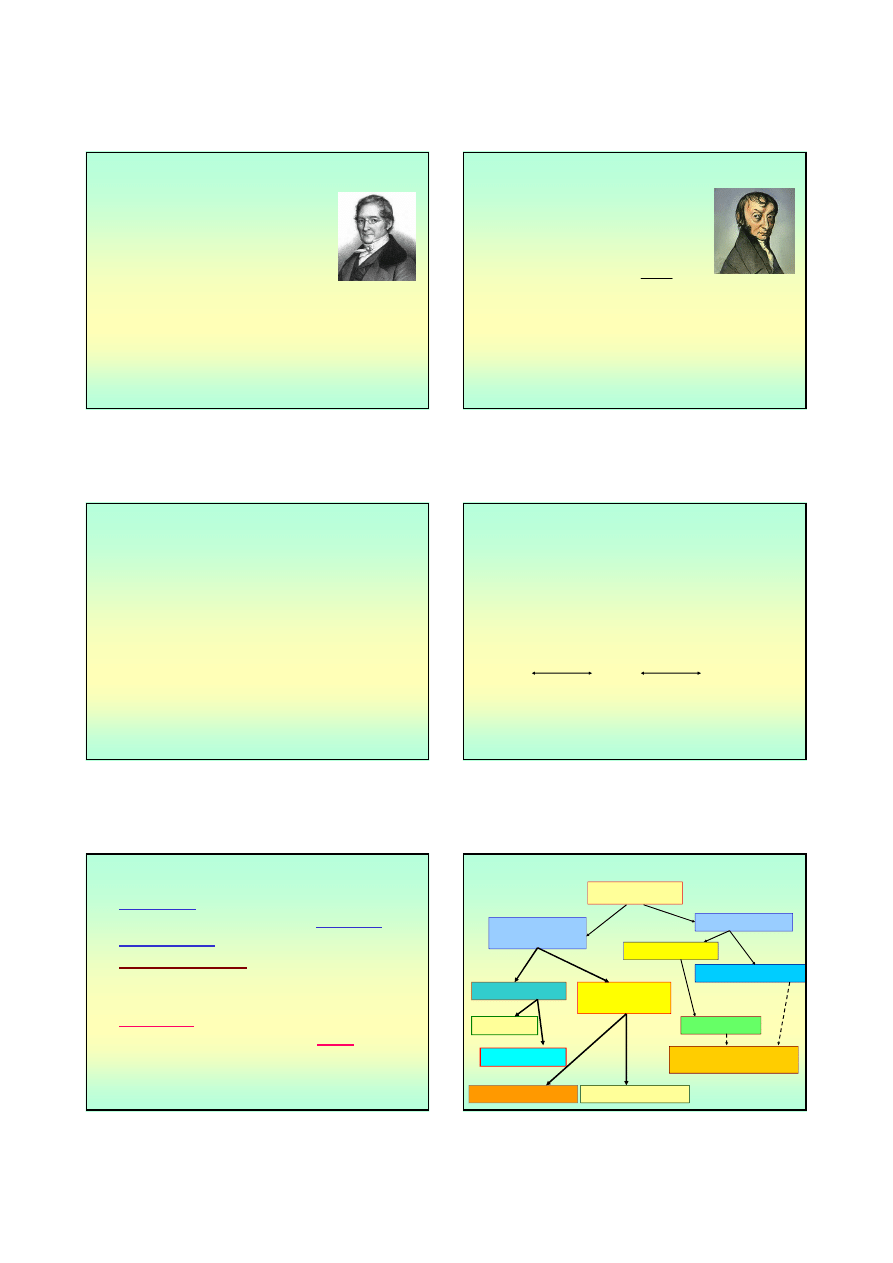
• Spektrometria (spektrografia) masowa pozwala
określić wzlędną masę atomów i cząsteczek
[J.J.Thompson (1907)]
Strumień
atomów
(cząstek)
Jonizacja
Elektromagnes
Strumień
zjonizowanych
cząstek
Detektor
rysunek własny
28
Jak określić masę atomów ? (2)
• Jednostka masy atomowej (umowna!) :
C
12
6
1/12 masy atomu izotopu
= 1 j.m.a. [u]
1 j.m.a. [u] = 1, 6605•10
-24
g
1 g = 6,02214 •10
23
u
Masa atomowa pierwiastka jest średnią ważoną mas jego izotopów
Przykład: naturalny węgiel składa się z trzech izotopów
(slady)
C
(1,11%),
C
(98,89%),
C
14
6
13
6
12
6
u
011
,
12
100
1,11
u
003
,
13
100
98,89
u
000
,
12
=
•
+
•
29
Jak określić ilość substancji ? (1)
• Umownie:
– 1 mol danej substancji zawiera dokładnie tyle
samo cząstek (atomów lub cząsteczek), ile
zawiera
12 gramów
izotopu węgla
12
C
– 1 atom węgla
12
C ma masę 12,000 u
– 1 mol węgla
12
C ma masę 12,000 g
– 1 mol węgla będący mieszaniną izotopów
12
C,
13
C
i
14
C ma masę 12,011 g
• Masa 1 mola danej substancji (w gramach!)
nosi nazwę masy molowej
30
Jak określić ilość substancji ? (2)
• Mole dwóch różnych substancji różnią się masą,
choć zawierają tyle samo atomów (cząsteczek)
• Masa 1 atomu Al = 26,982 u, jest on zatem 2,2485
razy cięższy niż 1 atom
12
C. Taka sama jest zatem
proporcja mas molowych: 12 g ·2,2485 = 26,892 g
• Jeśli podzielimy masę molową
12
C przez masę 1
atomu (w gramach), to otrzymamy liczbę atomów
w 1 molu (tak samo dla dowolnej substancji !!!)
A
23
23
24
N
10
02
,
6
10
0221367
,
6
g
10
1,6605
12
g
12,000
=
⋅
≈
⋅
=
⋅
⋅
−
6
31
Jak określić ilość substancji (3)
• Prawo stosunków objętościowych
(~1804):
– Objętości gazów uczestniczących
w reakcji mają sie do siebie jak
niewielkie liczby całkowite
Joseph Gay-Lussac
1778-1850
Jak zatem ma się objętość gazu do jego masy ?
Objętość gazu zależy od jego
temperatury i ciśnienia
32
Jak określić ilość substancji ? (4)
• Hipoteza Avogadro (1811):
– W jednakowych objętościach
gazów znajdują się jednakowe
ilości cząsteczek
T
R
V
p
n
T
R
n
V
p
⋅
⋅
=
⋅
⋅
=
⋅
;
n - liczba moli gazu, V - objętość gazu, p - ciśnienie gazu
(1,013·10
5
Pa), R - stała gazowa (8,314 J·mol
-1
·K
-1
), T -
temperatura (298 K)
Objętość 1 mola dowolnego gazu
w warunkach normalnych
wynosi 22,414 dm
3
(l)
Amedeo Avogadro
(1776 – 1856)
33
Liczba Avogadro (N
A
) :
• W 1 molu dowolnej substancji zawsze
znajduje się taka sama liczba elementów
(elektronów, atomów, cząsteczek, jonów
itd. ...)
N
A
= 6,02214179(30)·10
23
mol
-1
34
Jak określić ilość substancji ? (3)
• Liczba Avogadro (N
A
) bywa użyteczna, gdyż pełni
rolę „pomostu” pomiędzy światem „mikro” i „makro”
• Możemy zatem – posługując się pojęciem mola i
liczbą Avogadro – łatwo dokonywać konwersji mas
na liczbę atomów i cząsteczek i odwrotnie:
Masa
substancji
Masa molowa
Liczba
moli
Liczba Avogadro
N
A
Liczba atomów
(cząsteczek)
Skala
makroskopowa
Skala
atomowa
35
Pierwiastki i związki chemiczne
• Pierwiastek składa się z atomów tego
samego rodzaju (tj. mających taką samą
ilość protonów w jądrze)
• Związek chemiczny składa się z różnego
rodzaju atomów połączonych ze sobą
wiązaniami chemicznymi
• Mieszanina składa się z pierwiastków lub
związków chemicznych, które nie są
połączone pomiędzy sobą wiązaniami
chemicznymi
36
Klasyfikacja materii
MATERIA
CZYSTE
SUBSTANCJE
MIESZANINY
PIERWIASTKI
ZWIĄZKI
CHEMICZNE
METALE
NIEMETALE
NIEORGANICZNE
ORGANICZNE
JEDNORODNE
NIEJEDNORODNE
ROZTWORY
ROZTWORY
KOLOIDALNE (ZOLE)
rysunek własny

7
37
Klasyfikacja mieszanin
składnik A
składnik B
jednorodne
niejednorodne
gaz
gaz
zawsze
–
gaz
ciecz
woda
gazowana
mgła, piana
ciecz
ciecz
ocet, kwas
siarkowy
emulsja
(np.mleko)
gaz
stały
wodór w
metalach
dym, kurz
cegła, pumeks
stały
ciecz
roztwór soli
zawiesiny
stały
stały
stop
skała
38
Przemiany (reakcje) chemiczne (1)
• Synteza:
A + B => AB
(A i B mogą być pierwiastkami lub
związkami chemicznymi)
• Analiza (rozkład):
AB => A + B
(A i B mogą być pierwiastkami lub
związkami chemicznymi)
• Wymiana:
AB + CD => AC + BD
(reakcja A + BC => AC + B jest przypadkiem
szczególnym)
39
Przemiany (reakcje) chemiczne (2)
Układanie równań chemicznych - podstawowe prawa
PRAWO ZACHOWANIA MASY:
substraty
produkty
masa substratów = masa produktów
reakcja
→
Antoine de Lavoisier, 1785
PRAWO STOSUNKÓW STAŁYCH:
Skład chemiczny danej substancji
(wzajemny stosunek liczby atomów =
wzajemny stosunek liczby moli) jest
zawsze taki sam, niezależnie od
sposobu jej otrzymania
Antoine Lavoisier
(1743 - 1794)
Joseph-Louis Proust
(1754 - 1826)
40
Zasady uzgadniania równań reakcji chemicznych
Zapis reakcji chemicznej ma charakter równania
Musi być spełnione
prawo zachowania masy
, to znaczy,
ż
e po obu stronach reakcji musi być taka sama liczba
atomów każdego rodzaju
Musi być spełnione
prawo stałości składu (prawo
stosunków stałych)
, to znaczy, że każdy związek
chemiczny będzie mieć zawsze taki sam wzór,
niezależnie od sposobu, w jaki został utworzony
Jeżeli w równaniu reakcji występują jony, to
sumaryczny ładunek elektryczny
jonów po prawej
stronie równania musi być taki sam jak po lewej
Równanie reakcji przedstawia zarówno reagujące ze
sobą
atomy/cząsteczki
jak i
mole
substancji
41
Co decyduje o właściwościach atomu ?
• masa (protony + neutrony + elektrony)
– prawie cała masa atomu skupiona jest w jądrze,
wkład elektronów jest niewielki
• ładunek jądra oraz liczba elektronów
– wzajemne oddziaływania o charakterze
elektrostatycznym
•
ułożenie elektronów (konfiguracja)
– istotne dla właściwości chemicznych są
zwłaszcza elektrony położone daleko od jądra
Wyszukiwarka
Podobne podstrony:
20id!213 Nieznany
2013 05 26 20id 28348 Nieznany
11 20id 12109 Nieznany (2)
21 Rozdziae 20id 29118 Nieznany (2)
20id 21210 Nieznany (2)
2011 02 21 WIL Wyklad 20id 2752 Nieznany (2)
04 20 belki i ramy zadanie 20id Nieznany (2)
Gor±czka o nieznanej etiologii
02 VIC 10 Days Cumulative A D O Nieznany (2)
Abolicja podatkowa id 50334 Nieznany (2)
45 sekundowa prezentacja w 4 ro Nieznany (2)
4 LIDER MENEDZER id 37733 Nieznany (2)
Mechanika Plynow Lab, Sitka Pro Nieznany
katechezy MB id 233498 Nieznany
2012 styczen OPEXid 27724 Nieznany
metro sciaga id 296943 Nieznany
Mazowieckie Studia Humanistyczn Nieznany (11)
cw 16 odpowiedzi do pytan id 1 Nieznany
więcej podobnych podstron