
WYDZIAŁ NAUK O ŻYWNOŚCI I RYBACTWA
CENTRUM BIOIMMOBILIZACJI I INNOWACYJNYCH
MATERIAŁÓW OPAKOWANIOWYCH
ENZYMOLOGIA
Kierunek:
Technologia Żywności
i Żywienie Człowieka
semestr I
Wykład 3
Nomenklatura, podział I czynniki
regulujące kinetykę procesów
enzymatycznych

Zakres materiału ENZYMOLOGIA
1. Biochemia, Autor: Jeremy Berg, Lubert Stryer, John L. Tymoczko,
PWN Warszawa (2005)
Rozdziały:
8. Enzymy:: podstawowe pojęcia i kinetyka
9. Strategie katalityczne
10. Strategie regulacyjne:: enzymy i hemoglobina
2. Ćwiczenia z enzymologii i technik biochemicznych. Bartoszewska, Niziołek,
Paszowski, Wydawnictwo SGGW
3. Handbook of Food Enzymology – ed. John R. Whitaker et al., CRC Press; (2002)
4. Enzymes in Food Technology -‐ ROBERT J. WHITEHURST, BARRY A.
LAW, Editors Sheffield Academic Press CRC Press (2002)
3. Food chemistry -‐ Hans-‐Dieter Belitz, Werner Grosch, Peter
Schieberle, Springer (2004)
Nomenklatura
EC:
Każdy
enzym
jest
opisany
przez
ciąg
czterech
segmentów
cyfr,
oddzielonych
od
siebie
kropką,
poprzedzonych
literami
"EC"
(Enzyme
Commission
lub
Enzyme
Catalogue):
EC
x.xx.xx.xx.
Pierwsza
cyfra
dzieli
enzymy,
według
mechanizmu
reakcji
przez
nie
katalizowanych
Następne
liczby
numeru
EC
oddzielone
kropkami
klasyfikują
dany
enzym
odpowiednio
do
podklasy
i
podpodklasy,
natomiast
ostatnia
liczba
określa
miejsce
enzymu
w
podpodklasie.
Nazewnictwo enzymów
Nomenklatura
i
systematyka
enzymów
1961
–pierwsze
podstawowe
zasady
nomenklatury
i
klasyfikacji
enzymów
przez
Komisję
Enzymatyczną
powołaną
przez
Międzynarodową
Unię
Biochemiczną
i
Biologii
Molekularnej
(IUBMB)
w
1955r
1972 Komitet Nazewnictwa (ang. Nomenclature Commihee) Międzynarodowej Unii
Biochemii
i
Biologii
Molekularnej
w
latach
1956-‐1972
opracował
dla
enzymów
nomenklaturę
naukową
–
numer
EC.
1992 – Nomenklatura enzymów wydana przez Komitet Enzymowy (NC) IUBMB – pozycja
książkowa
Nazewnictwo
zwyczajowe
W
nazewnictwie
enzymów
zaleca
się
stosowanie
numeru
EC,
jednak
dopuszcza
się
stosowanie
nazw
zwyczajowych
z
przyrostkiem
-‐aza,
gdzie
pierwszy
człon
określa
reakcję,
a
drugi
jej
substrat
Enzymy
dzieli
się
na
6
grup
(mechanizm
reakcji…):
EC
1
oksydoreduktazy:
katalizują
reakcje
utleniania
i
redukcji,
EC
2
transferazy:
przenoszą
grupy
funkcyjne,
EC
3
hydrolazy:
katalizują
hydrolizę
różnych
wiązań,
EC
4
liazy:
rozcinają
różne
wiązania
na
drodze
innej
niż
hydroliza
czy
utlenianie,
EC
5
izomerazy:
katalizują
zmiany
izomeracyjne
cząsteczek,
EC
6
ligazy:
łączą
cząsteczki
wiązaniami
kowalencyjnymi.
Nazewnictwo/klasyfikacja enzymów EC
• EC1
oksydoreduktazy
-‐ AH
2
+ B → A + BH
2
;
• EC2
transferazy
-‐ AB + C → A + BC;
• EC3
hydrolazy
-‐ AB + H
2
O → A + B;
• EC4
liazy
-‐ AB → A + B;
• EC5
izomerazy
-‐ AB → BA;
• EC6
ligazy
-‐ A + B → AB;
Enzymy
katalizujące
reakcje
oksydoredukcyjne,
polegające
na
przenoszeniu
elektronów,
protonów
lub
polegające
na
bezpośrednim
włączaniu
tlenu
do
substratu.
Klasa ta obejmuje następujące grupy enzymów
• Dehydrogenazy – odwodorowanie, utlenianie przenośniki e
-‐
i H
+
-‐ NAD
+
, FAD
•
Reduktazy
–
redukcja
przenośniki
e-‐
i
H+
-‐
NADP+,
FAD,
ferredoksyna,
cytochromy
•
Oksydazy
•
Peroksydazy
• Oksygenazy (a) i hydroksylazy (b)
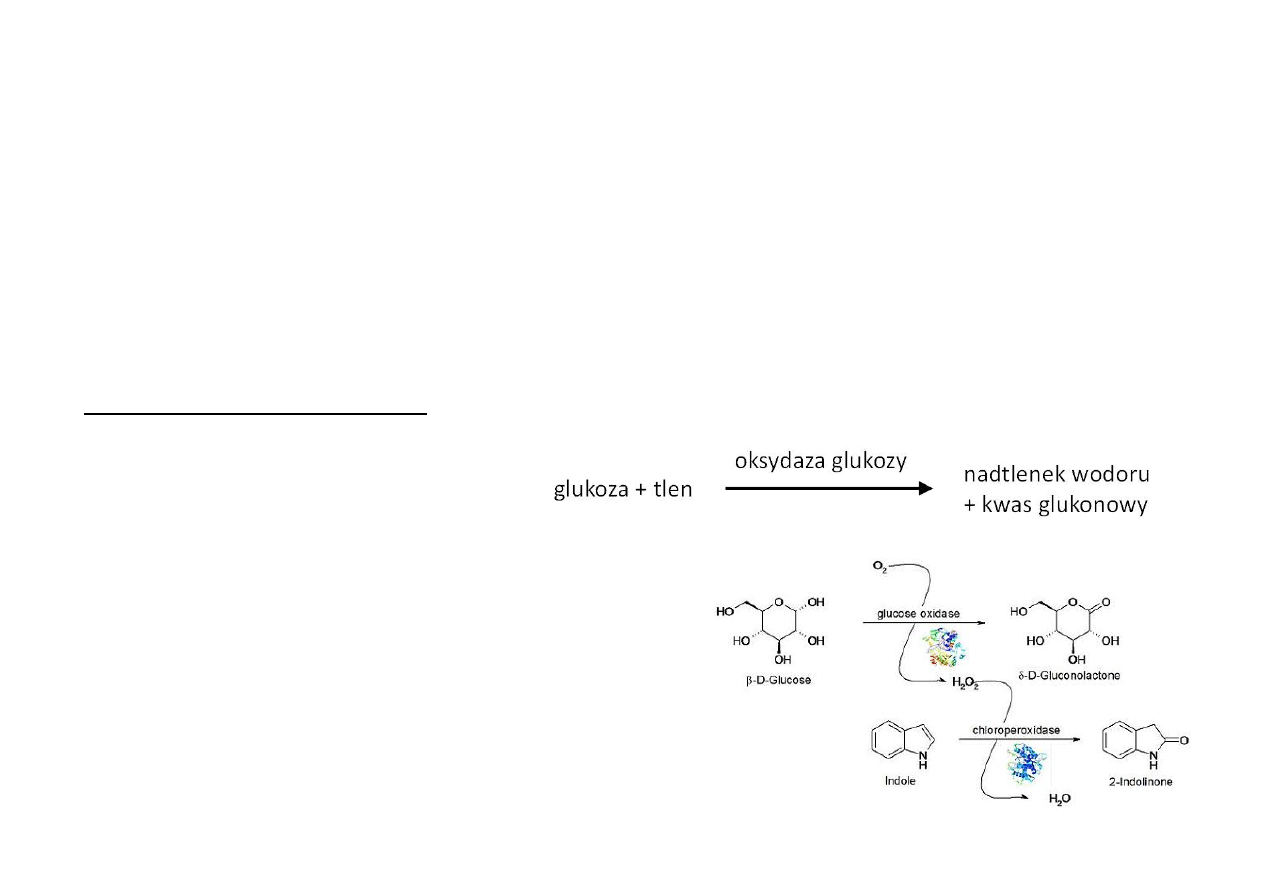
Oksydoreduktaza
β-‐D-‐glukoza:
tlen
–
nazwa
systematyczna
Oksydaza
glukozy
–
nazwa
potoczna
EC1.1.3.4
–
numer
klasyfikacyjny
4-‐kolejność
w
podklasie
3-‐akceptor:
tlen
1-‐utleniana
grupa
w
donorze:
CH-‐OH
1-‐klasa
enzymu
(oksydoreduktaza)
Zastosowanie oksydoreduktaz:
•
Do
usuwania
glukozy
i
tlenu
z
opakowań
•
Do
stabilizacji
piwa,
win,
soków
•
Do
odcukrzania
masy
jajowej
przed
suszeniem
• Do oznaczania ilościowej glukozy
1. OKSYDOREDUKTAZY
1. Klasa ta obejmuje enzymy katalizujące przeniesienie grup chemicznych pomiędzy
poszczególnymi związkami i to zwykle przy udziale specyficznych koenzymów.
2. W zależności od rodzaju przenoszonych grup lub rodników wyróżniamy m.in.:
-‐ Aminotransferazy: przenoszą grupą aminową-‐NH
2
-‐
Fosfotransferazy
(kinazy):
przenoszą
grupy
fosforanowe
z
udziałem
ATP
-‐
Metylotransferazy:
przenoszą
grupę-‐CH
3
-‐ Glikozylotransferazy: przenoszą grupy cukrowe
-‐ Acylotransferazy: przenoszą grupy acylowe 2,4,6-‐węglowe
6-‐fosfotransferaza
ATP
-‐
enzym
katalizujący
przeniesienie
fosforanu
z
ATP
na
grupę
hydroksylową
przy
6
at.
węgla
D-‐heksoza
–
nazwa
systematyczna
Heksokinaza
–
nazwa
potoczna
EC
2.7.1.1
–
numer
klasyfikacyjny
1-‐
kolejność
w
podklasie
1-‐
grupa
akceptorowa:
grupa
alkoholowa
7-‐
przenoszona
grupa:
grupa
zawierająca
fosfor
2-‐ klasa enzymu
2. TRANSFERAZY

1. Enzymy
katalizujące
reakcję
hydrolizy,
czyli
rozkładu
wiązań
z
udziałem
cząsteczki
wody.
2. Jest
to
jedna
klasa
enzymów,
która
nie
wymaga
obecności
koenzymów
3. W zależności od rodzaju atakowanych wiązań rozróżniamy hydrolazy m.in.:
-‐ Etsterazy -‐ rozkładające wiązania estrowe
-‐
Lipazy
(hydrolazy
estrów
karboksylowych)
-‐
Fosfatazy
(hydrolazy
monoestrów
fosforanowych)
-‐
Glikozydazy
-‐
hydrolizujące
wiązania
glikozydowe
-‐
np.
amylazy,
celulazy
-‐
Peptydazy
-‐
Hydrolizujące
wiązania
peptydowe
–
np.
trypsyna,
pepsyna,
chymotrypsyna
-‐
Amidohydrolazy
-‐
rozkładające
wiązanie
C-‐N
inne
niż
peptydowe
np.
w
amidach
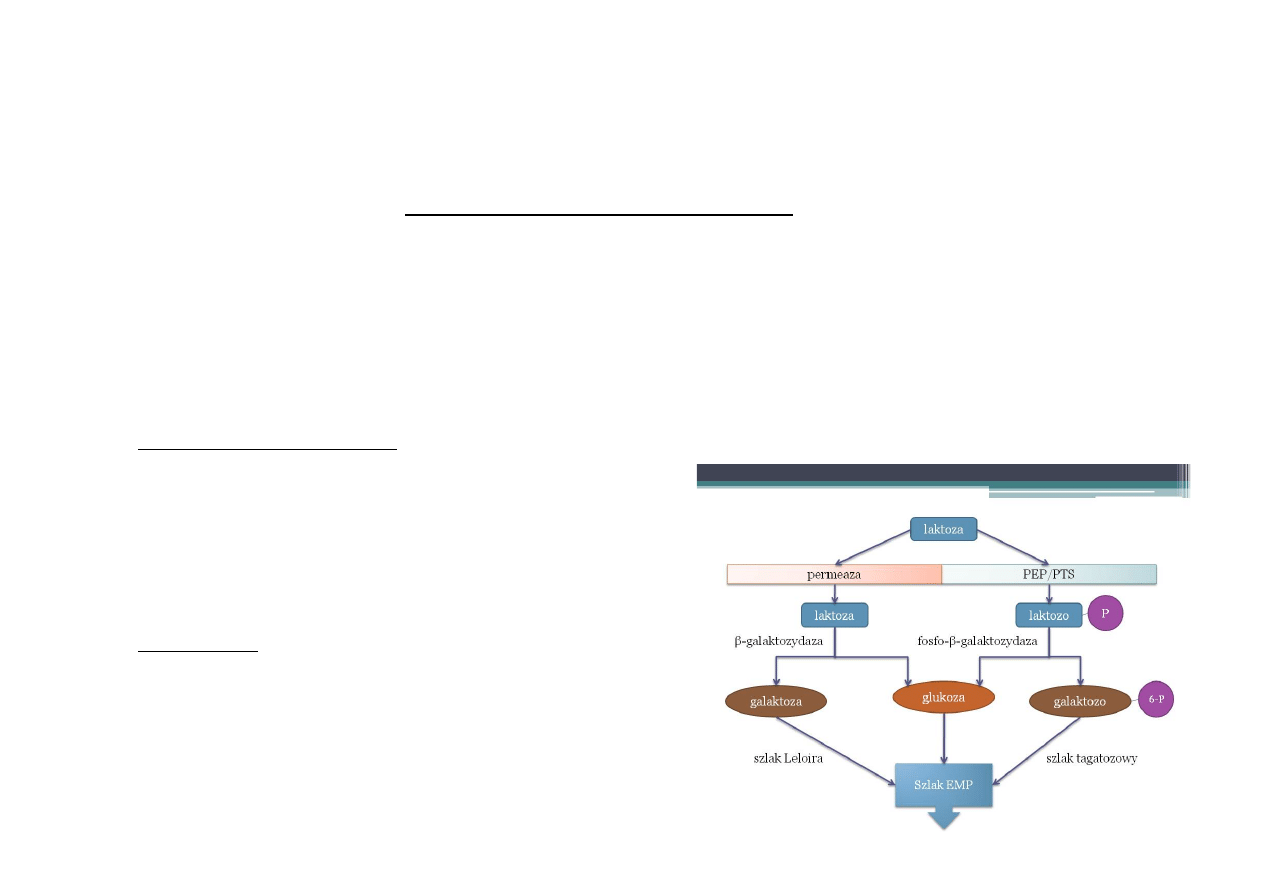
Galaktohydrolaza β-D-galaktozydu – nazwa systematyczna
β-D-galaktozydaza, laktaza – nazwa potoczna
EC
3.2.1.23
23-‐kolejność
w
podklasie
1-‐hydrolizowane
wiązanie
dokładniej
O-‐
lub
S-‐glikozylowe
2-‐hydrolizowane
wiązanie:
wiązanie
glikozydowi
3-‐klasa enzymu
3. HYDROLAZY
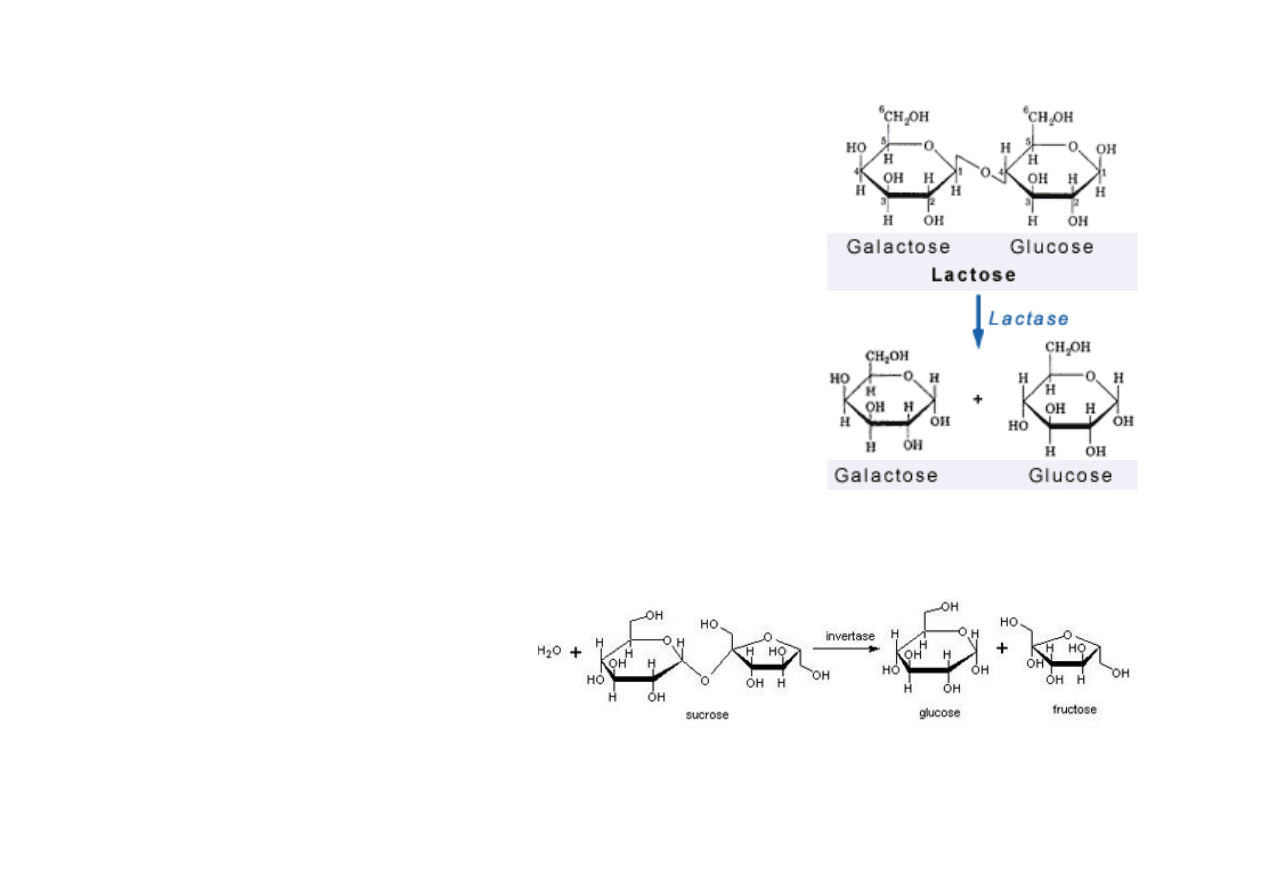
LAKATAZA
•
produkcja
mleka
przy
nietolerancji
laktozy,
hydroliza
laktozy do glukozy i galaktozy
• polepsza rozpuszczalność, zmniejsza koncentrację
sacharydów
w
produktach
koncentratów
z
mleka
i
serwatki
(łatwa
produkcja
lodów,
deserów)
•
glukoza
słodsza
od
laktozy
•
rozkład
glukozy
przyspiesza
fermentację
mleka
w
technologii napojów fermentowanych, twarogów,
serów
3. HYDROLAZY
(cz. II)
SACHARAZA
inwertaza
(sacharaza,
β-‐fruktofuranozydaza)
hydrolizuje
wiązanie
α-‐1,4-‐glikozydowe
i
powstaje
α-‐D-‐glukoza
i
β-‐D-‐fruktoza
•
produkcja
cukru
inwertowanego
• otrzymywanie fruktozy
Fruktoza:
•
najlepiej
rozpuszczalna
w
wodzie
–
słodzenie
soków
(nie
krystalizuje
w
czasie
przechowywania)
•
higroskopijna
–
zapobiega
utracie
wilgoci
z
żywności,
np.
owoce
kandyzowane
•
syropy
fruktozowe
(dla
diabetyków)
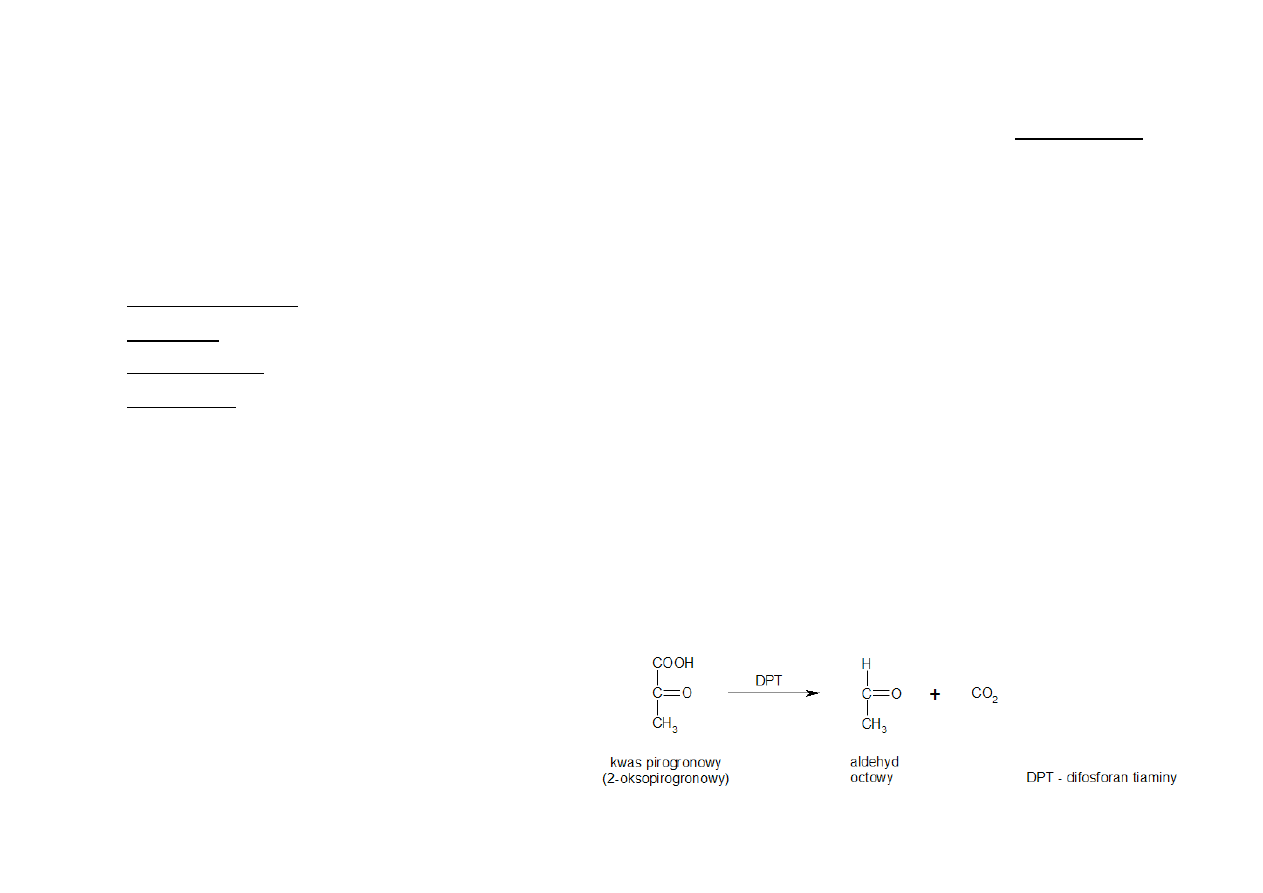
Enzymy
katalizujące
odwracalne
lub
nieodwracalne
rozerwanie
różnych
wiązań
bez
udziału
wody,
przy
czym
z
substratu,
na
który
działa
enzym,
odłączane
są
pewne
grupy
(np.
CO
2
,
H
2
O, NH
3
, aldehydy).
Ze względu na rodzaj rozszczepianych wiązań wyróżniamy m.in. liazy:
-‐ dekarboksylazy -‐ rozrywające wiązanie C-‐C -‐– uwalniają CO
2
z substratów
-‐ aldolazy – uwalniają aldehydy z substratu
-‐ dehydratazy -‐ działające na wiązanie C-‐O – odłączają cząsteczkę wody
-‐ hydratazy – przyłączają i odłączają cząsteczkę wody
-‐ deaminazy -‐ rozszczepiające wiązanie C-‐N – odłączają NH
3
Do klasy tej należą SYNTAZY, które nie wymagają nakładu energii do syntezy wiązań.
PRZYKŁAD:
karboksyliaza 2-‐oksokwasów
dekarboksylaza pirogronianowa
EC
4.
1.
1.
1.
–
numer
klasyfikacyjny
1
-‐
kolejność
w
podklasie
1 -‐ odszczepiana grupa: grupa COO
-‐
1 -‐ rozszczepiane wiązanie: wiązanie C-‐C
4 -‐ klasa enzymu
4. LIAZY
!
1.
Klasa
enzymów
katalizujących
przekształcenia
wewnątrzcząsteczkowe.
2.
Może
to
być
przegrupowanie
atomów
bądź
grup.
3. Skład chemiczny związku nie ulega zmianie.
Należą tutaj enzymy katalizujące różne reakcje izomeryzacji, m.in.:
-‐ racemazy i epimerazy – odpowiedzialne za zmianę konfiguracji przy węglu
asymetrycznym (wzajemne przekształcenia konfiguracji L i D lub formy α i β)
-‐ mutazy
–
odpowiedzialne
za
przemieszczenie
grup
wewnątrz
cząsteczki
-‐
izomerazy
cis-‐trans
–
izomeria
geometryczna
(cis-‐trans)
-‐ izomerazy odpowiedzialne za wewnątrzcząsteczkowe przemiany oksydoredukcyjne
(przesunięcie atomów H+)
PRZYKŁAD:
ketolo-‐izomeraza
D-‐ksylozy
izomeraza ksylozowa (glukozowa)
EC 5. 3. 1. 5. – numer klasyfikacyjny
5
-‐
kolejność
w
podpodklasie
1
-‐
przekształcenie:
przemiana
aldoza
–
ketoza
3
-‐
typ
przekształcenia:
przegrupowanie
atomów
H
5
-‐
klasa
enzymu
5. IZOMERAZY
!
1.
Enzymy
(pot.
syntetazy)
katalizujące
syntezę
–
powstanie
nowych
wiązań:
C-‐O,
C-‐S,
C-‐N,
C-‐C.
2.
Wszystkie
reakcje
katalizowane
przez
ligazy
zachodzą
z
udziałem
ATP
lub
innego
związku
makroergicznego.
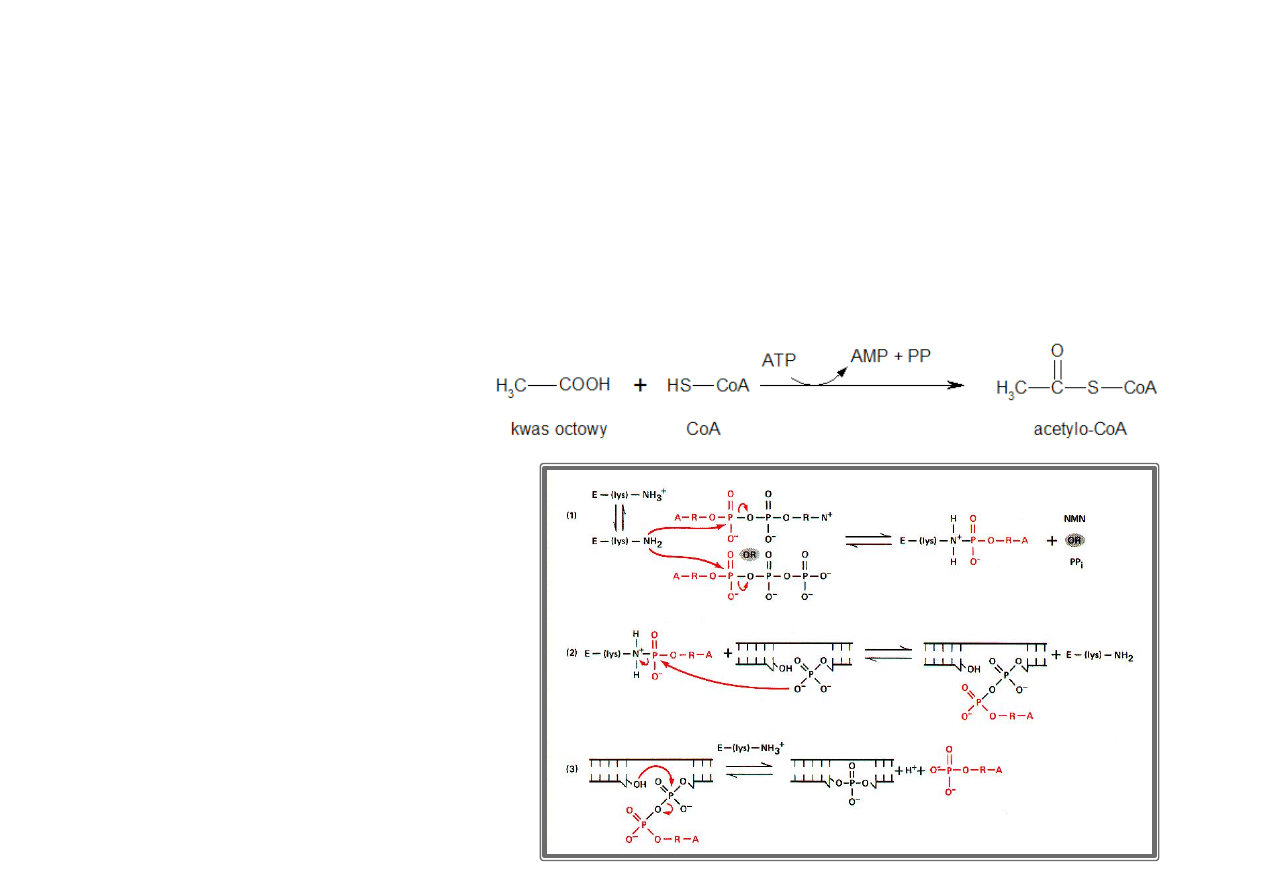
Syntetazy katalizujące dołączenie do substratu CO
2
– nazywamy potocznie karboksylazami.
PRZYKŁAD:
ligaza
octan:
CoA
(AMP)
syntetaza
acetylo-‐CoA
EC 6. 2. 1. 1. – numer klasyfikacyjny
1
-‐
kolejność
w
podklasie
1-‐
substraty
syntezy:
kwas
-‐
vol
2
-‐
powstające
wiązanie:
C-‐S
6
-‐
klasa
enzymu
6. LIGAZY
!
Ligaza DNA
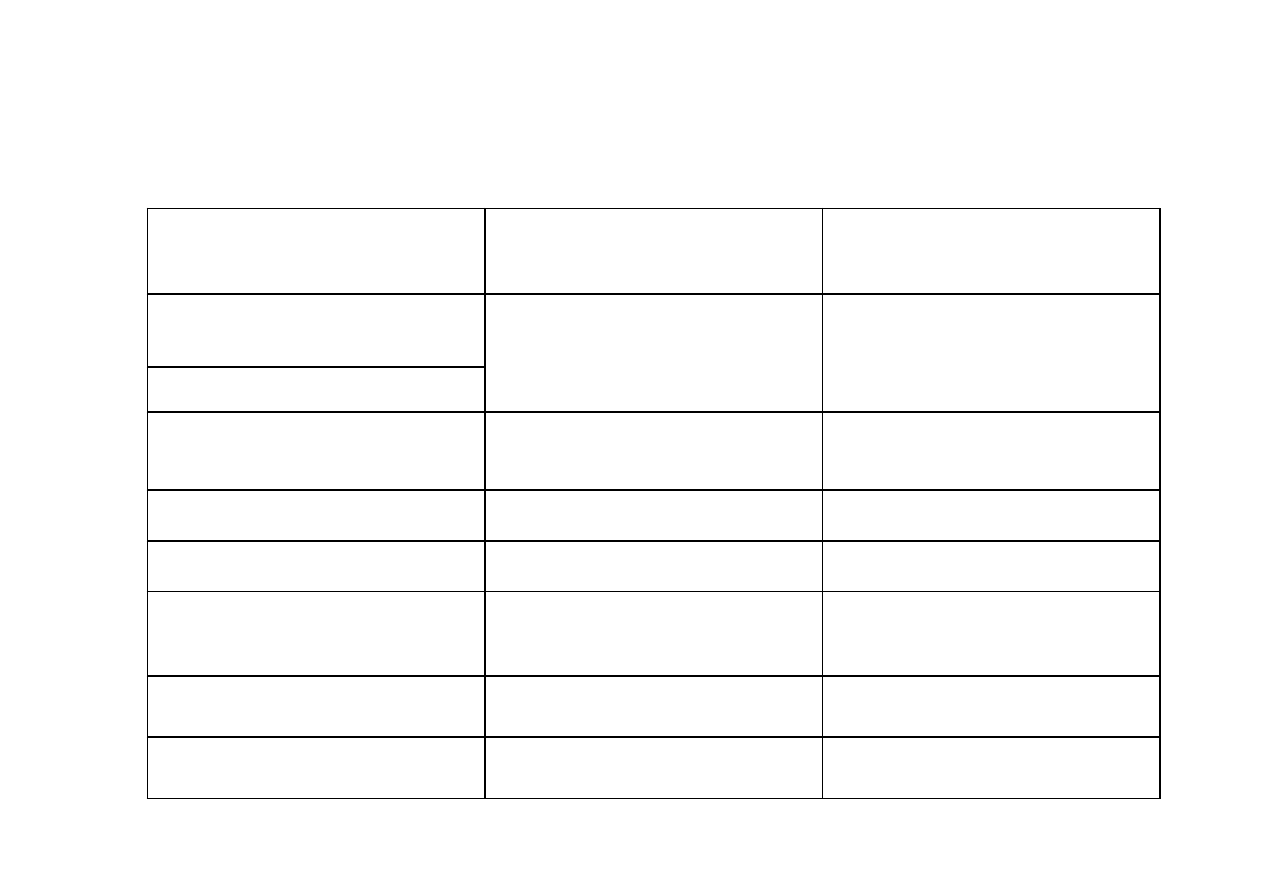
PORÓWNANIE KATALIZY I BIOKATALIZY
PORÓWNYWANY
CZYNNIK
BIOKATALIZA
KATALIZA
temperatura
Duże ograniczenie,
potrzeba ścisłego
kontrolowania warunków
Duży zakres temperatur
stosowanych, mniej wrażliwe
na zmiany warunków
pH
wrażliwość na zatrucia
mniejsza
(trucizny, inhibitory)
duża
( zatrucia)
specyficzność
duża
w zależności od procesu
selektywność
duża
w zależności od procesu
żywotność
duża
mniejsza w porównaniu do
biokatalizatorów
możliwość aktywacji
koenzymy, aktywatory
promotory
zakres stężeń reagentów
nieduże
różne

Czynniki regulujące szybkość działania enzymów
1. kinetyczne:
•
temperatura, pH, dyfuzja,
kształt,
lepkość roztworu
•
stężenie substratów
•
obecność enzymatycznych
aktywatorów i enzymatycznych
inhibitorów
•
czynniki pośrednie:
czynniki allosteryczne,
sprzężenie zwrotne, przemiana
proenzymu w enzym
2. strukturalne:
•
powiązanie enzymów z
określonymi strukturami i ich
rozgraniczenie błonami
wewnątrzkomórkowymi
•
regulowany transport przez
błony komórkowe i
cytoplazmatyczne
•
szybkość odprowadzania
produktów
1. Kinetyka – badanie szybkości, z jaką przebiega reakcja oraz czynników wpływających na
tą czynność reakcji. Nie zajmuje się naturą chemiczną zmian.
2. Kinetyczny opis aktywności enzymów jest konieczny do zrozumienia działania enzymów.
Czynniki:
-‐
stężenie
enzymów
i
substratu
-‐
występowanie
i
stężenie
kofaktorów,
inhibitorów
i
aktywatorów
-‐
temperatura
-‐
stężenie
H
+
(pH)
-‐ oddziaływania allosteryczne, modyfikacje kowalencyjne, aktywacja proteolityczna
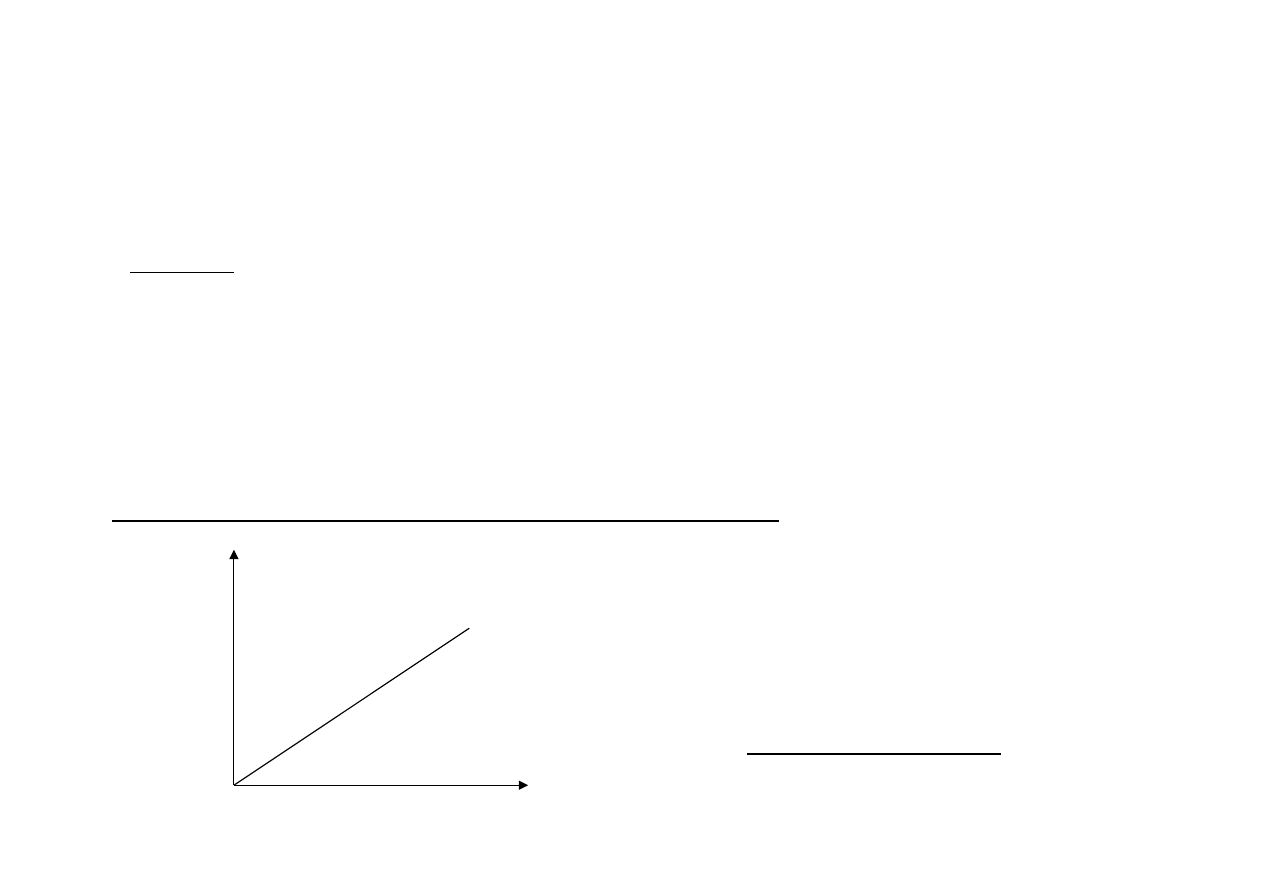
KINETYKA REAKCJI ENZYMATYCZNYCH
Wpływ stężenia enzymu na szybkość reakcji enzymatycznej
[E]
V
Zależność wprost proporcjonalna
2x większe stężenie E => 2x szybsza reakcje
ALE
Substrat w nadmiarze!
1. Oznaczanie aktywności enzymatycznej wykonuje się na początku reakcji enzymatycznej,
ponieważ może dojść do:
-‐ hamowania
aktywności
enzymatycznej
produktem
na
drodze
hamowania
zwrotnego,
-‐ enaturacji
białka
enzymatycznego.
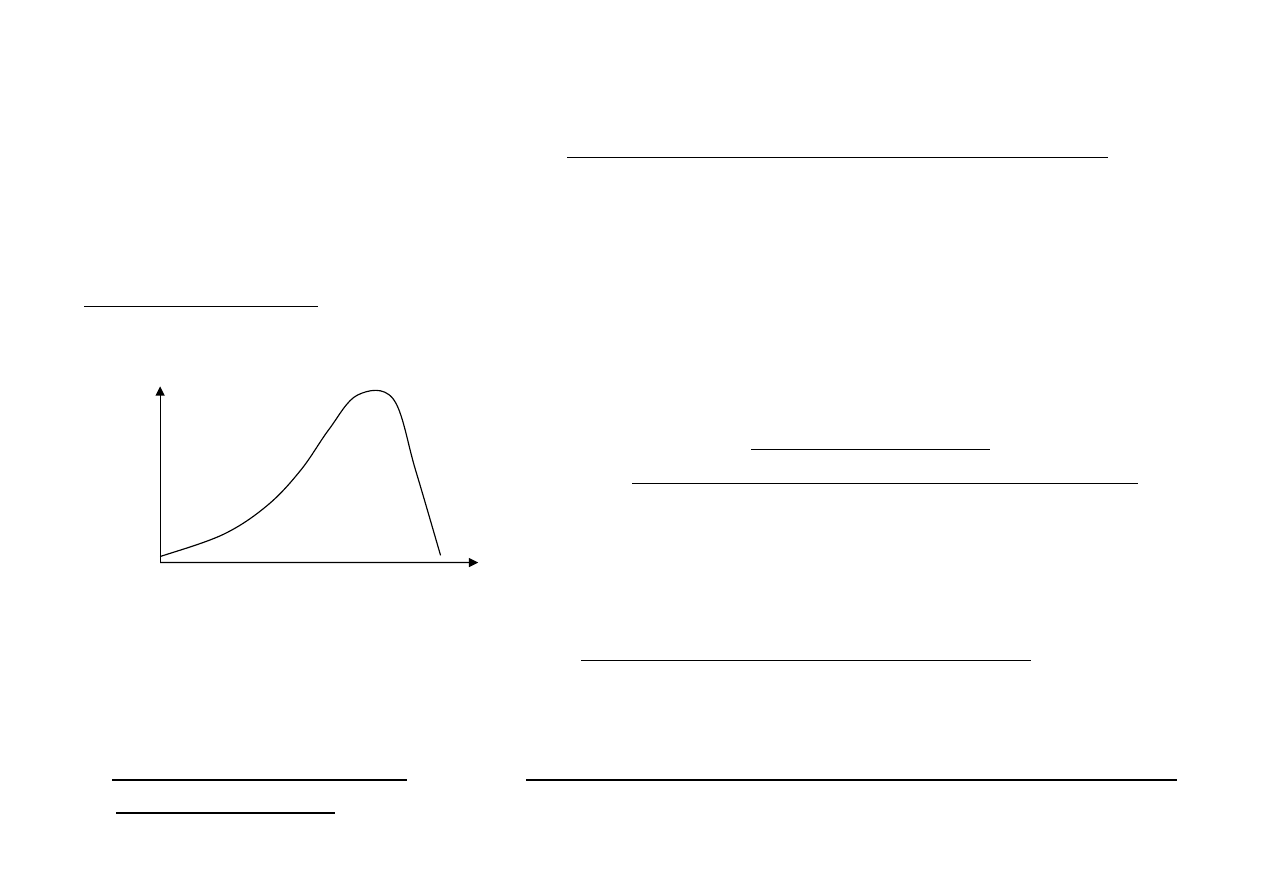
KINETYKA REAKCJI ENZYMATYCZNYCH
Wpływ temperatury
Działa na cząsteczki S i E. ↑ temp. => ↑ en. kinetycznej cz. S
Cząsteczki substratu szybciej się poruszają, zderzają się
częściej, więcej z nich może osiągnąć stan przejściowy.
1.
W
pewnym
momencie
osiągnięta
zostaje
temp.
optymalna
dla
działania
enzymu.
2.
Temperatura
optymalna
–
temperatura,
przy
której
szybkość
reakcji
enzymatycznej
biegnie
z
maksymalną szybkością, a nie ma miejsca jeszcze denaturacja białka enzymatycznego.
3. Zbyt wysoka temperatura powoduje drgania w cząsteczkach enzymu i dochodzi do rozerwania
wiązań w enzymie.
[°C]
V
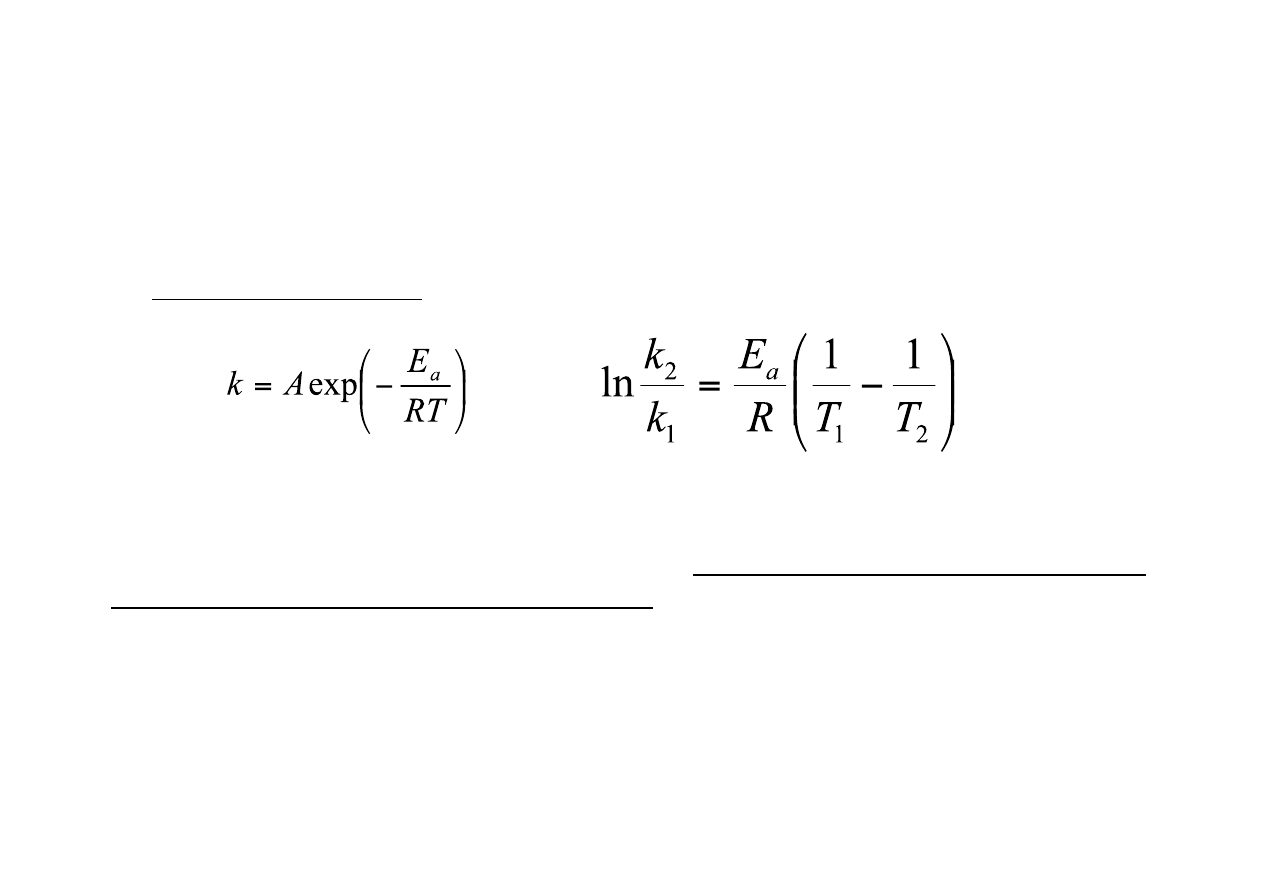
Reguła
van
Hoffa
Wzrost
temperatury
o
10°C
powoduje:
-‐
2-‐3-‐krotny
wzrost
szybkości
reakcji
nieenzymatycznej
-‐
1-‐2-‐krotny
wzrost
szybkości
reakcji
enzymatycznej
„Opvmum temperatury” zależy od czasu przyjętego do obliczenia szybkości reakcji.
Termostabilność enzymu możemy określić podając najwyższą temperaturę, w której jeszcze
nie dochodzi do termicznej inaktywacji enzymu.
Badanie wpływu temperatury na aktywność enzymu:
-‐ przygotowuje się mieszaninę reakcyjną S + E, pH, bufor; mieszaninę przenosi się do
określonej temperatury i reakcja enzymatyczna zachodzi właśnie w takiej określonej
temperaturze, następnie zatrzymujemy reakcję i mierzymy szybkość reakcji enzymatycznej.
KINETYKA REAKCJI ENZYMATYCZNYCH
Równanie Arrheniusa
KINETYKA REAKCJI ENZYMATYCZNYCH
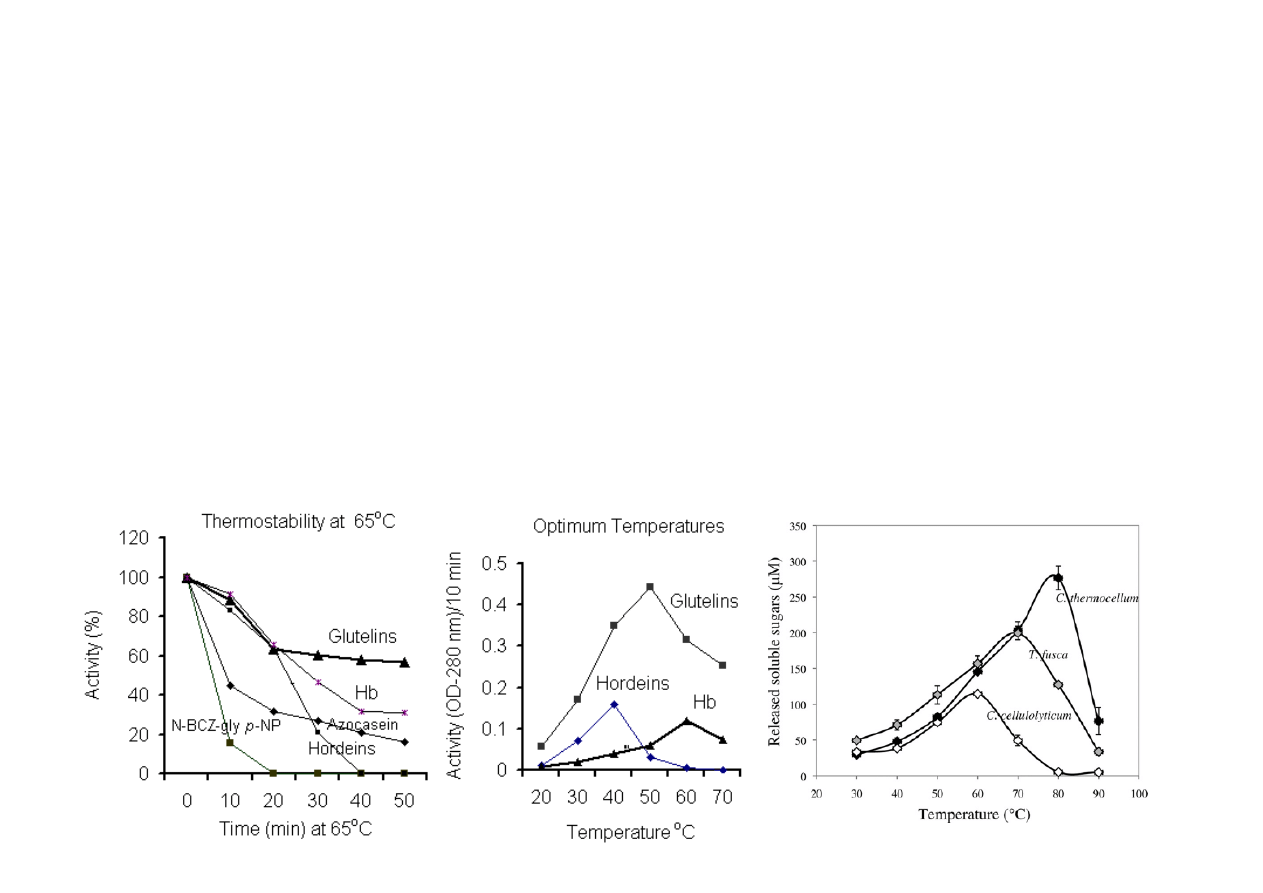
Termostabilność
celulaz
–
różne
mikroorganizmy
Badanie termostabilności białka:
-‐
Badanie
temperatury,
w
której
enzym
zachowuje
aktywność.
-‐
Białko
enzymatyczne
poddaje
się
traktowaniu
różnymi
temperaturami
–
badamy,
jak
ten
enzym zachowuje się w różnych temperaturach.
-‐ Białko enzymatyczne przenosi się do temperatury optymalnej i dodaje pozostałe składniki
reakcyjne.
-‐ Reakcja enzymatyczna biegnie w temperaturze optymalnej.

pH
środowiska
wpływa
na:
wiązanie
substratu
przez
E,
aktywność
katalityczną
E,
stan
jonizacji
substratu,
zmiany
w
strukturze przestrzennej E.
pH
wpływa
na
stopień
zdysocjowania
(uprotonowania):
-‐
grup
funkcyjnych
centrum
aktywnego,
-‐
grup
funkcyjnych,
które
uczestniczą
w
katalizie,
-‐
grup
funkcyjnych
substratu,
które
uczestniczą
w
wiązaniu
do
enzymu,
-‐
grup
funkcyjnych
leżących
w
pobliżu
centrum
aktywnego,
które
decydują
o
konformacji
tego centrum aktywnego.
Optymalne pH działania – wartość pH, przy której szybkość katalizowanej reakcji jest
maksymalna.
Krzywe zależności v/pH mogą być też prostoliniowe.
Niewielkie odchylenie pH od wartości optymalnych powoduje nagły spadek szybkości
reakcji enzymatycznej.
Kinetyka reakcji enzymatycznych -‐ wpływ pH
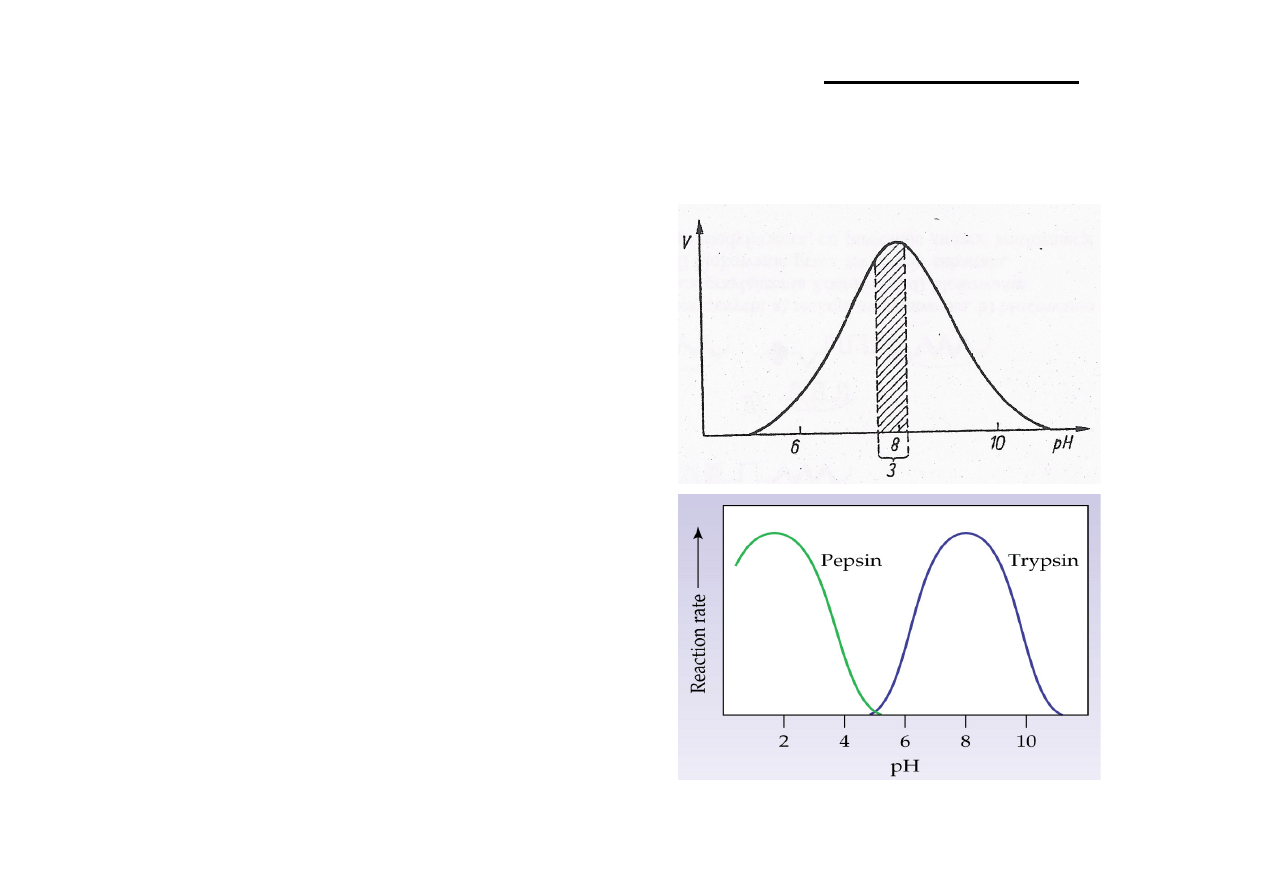
Optymalne
pH
reakcji
jest
różne
dla
różnych
enzymów.
Dla większości mieści się w granicach odczynu
obojętnego (pH 6-‐9).
pepsyna – 1,8
proteinaza kwaśna – 3,5
trypsyna – 8
arginaza – 10
Kinetyka reakcji enzymatycznych – optymalne pH
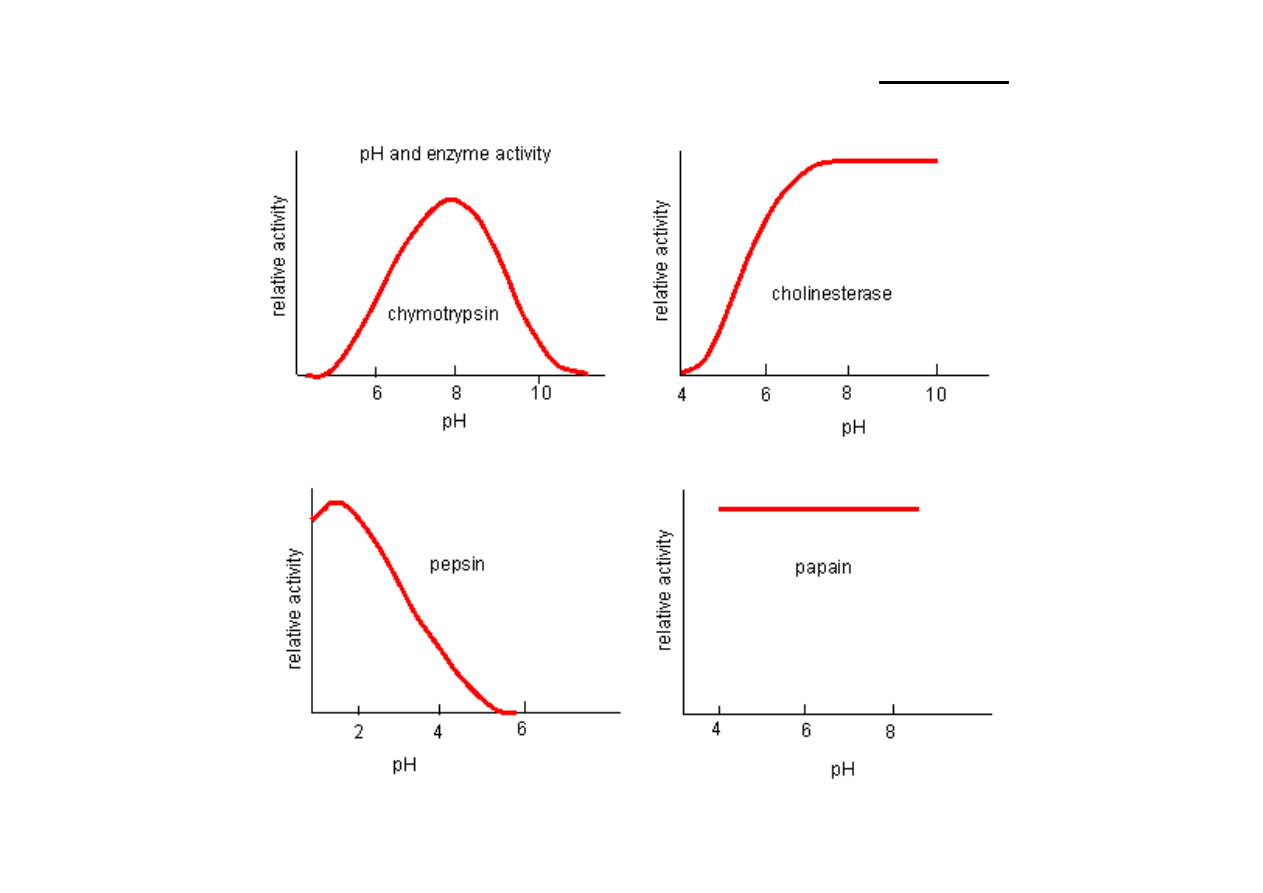
Kinetyka reakcji enzymatycznych
-‐ wpływ pH
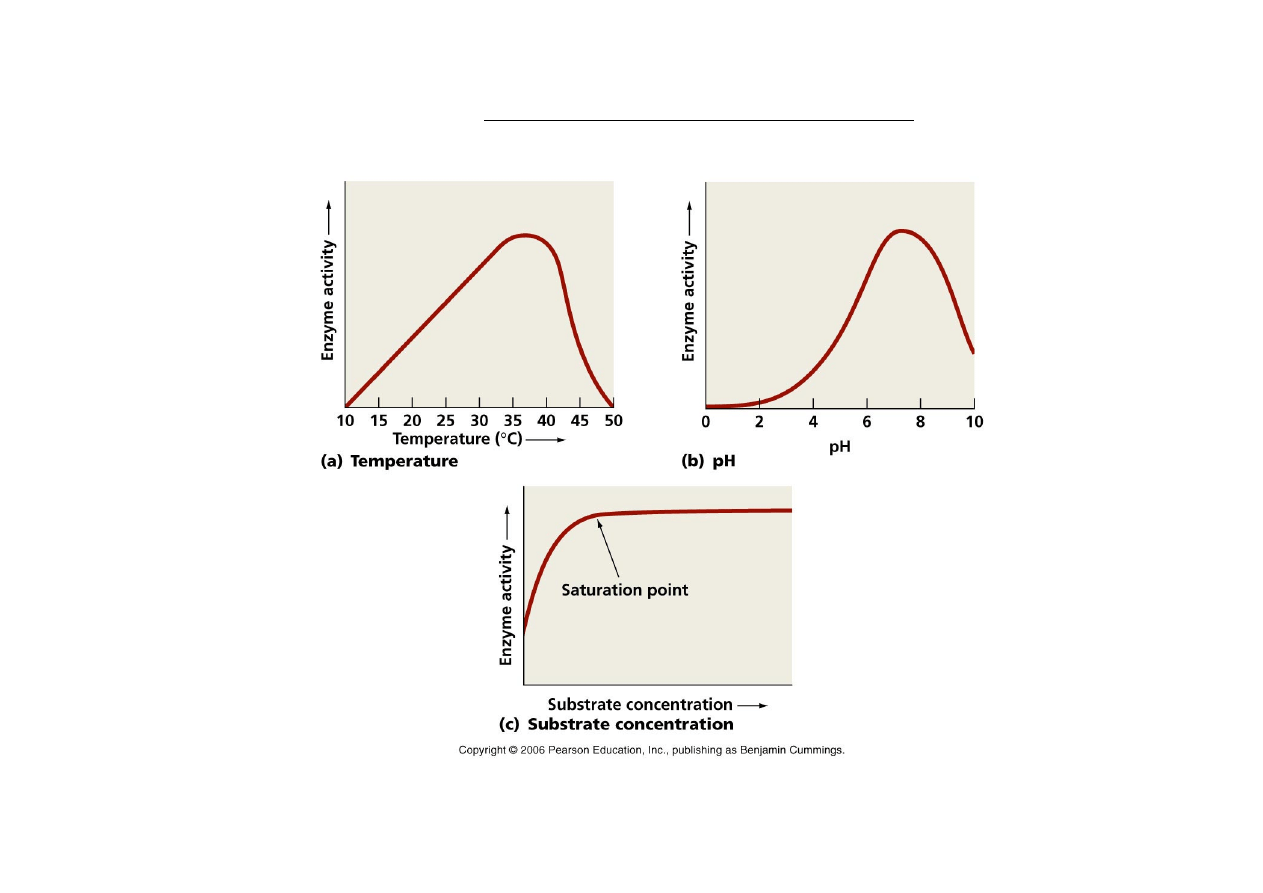
Kinetyka reakcji enzymatycznych
– wpływ podstawowych czynników
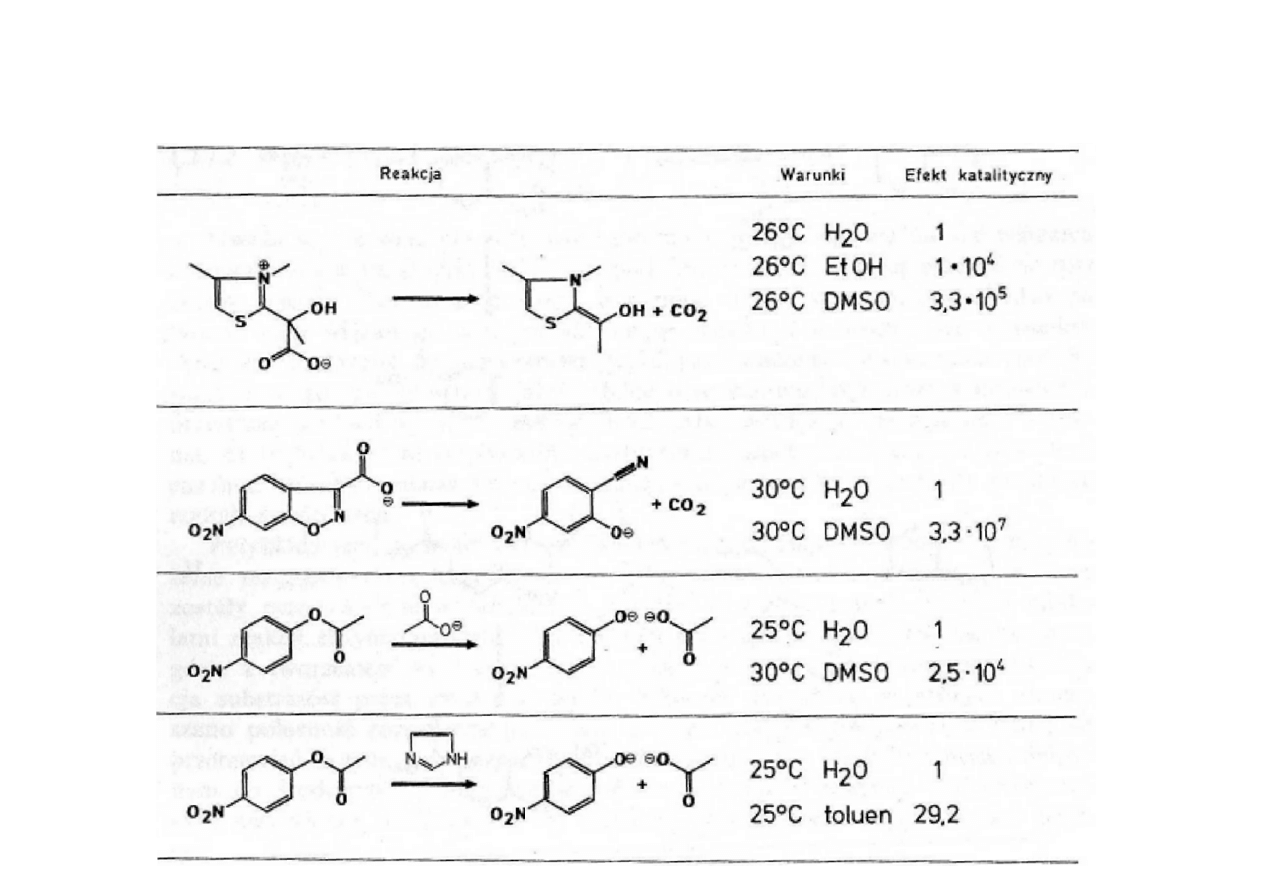
WPŁYW ŚRODOWISKA NA SZYBKOŚĆ REAKCJI
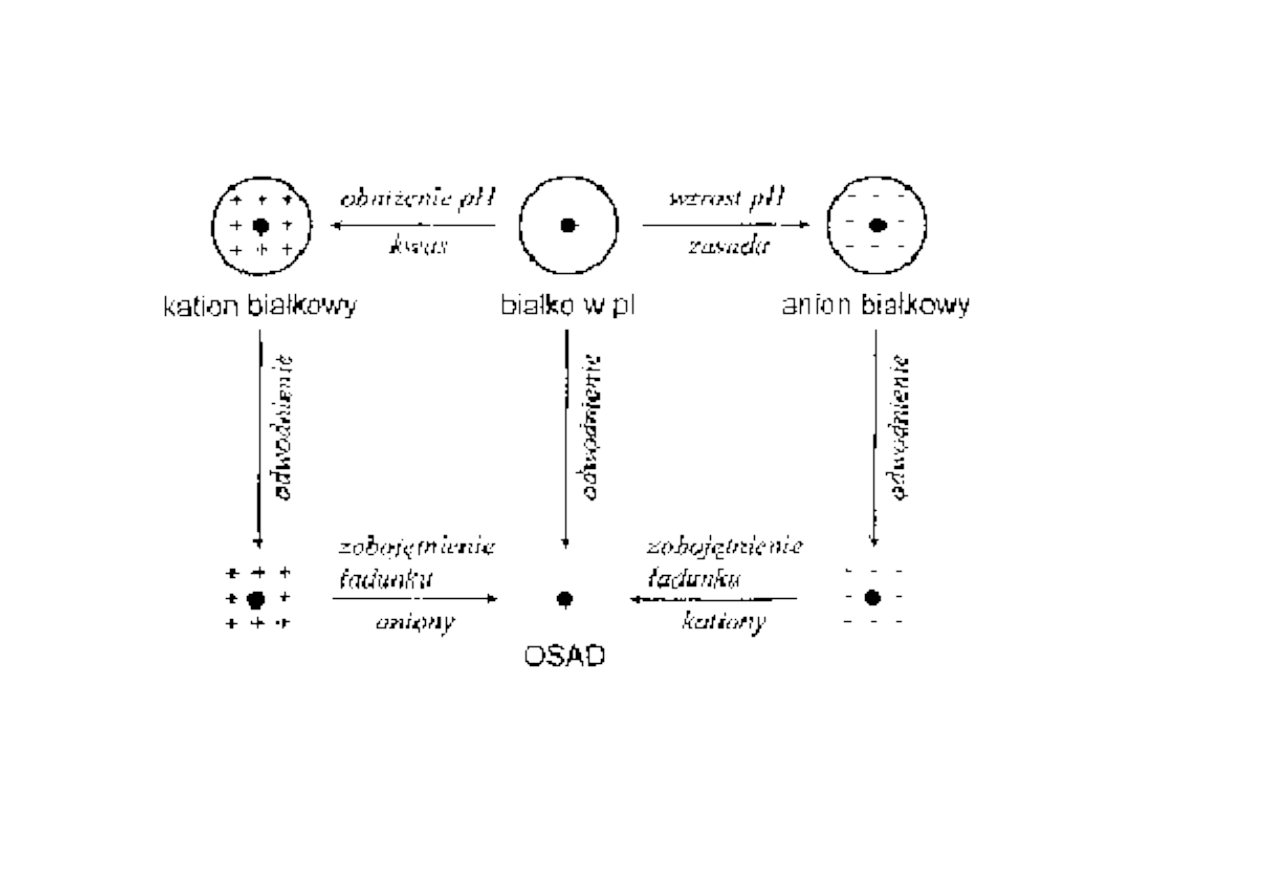
STĘŻENIE SOLI

Inne
czynniki
•
szybkość dyfuzji –
jest odwrotnie proporcjonalna od wielkości cząsteczek
(dla wody w temp. 25
0
C wynosi 2,27 10
-‐5
cm/s),
•
kształt i wielkość cząsteczek,
•
lepkość roztworu.
Działanie czynników regulujących potencjał oksydoredukcyjny środowiska
-‐ aktywacja enzymów zawierających w centrum
katalitycznym wolne grupy hydrosulfidowe –SH
-‐ aktywatory: substancje o niskim potencjale
oksydoredukcyjnym (reduktory) zwykle zawierające
grupy –SH, np.: cysteina, glutavon, merkaptoetanol
-‐ enzymy: papaina, dehydrogenaza alkoholowa i inne
Kinetyka reakcji enzymatycznych
wpływ innych czynników
Wyszukiwarka
Podobne podstrony:
Enzymologia wykłady ściąga
EnzymologiaTZ wyklad 4
Wyklad 1 z enzymologii, Studia, Przetwórstwo mięsa - Semestr 1, Enzymologia, Wykłady
Enzymologia wykład, V sem
Enzymologia wyklad 30 11
WYKŁAD 7, Studia Biologia, Enzymologia, wykłady
EnzymologiaTZ wyklad 7
enzymologia w8, studia, bio, 3rok, 6sem, enzymologia, enzymologia wykłady
WYKŁAD 3, Studia Biologia, Enzymologia, wykłady
wyklad w11, studia, bio, 3rok, 6sem, enzymologia, enzymologia wykłady
WYKŁAD 6, Studia Biologia, Enzymologia, wykłady
enzymologia w10, studia, bio, 3rok, 6sem, enzymologia, enzymologia wykłady
wykłady z enzymologii, Studia Biologia, Enzymologia, wykłady
enzymologia w7, studia, bio, 3rok, 6sem, enzymologia, enzymologia wykłady
Enzymologia wykłady ściąga
EnzymologiaTZ wyklad 4
EnzymologiaTZ wyklad 7
więcej podobnych podstron