
1
Opracował: Wojciech Augustyniak
Dr Wojciech Augustyniak
Pracownia Peptydów
Gmach Chemii – p. 230 (tel. wew. 509)
Gmach Radiochemii – p. 118, 122, 165, 169 (wew. 432), 115 (wew. 434)
Email: august@chem.uw.edu.pl
URL: www.chem.uw.edu.pl/people/WAugustyniak/
Proseminarium identyfikacji
związków organicznych
Polecana lektura:
„Ćwiczenia z organicznej analizy jakościowej i chemii bioorganicznej”
K. Bańkowski, A. Krawczyk, R. Siciński, J. Stępiński, A. Temeriusz
Wydawnictwa Uniwersytetu Warszawskiego, Warszawa 1990
2
Opracował: Wojciech Augustyniak
Stałe fizyczne charakteryzujące
związki organiczne
Temperatura topnienia – substancje stałe
Temperatura wrzenia – ciecze
Współczynnik załamania światła (szybkość światła w ośrodku/szybkość światła w próżni) –
refraktometr Abbego, pomiar w cieczach
Skręcalność właściwa – polarymetr, skręcalność właściwa [
α
D
t
], pomiar dla roztworów związków
czynnych optycznie
α
D
t
– skręcalność odczytywana
l – droga optyczna [dm]
c – wagowe stężenie procentowe [%]
c
l
]
[
t
D
t
D
∗
α
∗
=
α
100
3
Opracował: Wojciech Augustyniak
Oznaczanie składu pierwiastkowego
Spalanie w płomieniu palnika:
- związki organiczne zostawiają czarną pozostałość znikająca po prażeniu
- związki aromatyczne palą się kopcącym płomieniem
- związki zawierające metal pozostawiają popiół po prażeniu
Próba Beilsteina: wykrywanie chlorowców, zielona barwa płomienia po umieszczeniu w nim drucika
zanurzonego w substancji
Stapianie z sodem:
N – tworzy cyjanki; wykrycie – tworzenie błękitu pruskiego
S – tworzy Na
2
S; wykrycie – reakcja z solami Pb(II) lub z nitroprusydkiem sodu (purpurowe zabarwienie
roztworu)
Cl, Br, I – tworzą halogenki sodu; wykrycie – reakcja z AgNO
3
i rozpuszczanie osadu w roztworze
amoniaku, wykrycie I – reakcja z NaNO
2
z dodatkiem CCl
4
wykrycie Br – próba eozynowa (po reakcji z NaNO
2
i usunięciu jodu) z papierkiem fluoresceinowym,
w obecności bromu barwi się na różowo
6 CN
-
Fe
2+
Fe(CN)
6
4-
+
3 Fe(CN)
6
4-
4 Fe
3+
Fe
4
[Fe(CN)
6
]
3
+
2 I
-
2 NO
2
-
4 H
+
I
2
2 NO
2 H
2
O
+
+
+
+
2 Br
-
PbO
2
4 H
+
Br
2
Pb
2+
2 H
2
O
+
+
+
+
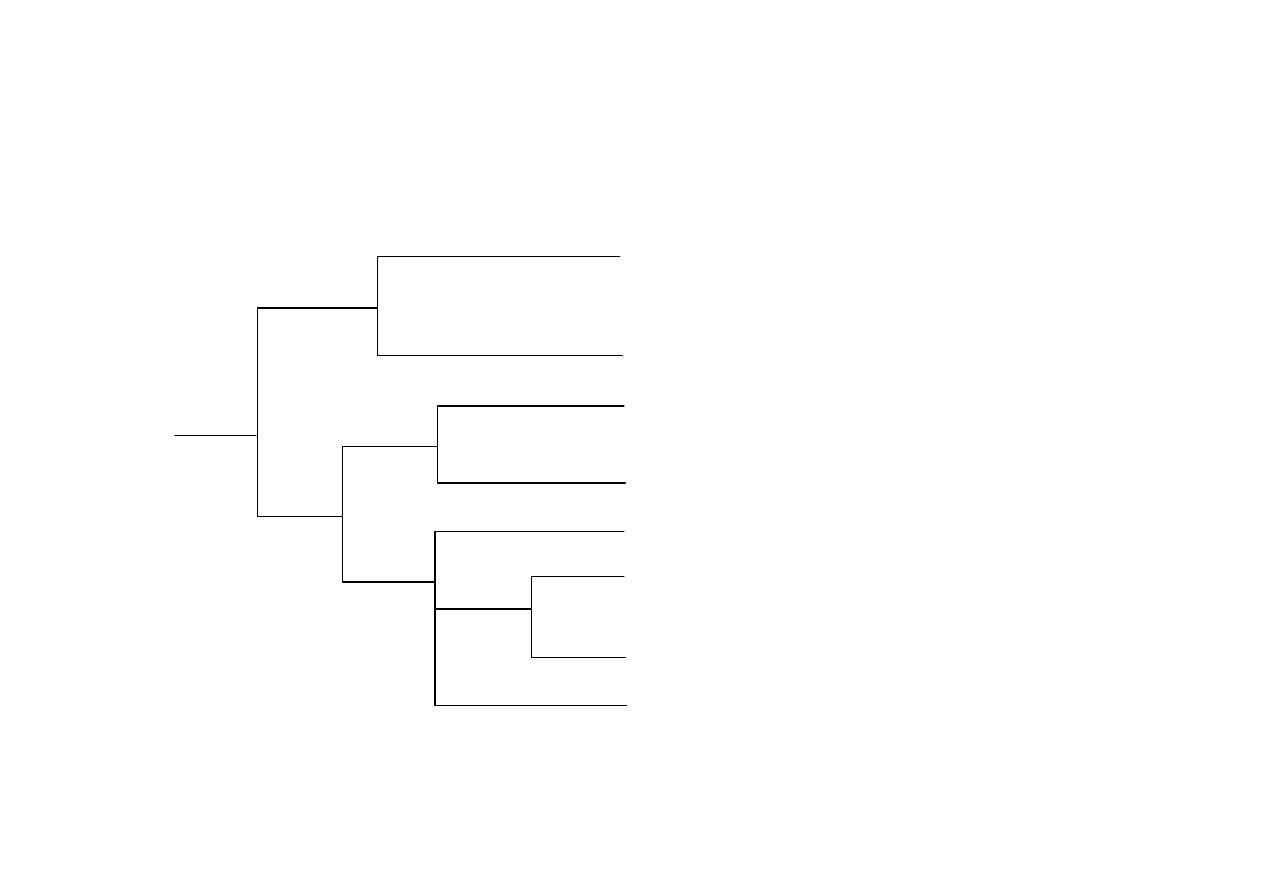
4
Opracował: Wojciech Augustyniak
Oznaczanie grupy rozpuszczalności
Niższe homologi: alkohole, aldehydy,
ketony, kwasy, estry, aminy, etc.
Kwasy wielokarboksylowe, glikole,
poliaminy, kwasy sulfonowe, sole
Mocne kwasy: kwasy
karboksylowe, sulfonowe
Słabe kwasy: fenole, tiole
Zasady: aminy
Węglowodory nienasycone
Węglowodory nasycone, aromatyczne
i ich chlorowcopochodne
Związki nitrowe, amidy, nitryle
woda
eter
rozp.
nierozp.
rozp.
rozp.
rozp.
nierozp.
nierozp.
nierozp.
nierozp.
rozp.
I
II
III A
III B
IV
V
VI
VII
NaOH
NaHCO
3
HCl
H
2
SO
4
zawiera N, S
rozp.
nierozp.

5
Opracował: Wojciech Augustyniak
Pochodne krystaliczne
Rozróżnienie związków ze względu na temperaturę topnienia pochodnej
Łatwe do otrzymania
Szybko można je wyizolować
Łatwa krystalizacja
Otrzymanie dużych, łatwych do wysuszenia kryształów
6
Opracował: Wojciech Augustyniak
Węglowodory
Nasycone i aromatyczne – VI grupa rozpuszczalności; nienasycone – V grupa
Wykrywanie układu aromatycznego:
reakcja Friedla-Craftsa z bezwodnym AlCl
3
daje barwne związki:
- związki jednopierścieniowe: czerwone bądź pomarańczowe
- dwupierścieniowe: czerwone lub niebieskie
- wielopierścieniowe: zielone
5 C
6
H
6
2 CHCl
3
AlCl
3
(C
6
H
5
)
3
CCl
(C
6
H
5
)
2
CH
2
5 HCl
+
+
+
Inne reakcje:
- Friedla-Craftsa z AlCl
3
i bezwodnikiem ftalowym (wykrycie - otrzymywanie kwasów
aroilobenzoesowych jako pochodnych krystalicznych)
- sulfonowanie (rozpuszczanie się związku w dymiącym kwasie siarkowym)
- nitrowanie (wykrycie - izolacja nitrozwiązku jako pochodnej krystalicznej)
- otrzymywanie krystalicznych adduktów z kwasem pikrynowym (jako pochodnych krystalicznych)
-utlenianie łańcucha bocznego za pomocą KMnO
4
(wykrycie – odbarwienie roztworu i izolacja kwasu
jako pochodnej krystalicznej)
Wykrywanie układów nienasyconych:
- próba Bayera – utlenienie wiązań podwójnych do glikoli i ketonów, odbarwienie KMnO
4
- reakcja addycji bromu – odbarwienie czerwonawego roztworu

7
Opracował: Wojciech Augustyniak
Chlorowcopochodne węglowodorów
Próby na reaktywność chlorowca:
Reakcja z etanolowym roztworem AgNO
3
(wytrącanie osadu halogenku srebra wg S
n
1):
- w temperaturze pokojowej: halogenki alkilowe trzeciorzędowe, allilowe, benzylowe, jodki alkilowe,
1,2-dibromozwiazki, sole, halogenki kwasowe
- po podgrzaniu: chlorki i bromki alkilowe
- brak reakcji: halogenki winylowe, chlorowcoareny, geminalne trichloropochodne, CCl
4
Reakcja z acetonowym roztworem NaI (wytrącanie halogenku sodu wg S
n
2):
- w temperaturze pokojowej: bromki pierwszorzędowe, halogenki allilowe i benzylowe
- po ogrzaniu: drugo- i trzeciorzędowe bromki, bromki allilowe, pierwszo- i drugorzędowe chlorki
allilowe
- z wydzielaniem jodu: 1,2-dichloro i dibromozwiązki
- brak reakcji: halogenki winylowe i arylowe, trzeciorzędowe chlorki alkilowe, geminalne
trichloropochodne, CCl
4
Pochodne krystaliczne:
- etery alkilowo-2-naftylowe (z 2-naftolanem sodu) i ich pikryniany
- dla związków aromatycznych: pochodne nitrowe, pikryniany, kwasy karboksylowe powstałe po
utlenieniu łańcucha bocznego

8
Opracował: Wojciech Augustyniak
Alkohole (1)
Wykrywanie grupy hydroksylowej:
- acetylowanie chlorkiem acetylu, wykrywanie – zapach estru
- reakcja z sodem, wykrywanie – pęcherzyki wodoru
Niższe homologi: I grupa rozpuszczalności, związki polihydroksylowe – II grupa,
wyższe homologi: V grupa
Rozróżnianie rzędowości alkoholi:
Próba Lucasa (wytrząsanie z roztworem ZnCl
2
w stężonym HCl, tworzenie chlorków alkilowych):
- roztwór klarowny (brak reakcji): alkohole pierwszorzędowe do pentanolu
- dwie rozdzielone, klarowne warstwy (brak reakcji): alkohole pierwszorzędowe wyższe, niż pentanol
- zmętnienie roztworu po kilku minutach, następnie rozdzielenie się faz: alkohole drugorzędowe i allilowe
- natychmiastowe zmętnienie roztworu, i rozdzielenie się faz: alkohole trzeciorzędowe i benzylowe
Odróżnienie alkoholi drugo- i trzeciorzędowych - reakcja ze stężonym HCl (wytrząsanie):
- roztwór klarowny: alkohole drugorzędowe (i pierwszorzędowe)
- zmętnienie po kilku minutach: alkohole trzeciorzędowe
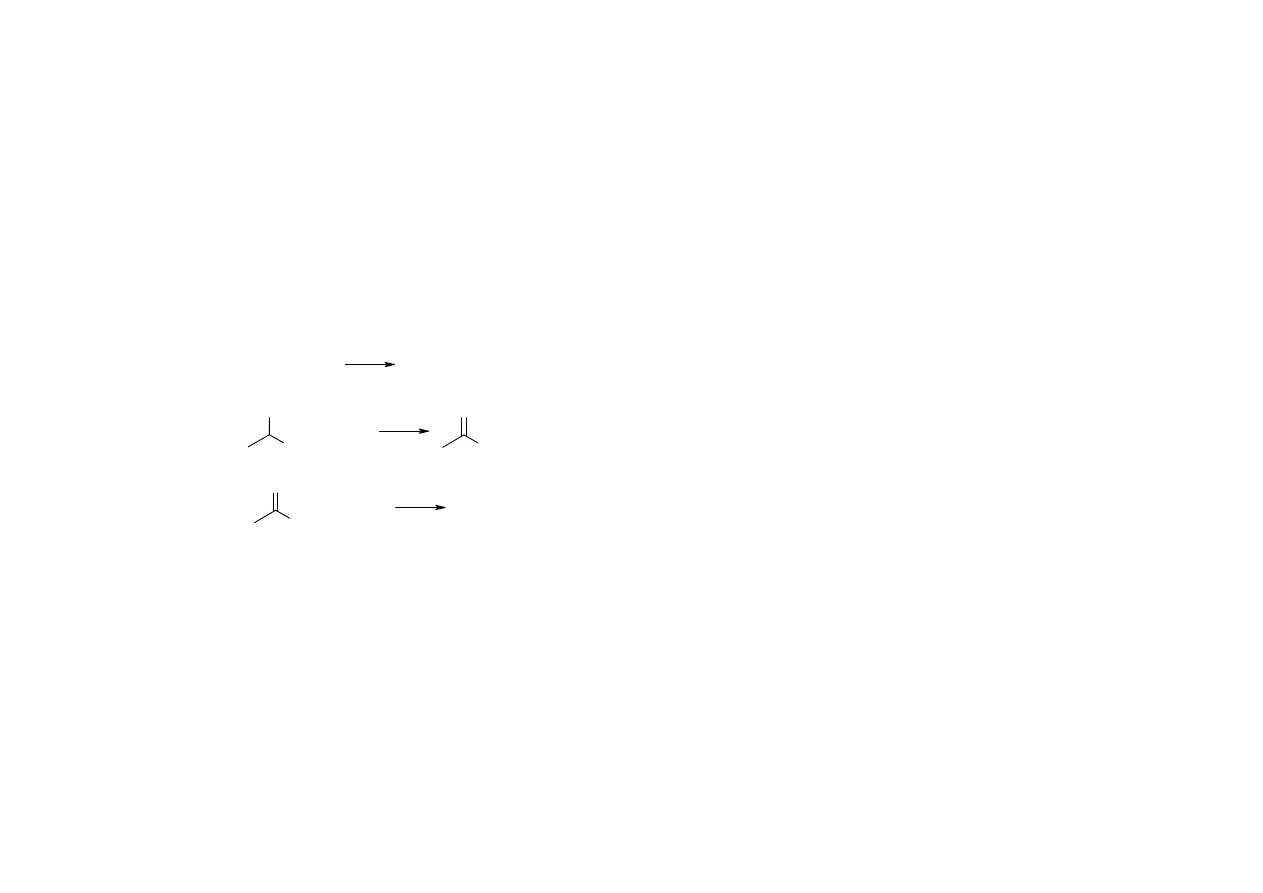
9
Opracował: Wojciech Augustyniak
Alkohole (2)
Próba jodoformowa z alkalicznym roztworem jodu, wykrywanie metylokarbinoli poprzez
wytrącenie żółtego osadu jodoformu
I
2
2 NaOH
H
2
O
NaOI
NaI
+
+
+
R
OH
R
O
NaOI
NaI
H
2
O
+
+
+
R
O
3 NaOI
CHI
3
RCOONa
2 NaOH
+
+
+
Pochodne krystaliczne: estry kwasu 3,5-dinitrobenzoesowego (synteza z SOCl
2
)

10
Opracował: Wojciech Augustyniak
Fenole i enole
Grupa rozpuszczalności III B, niekiedy (przy kilku podstawnikach II rodzaju) III A,
lub I (fenole polihydroksylowe)
Wykrywanie - reakcja z FeCl
3
:
- roztwór czerwonobrunatny: enole
- roztwór fioletowy, niebieski lub zielony: fenole
Reakcja z Br
2
na fenole: odbarwianie roztworu
Tworzenie barwników azowych fenoli z kwasem azotawym
Pochodne krystaliczne fenoli:
- estry kwasu 3,5-dinitrobenzoesowego
- kwasy aryloksyoctowe (otrzymywanie w środowisku zasadowym z kwasu chlorooctowego)

11
Opracował: Wojciech Augustyniak
Etery
V grupa rozpuszczalności; etery dwuarylowe - VI grupa
Wykrywanie tlenu - próba jodowa z I
2
:
- brązowe zabarwienie: związki tlenowe
- fioletowe zabarwienie: węglowodory i ich chlorowcopochodne
Pochodne krystaliczne eterów alkilowoarylowych:
- produkty rozszczepienia za pomocą HI (fenole i jodki alkilowe)
- nitropochodne
- pikryniany
- kwasy karboksylowe powstające z utlenienia alkilowych łańcuchów bocznych
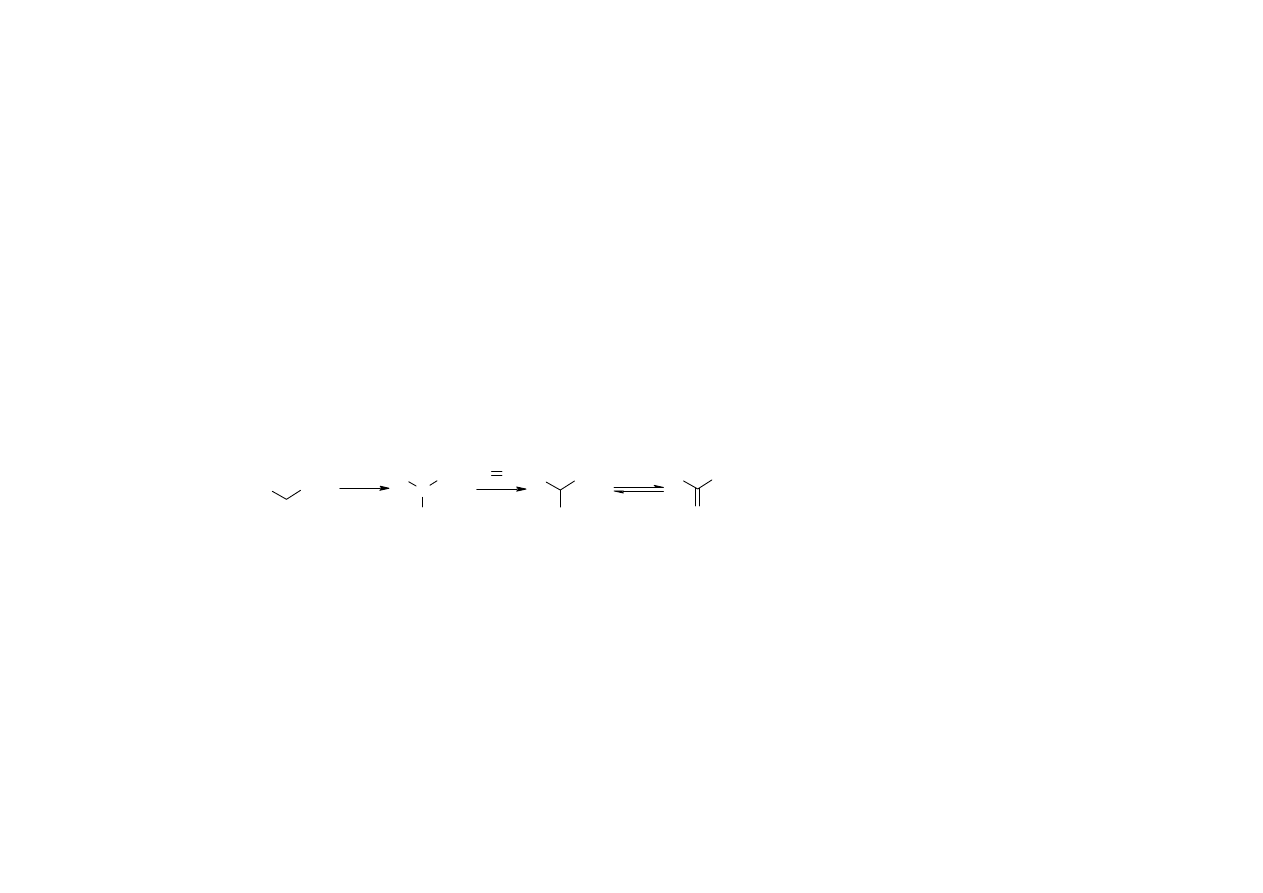
12
Opracował: Wojciech Augustyniak
Nitrozwiązki
Związki pierwszo- i drugorzędowe - III, związki trzeciorzędowe i aromatyczne - VII grupa
R
NO
2
R
C
H
NO
2
R
NO
2
NO
R
NO
2
NOH
N O
-
OH
-
+
Określanie rzędowości nitrozwiązków alifatycznych – reakcja z azotynami w środowisku
zasadowym:
- czerwone zabarwienie pojawiające się po dodaniu azotynu, znikające po zakwaszeniu: związki
pierwszorzędowe
- zabarwienie niebieskie pojawiające się po zakwaszeniu: związki drugorzędowe
- brak zmian: związki trzeciorzędowe
Pochodne krystaliczne:
- benzamidy utworzone przez pierwszorzędowe aminy powstałe po redukcji związków nitrowych
za pomocą Sn/HCl
- polinitrozwiązki
- kwasy karboksylowe powstałe przez utlenienie łańcuchów bocznych związków aromatycznych
13
Opracował: Wojciech Augustyniak
Aminy (1)
Homologi do 6 atomów węgla w cząsteczce – I grupa rozpuszczalności; wyższe homologi amin
alifatycznych i aminy monoaromatyczne – IV grupa; aminy di- i triaromatyczne – VII grupa
Sole amin – II grupa
Rozróżnianie rzędowości amin - reakcja z kwasem azotawym:
- roztwór klarowny, i) po dodaniu 2-naftolu uzyskuje się pomarańczową barwę, ii) po zagotowaniu
wydzielają się pęcherzyki gazu: pierwszorzędowa amina aromatyczna
ArNH
2
HNO
2
H
+
ArN
2
+
2 H
2
O
+
+
+
ArN
2
+
H
2
O
ArOH
N
2
+
+
- roztwór klarowny z wydzielaniem się gazu: pierwszorzędowa amina alifatyczna
RNH
2
HNO
2
H
+
RN
2
+
2 H
2
O
+
+
+
RN
2
+
H
2
O
R
+
N
2
+
+
R
N
H
R'
R
N
R'
NO
+
HNO
2
H
2
O
+
- żółty olej: amina drugorzędowa
- zielone zabarwienie: trzeciorzędowa amina
aromatyczna
NRR'
NRR'
ON
HNO
2
+
OH
OH
N
N
Ar
ArN
2
+
H
+
+
+
14
Opracował: Wojciech Augustyniak
Aminy (2)
Próby na rzędowość amin (cd) – wytrącenie p-toluenosulfonamidu z chlorkiem p-toluenosulfonylu
z kwaśnego roztworu i alkalizacja (próba Hinsberga):
- p-toluenosulfonamid rozpuszcza się po alkalizacji: amina pierwszorzędowa
- osad / olej nie rozpuszcza się po alkalizacji: amina drugorzędowa
- nie tworzy się p-toluenosulfonamid: amina trzeciorzędowa
SO
2
Cl
SO
2
NHR
SO
2
NR
RNH
2
-
+
OH
-
Krystaliczne pochodne:
- benzamidy, otrzymane z chlorku benzoilu w obecności pirydyny
- p-toulenosulfonamidy
- pikryniany
Próba na zasadowość amin: zobojętnianie kwasem wobec papierka uniwersalnego
Sole amin: tworzenie w reakcji z kwasem, odzyskiwanie aminy po alkalizacji
15
Opracował: Wojciech Augustyniak
Aldehydy i ketony
Wykrywanie grupy ketonowej - reakcja z 2,4-dinitrofenylohydrazyną (lub hydroksyloaminą)
w środowisku kwaśnym: wytrącanie żółtych kryształów 2,4-dinitrofenyloydrazonów
V grupa rozpuszczalności, poza aldehydami: mrówkowym, octowym i propionowym, oraz acetonem;
homologi zawierające więcej niż 9 atomów węgla nie rozpuszczają się w 85% H
3
PO
4
R
R'
O
NHNH
2
NO
2
O
2
N
NO
2
O
2
N
N
H
N
R
R'
H
2
O
+
+
Rozróżnianie aldehydów i ketonów - próba Tollensa z roztworem jonów diaminosrebrowych:
- tworzenie lustra srebrnego: aldehydy
- brak reakcji: ketony
Próba Fehlinga z winianowym kompleksem jonów Cu
2+
:
- wytrącanie czerwonego Cu
2
O: aldehydy alifatyczne i niektóre aromatyczne
- brak reakcji: niektóre aldehydy aromatyczne i ketony
Wykrywanie metyloketonów – próba jodoformowa z jodem w środowisku zasadowym, wytrącanie
żółtego jodoformu
Pochodne krystaliczne:
- 2,4-dinitrofenlohydrazony
- p-nitrofenylohydrazony
- semikarbazony (otrzymywane z chlorowodorku semikarbazydu H
2
NNHCONH
2
• HCl)

16
Opracował: Wojciech Augustyniak
Kwasy karboksylowe
Grupa rozpuszczalności – III A, niższe homologi i kwasy wielokarboksylowe – grupa I lub II
Próby na odczyn kwaśny – papierek uniwersalny, lakmusowy lub Kongo, zobojętnianie NaOH
wobec fenoloftaleiny
Wykrycie grupy karboksylowej - tworzenie estrów etylowych w stężonym H
2
SO
4
, wykrycie
zapachu estru
Pochodne krystaliczne:
- amidy otrzymywane z NH
3
i SOCl
2
- anilidy i p-toluidydy

17
Opracował: Wojciech Augustyniak
Halogenki i bezwodniki kwasowe
Niższe homologi – I lub III grupa rozpuszczalności; wyższe – V grupa
Halogenki kwasowe – wykrywanie chlorowca – reakcja z AgNO
3
i identyfikacja halogenu
w wytrąconym osadzie
Hydroliza:
- barwienie wilgotnego papierka uniwersalnego na czerwono: chlorek kwasowy
- obojętny odczyn wodnego roztworu na zimno, kwaśny po ogrzaniu: bezwodnik kwasowy
Próba hydroksamowa – tworzenie kwasów hydroksamowych z hydroksyloaminą
tworzących kompleksy z jonami Fe
3+
o czerwonym zabarwieniu
Pochodne krystaliczne: anilidy i p-toluidydy

18
Opracował: Wojciech Augustyniak
Estry, amidy i nitryle
Estry: grupa rozpuszczalności – V, niższe homologi – I lub II grupa
Amidy: grupa VII, niższe homologi – I lub II grupa, imidy i niektóre kwaśne amidy – III B
Nitryle: grupa VII, niższe homologi – I lub II grupa
Identyfikacja estrów:
- owocowy zapach
- tworzenie kwasów hydroksamowych z hydroksyloaminą (próba wykonywana po negatywnych
testach na aldehydy i ketony)
Pochodne krystaliczne estrów:
- uzyskane po uprzedniej zasadowej hydrolizie: kwas karboksylowy i ester kwasu
3,5-dinitrobenzoesowego alkoholu
- hydrazyd kwasu karboksylowego uzyskany po hydrazynolizie estrów
Pochodne krystaliczne amidów: kwas karboksylowy i pochodne amin uzyskanych po
zasadowej lub kwaśnej hydrolizie amidu
Wykrywanie amidów pierwszorzędowych i nitryli: hydroliza zasadowa z wydzieleniem NH
3
Pochodne krystaliczne nitryli:
- amid pierwszorzędowy uzyskany po częściowej kwaśnej hydrolizie
- kwas karboksylowy uzyskany po całkowitej hydrolizie
19
Opracował: Wojciech Augustyniak
Aminokwasy i peptydy
Grupa rozpuszczalności - II
Aminokwasy białkowe – szereg
L
, konfiguracja S (wyjątki: cysteina i glicyna)
Aminokwasy mają wysokie temperatury topnienia ze względu na swój jonowy charakter
Identyfikacja aminokwasów – reakcje na grupę karboksylową i aminową, np. próba
ninhydrynowa, niebieskie zabarwienie rozworu (prolina – żółte)
O
O
O
R
NH
2
COOH
O
N
OH
O
O
2
RCHO
CO
2
3 H
2
O
+
+
+
+
Pochodne krystaliczne aminokwasów: N-benzoilopochodne
Identyfikacja peptydów – reakcja biuretowa, granatowe zabarwienie roztworu w obecności Cu
2+

20
Opracował: Wojciech Augustyniak
Sacharydy
Mono- i oligosacharydy – II grupa rozpuszczalności; polisacharydy nie rozpuszczają się w wodzie
Identyfikacja – reakcja Molisha z α-naftolem z dodatkiem stężonego H
2
SO
4
,
czerwonofioletowa barwa na styku kwasu z resztą roztworu; w podobnej reakcji
z tymolem roztwór ma barwę czerwoną
Sacharydy są czynne optycznie
Wykrywanie cukrów redukujących: reakcje Fehlinga i Tollensa, wykrywanie aldoz i ketoz
Pochodne krystaliczne: osazony tworzone w reakcji z fenylohydrazyną
R
O
OH
R
N
N
N
H
C
6
H
5
N
H
C
6
H
5
3 C
6
H
5
NHNH
2
C
6
H
5
NH
2
NH
3
2 H
2
O
+
+
+
+
Wyszukiwarka
Podobne podstrony:
ANALIZA ORGANICZNA
Tok jakościowej analizy organicznej, Farmacja ŚUM, II ROK, Chemia organiczna, Chemia organiczna, Ćwi
Analiza organizacyjnych patologii
ANALIZA ORGANICZNA 2010
Analiza organizacji metodą H J Leavitta(Żabka Polska S A )
05 Analizowanie organizacyjno – prawnych podstaw pracy
EKONOMICZNE ANALIZY W OPIECE ZDROWOTNEJ, Medycyna, Zdrowie Publiczne & Organizacja i ekonomika w och
Analiza klasyczna związku organicznego I 2012
analiza zwiazkow organiczna id Nieznany (2)
analiza związku, chemia, organiczna
Analiza reklamy, technik organizacji reklamy, Dokumenty - Organizacja Reklamy
Analiza klasyczna związku organicznego II 2012
Analiza otoczenia organizacji, Analiza otoczenia organizacji-wykłady
Metody organizacji i zarządzania, BCG, Analiza i projektowanie portfela produkcji za pomocą macierzy
Analiza otoczenia organizacji W 3 03 2013
więcej podobnych podstron