
Mechanizmy reakcji
organicznych

1. Jak rozpocząć pisanie mechanizmu reakcji
2. Reakcje polarne zachodzące w warunkach zasadowych
3. Reakcje polarne w warunkach kwaśnych
4. Reakcje pericykliczne
5. Reakcje wolnorodnikowe
6. Reakcje promowane lub katalizowane metalami
7. Metody badania mechanizmów reakcji

1. Jak rozpocząć pisanie mechanizmu reakcji
•
Obrazowanie mechanizmów reakcji za pomocą strzałek
•
Kwasowość i zasadowość Brønsteda
•
Kinetyka i termodynamika (profile energii)
•
Kontrola kinetyczna i termodynamiczna w reakcjach organicznych
•
Klasyfikacja przemian w chemii organicznej
•
Klasyfikacja mechanizmów reakcji chemicznych


Chemia organiczne jest dziedziną nauki która bada jak substancje
organiczne są przekształcane od substratów w produkty

Mechanizmy reakcji organicznych są
opisami dróg
przekształcania substratów w produkty. Cząsteczki z takimi
samymi grupami funkcyjnymi reagują
wedle podobnych
mechanizmów. Na podstawie mechanizmów znanych reakcji
można przewidzieć zachowanie się podobnych cząsteczek w
analogicznych warunkach. Mechanizmy reakcji są więc tym co
łączy podobne reakcje. Znając je, można wyjaśnić sposób
powstawania produktów znanych reakcji, a także przewidzieć
reaktywność cząsteczek organicznych.
Science 31 Vol. 317 no. 5842 pp. 1189-1192
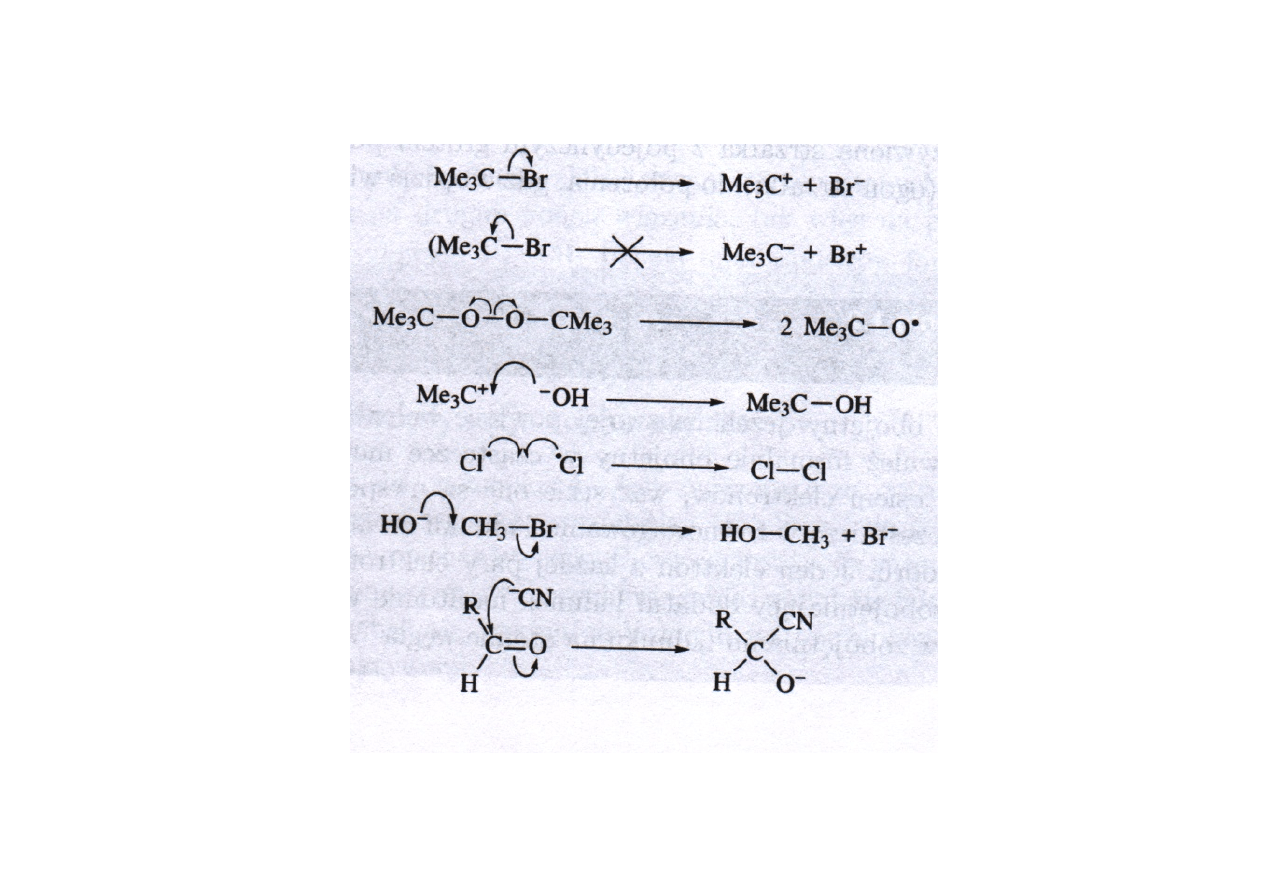
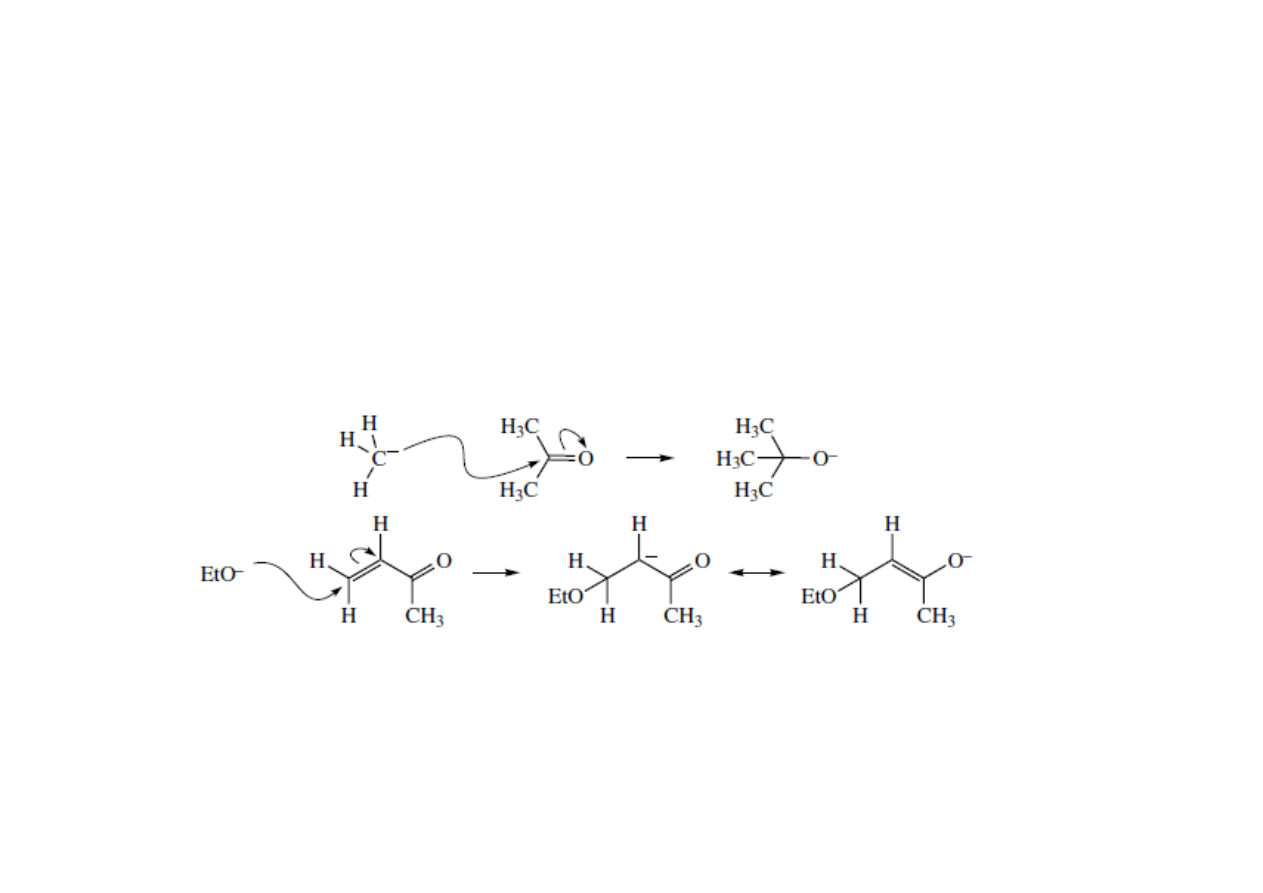
Obrazowanie mechanizmów reakcji za pomocą strzałek
Wygięta strzałka przedstawia ruch pary elektronowej z orbitalu zapełnionego na pusty
Gdy nukleofil atakuje
niewiążący orbital jedna
strzałka obrazuje
powstawanie nowego
wiązania, a druga
pęknięcie starego
Zachowanie ładunku na każdym etapie reakcji
Elektrony mogą być dostarczane
również z wiązania π. Strzałka
zaczyna się w środku wiązania π.
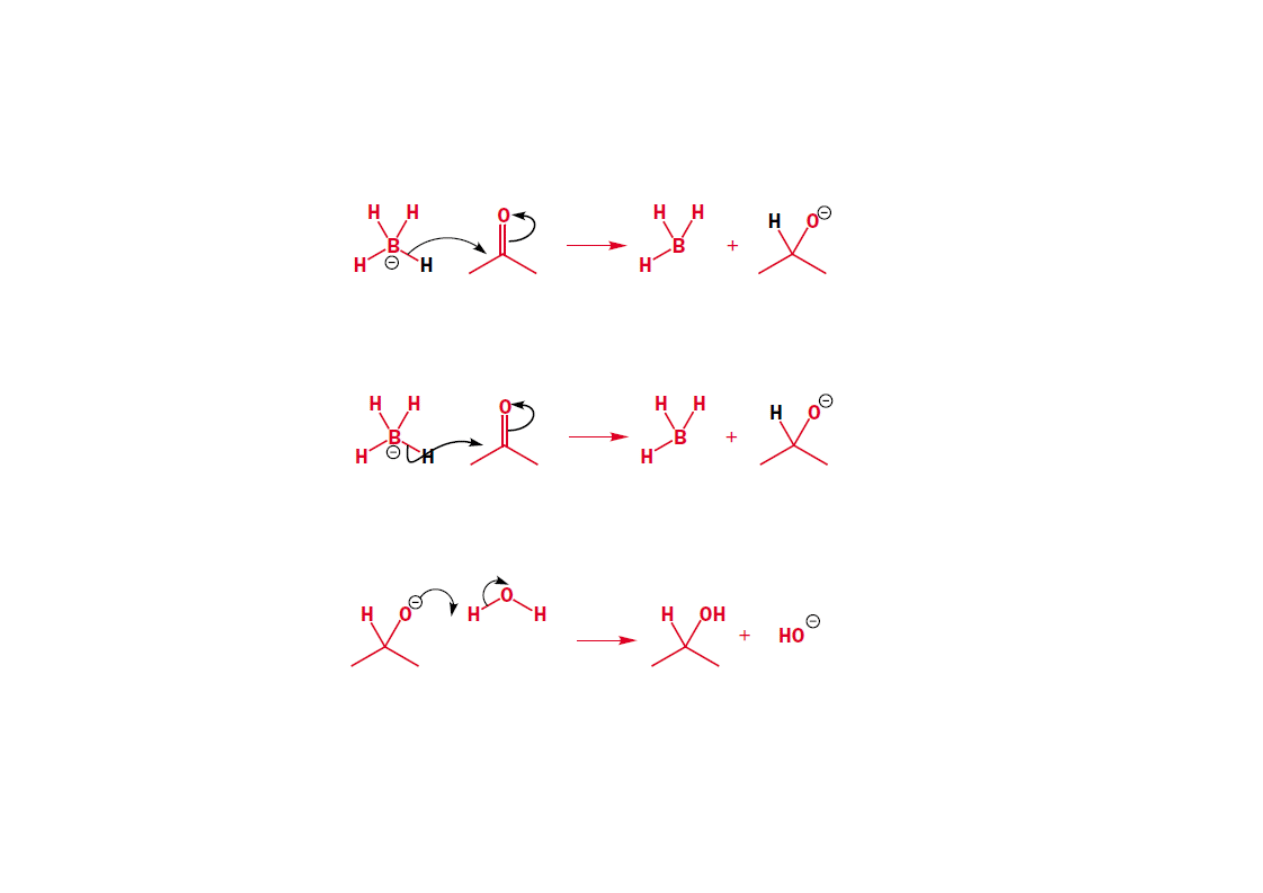
Zachowanie ładunku na każdym etapie reakcji
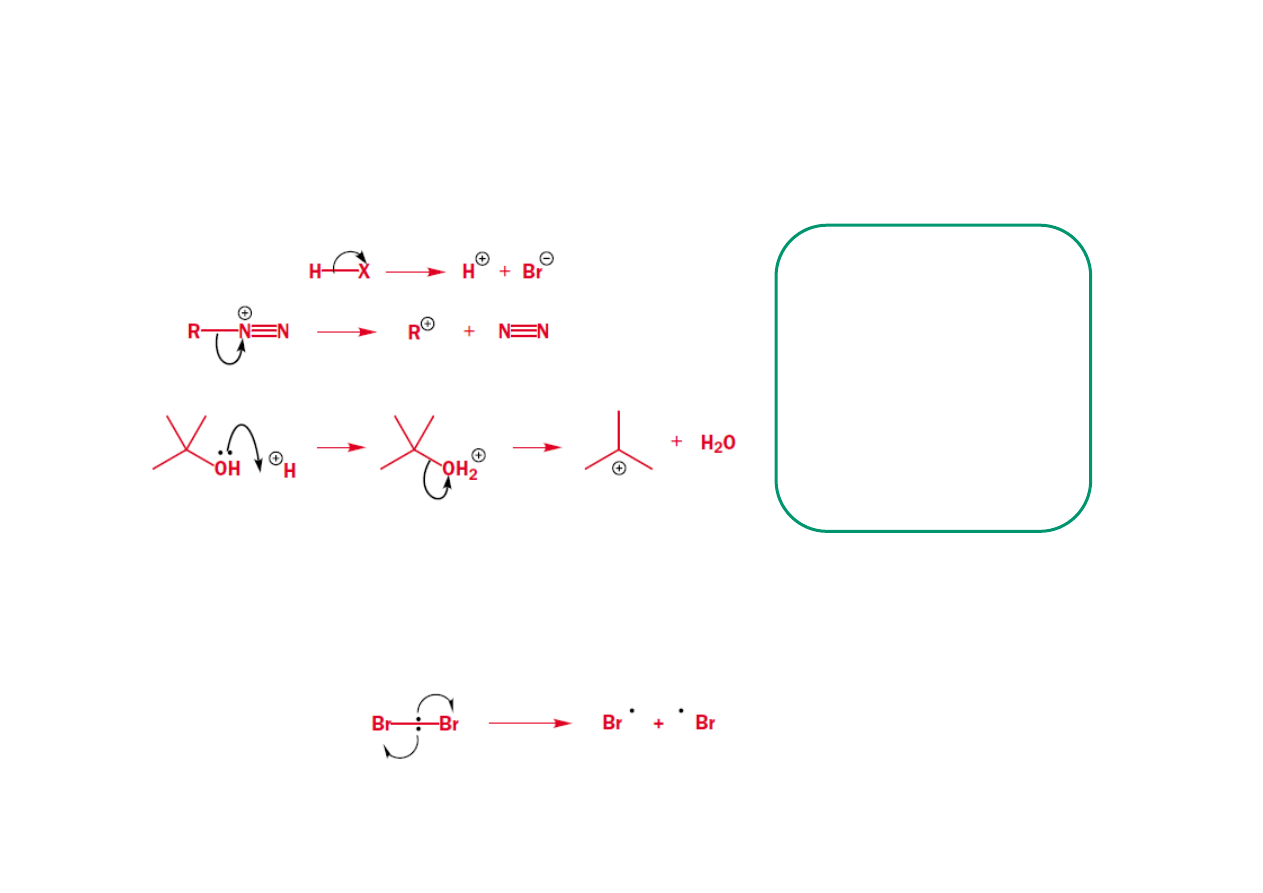
Rozpad cząsteczek
Spontaniczny rozpad cząsteczek - przyczyna – słabe spolaryzowane wiązanie σ
Grupy funkcyjne, które
„oddalają się” z
elektronami z wiązania σ
(Br, N
2
+
, OH
2
+
) są zwane
grupami opuszczającymi,
a tego typu rozpad
określamy jako
rozczepienie
heterolityczne
Homolityczne rozczepienie – tworzenie rodników
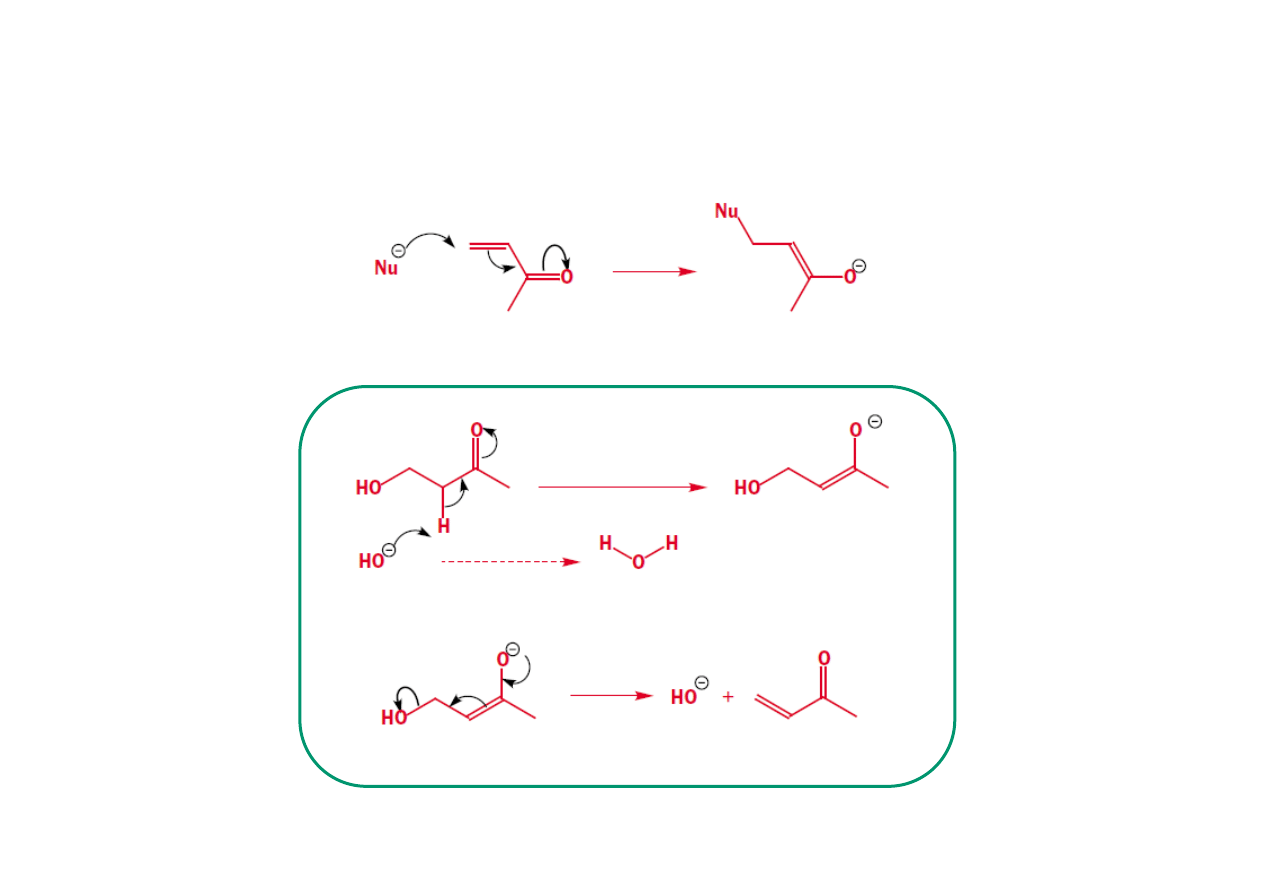
Przemieszczanie elektronów wewnątrz cząsteczki

Podsumowanie. Co oznaczają wygięte strzałki:
•
Wygięta strzałka pokazuje ruch pary elektronowej
• Początek strzałki wskazuje źródło pary elektronowej, którym może być zapełniony
orbital HOMO lub wolna para elektronowa wiązania π lub σ.
• Grot strzałki pokazuje miejsce przemieszczenia pary elektronów, którym może być
elektroujemny atom, który w wyniku tego przemieszczenie zyskuje ładunek ujemny
(grupa opuszczająca), pusty orbital, gdy tworzone jest nowe wiązanie lub niewiążący
orbital (σ* lub π*), gdy wiązanie jest przerywane.
• Zachowany jest sumaryczny ładunek.

Wskazówki do samodzielnego pisanie mechanizmów reakcji
(Clayden str. 131)
• Ustal strukturę każdego reagenta.
• Ustal, który atom jest nukleofilowy, a który elektrofilowy.
• Zaznacz wolną parę na nukleofilowym atomie.
• Wygięte strzałki zawsze rysuj w tym samym kierunku.
• Jeśli tworzysz nowe wiązanie z H, C, N lub O musisz zerwać już istniejące wiązanie.
• Zaznacz wyraźnie ładunki w reagentach i produktach pośrednich.
• Upewnij się, że ładunek całkowity w Twoim mechanizmie jest zachowany.


Kwasowość i zasadowość Brønsteda
• Kwasem jest substancja wykazująca skłonność do utraty protonu
• Zasadą jest substancja wykazująca skłonność do przyłączenia protonu
• Zasady mogą być anionowe lub neutralne, a kwasy neutralne bądź
kationowe
• Reakcje kwasowo zasadowe są reakcjami równowagowymi
• Kwas i zasadę mamy po obu stronach reakcji równowagowej
• Reakcja transferu protonu jest reakcją bardzo szybką szczególnie gdy proton
jest transferowany z jednego heteroatomu na drugi
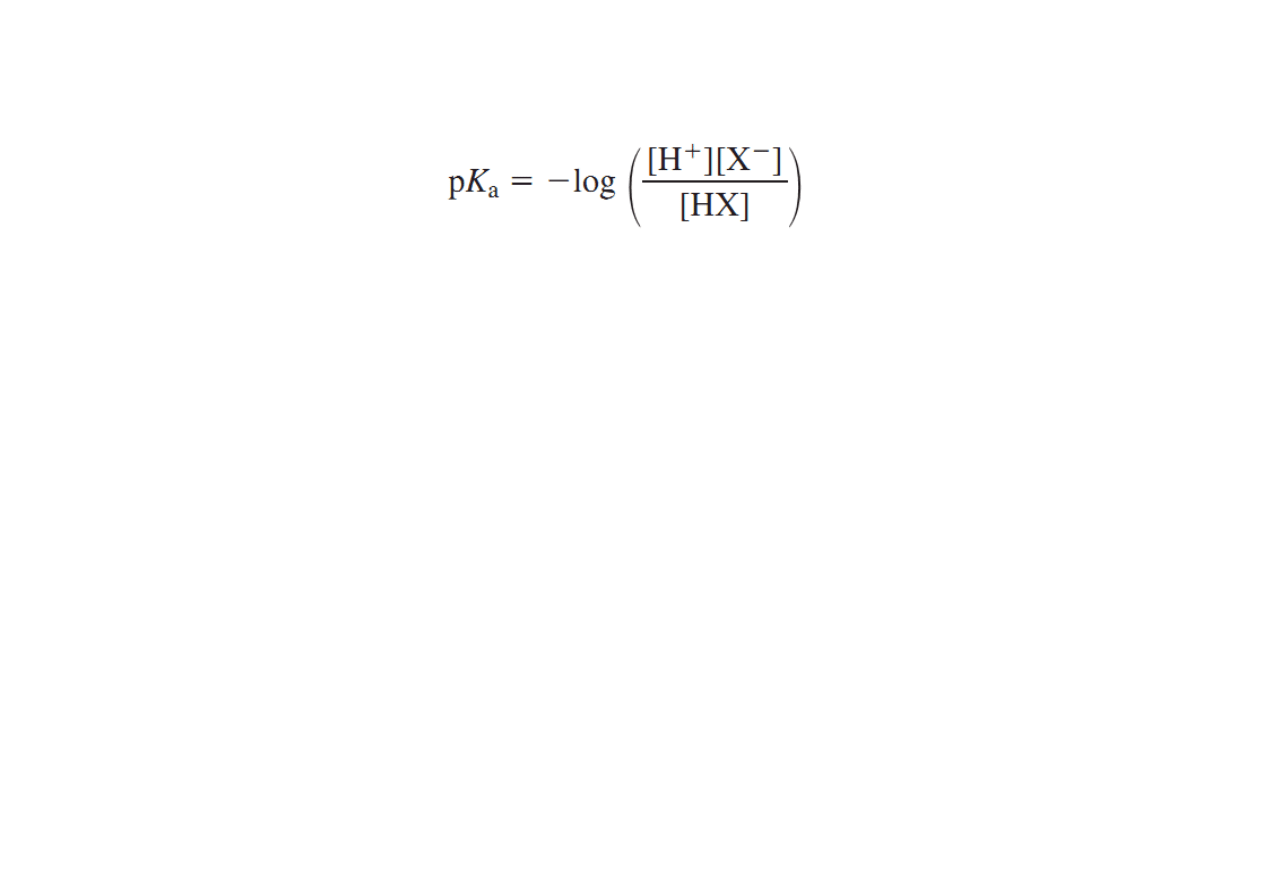
Wartość pKa określa, jak bardzo kwasowy (lub jak mało) jest dany
atom wodoru w rozpatrywanym związku. Jest to bardzo
użyteczne, ponieważ w sytuacji, gdy pierwszym etapem reakcji
jest protonowanie lub deprotonowanie jednego z substratów,
trzeba wiedzieć, w którym miejscu związek ten może być
protonowany bądź deprotonowany i jak mocny kwas lub zasada
będzie tu potrzebna.
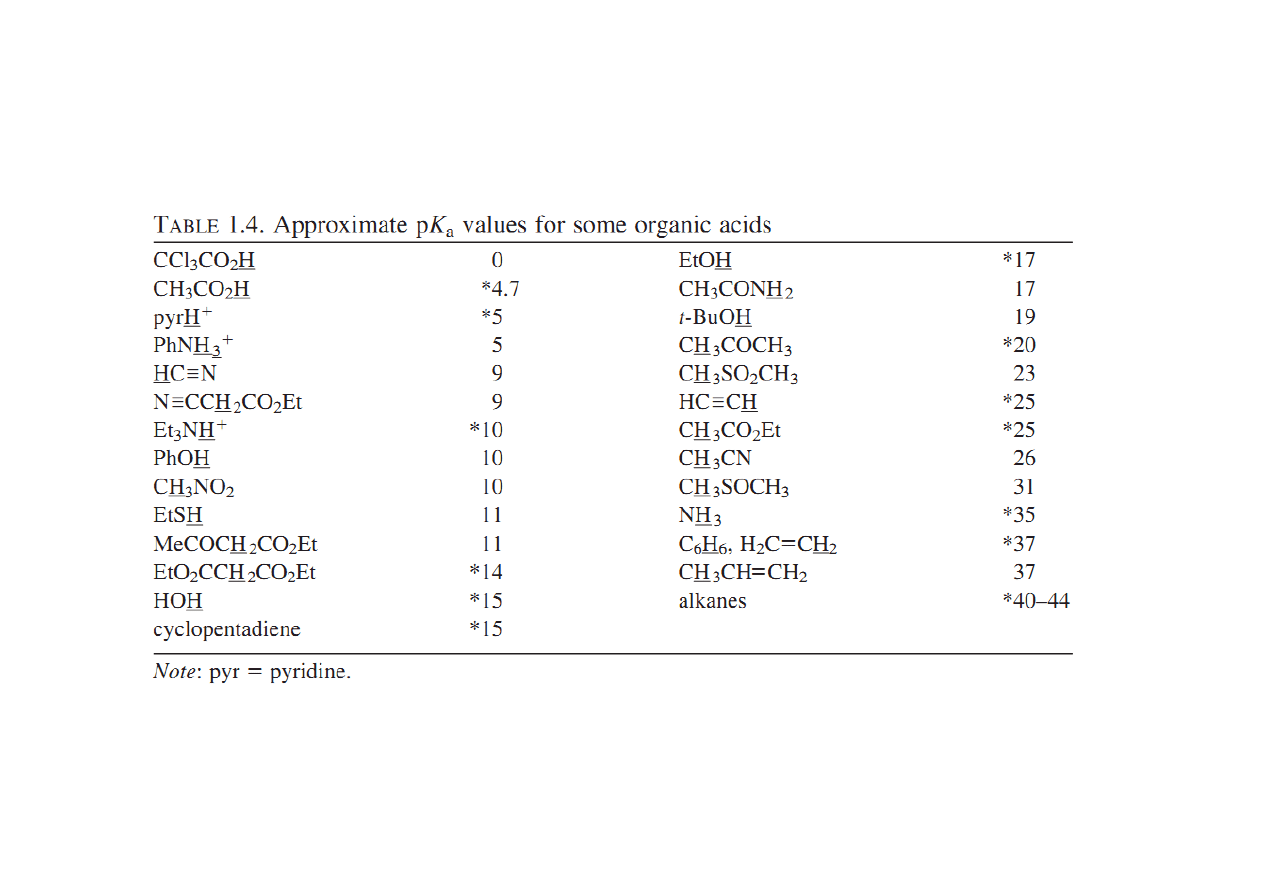
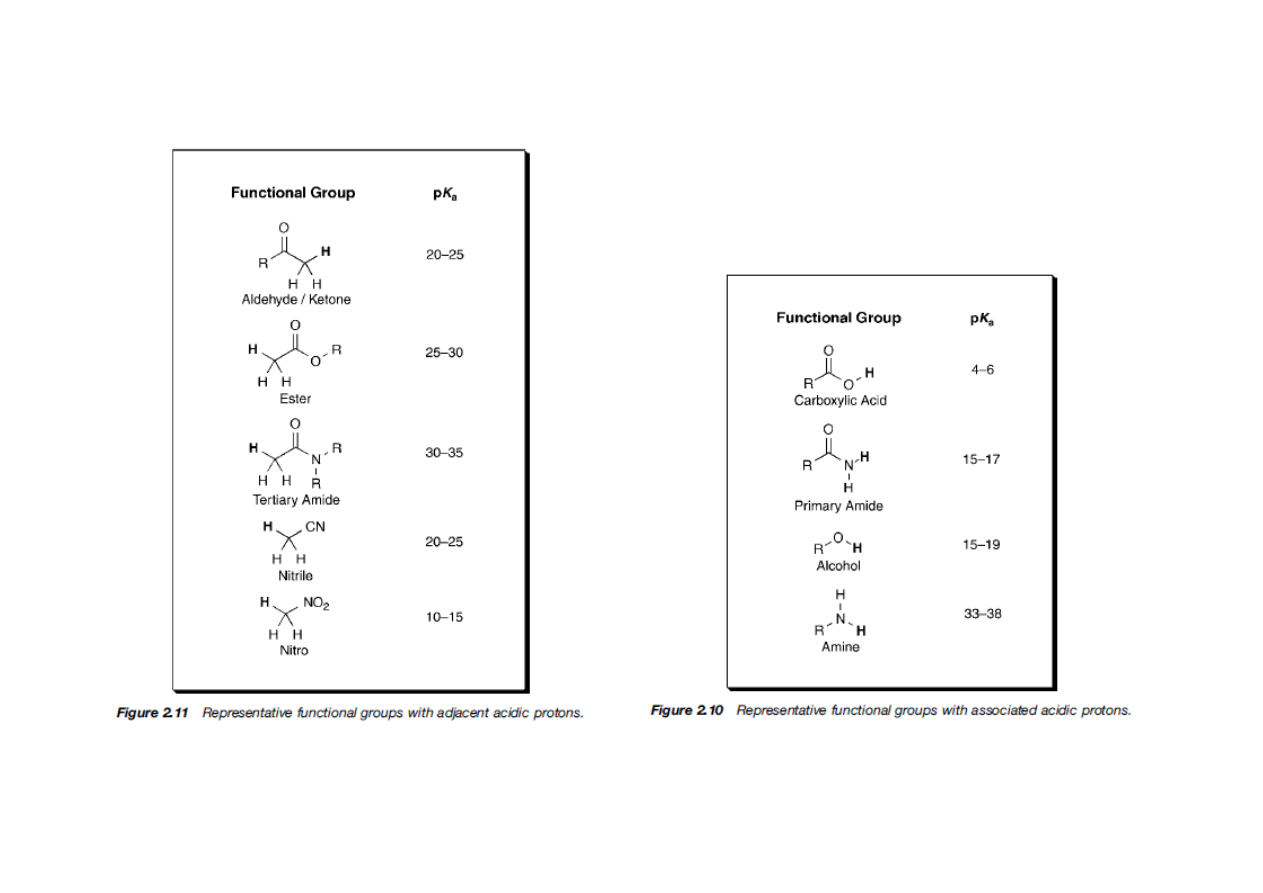
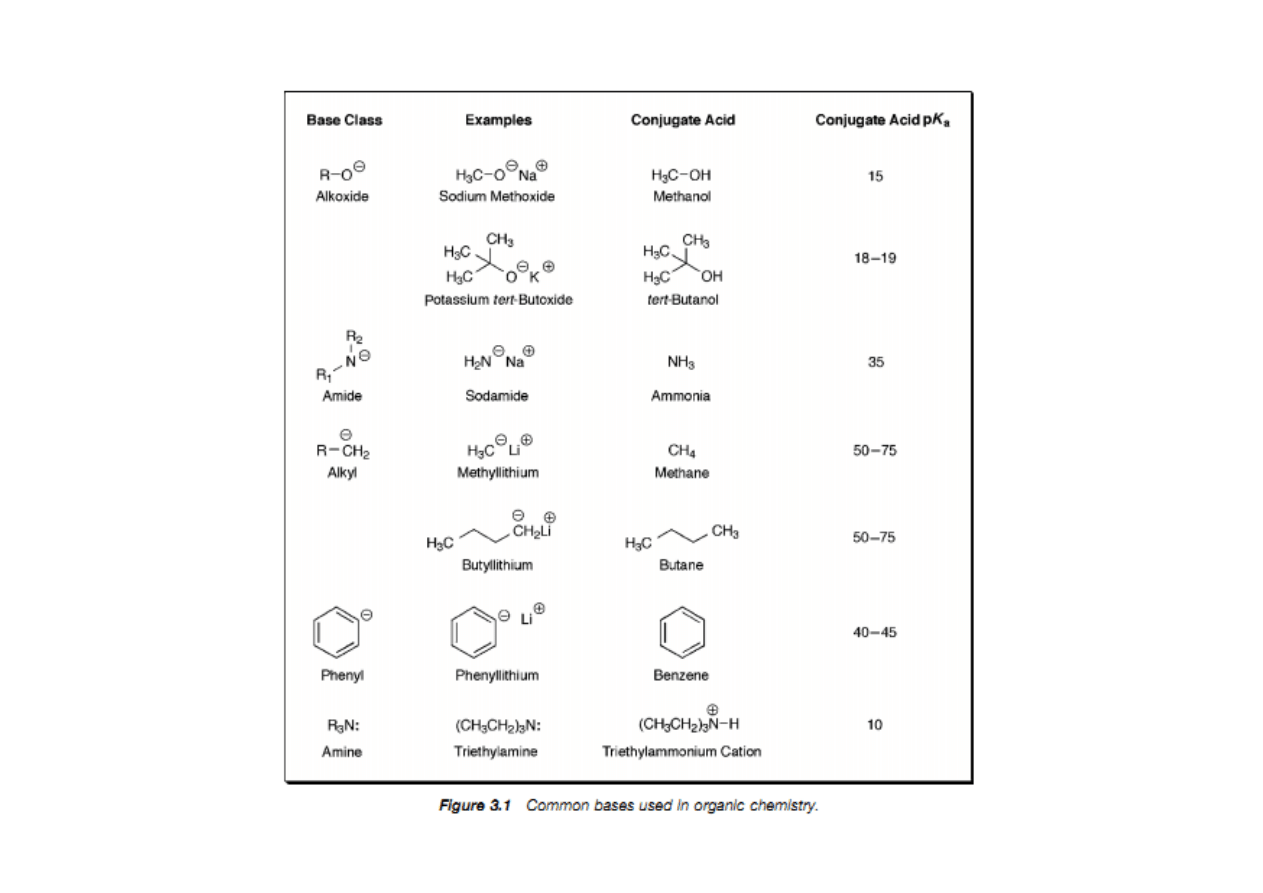
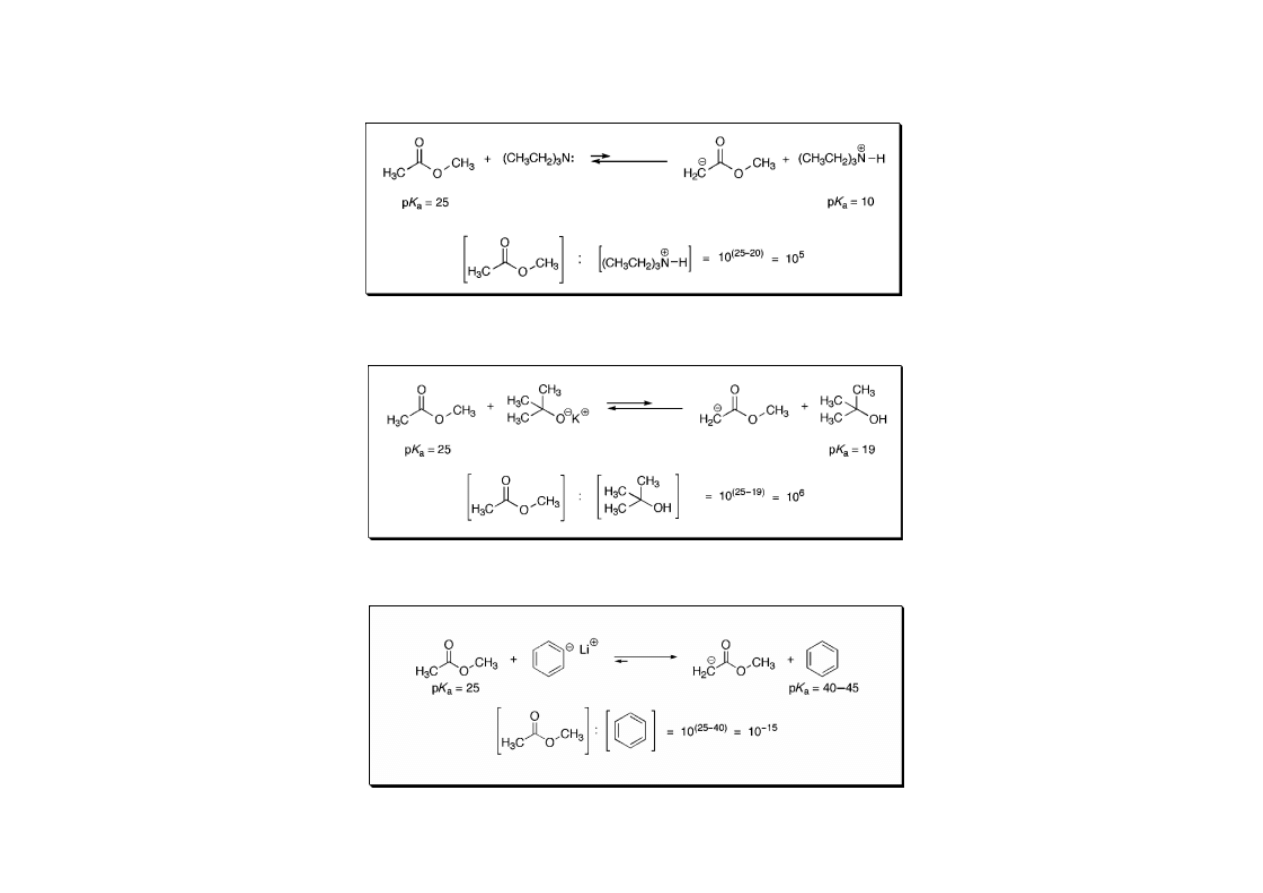

Do zapamiętania:
• Kwasowość wzrasta wraz ze wzrostem elektroujemności (porównaj: H
3
CH, H
2
NH,
HOH)
• Kwasowość wzrasta idąc w dół układu okresowego (porównaj: EtOH z EtSH). Jest to
prawdopodobnie spowodowane słabym nakładaniem się małych orbitali wodoru z
rosnącymi walencyjnymi orbitalami atomów, z którymi jest połączony.
• Kwasowość związku HA wzrasta kiedy indukcyjnie elektronoakceptorowe grupy są
połączone z A ,a maleje gdy grupy elektronodonorowe są połączone z A (porównaj
CCl
3
COOH z CH
3
COOH, i HOH z EtOH).
• Dla neutralnych kwasów, kwasowość maleje ze wzrostem zawady przestrzennej
(porównaj EtOH, t-BuOH).
• Kwas (HA) jest zdecydowanie bardziej kwaśny kiedy wolna para sprzężonej zasady
jest stabilizowana przez rezonans (porównaj: PhOH z EtOH i CH
3
CH=CH
2
z
alkanami). HA jest wyjątkowo kwaśny gdy wolna para jest delokalizowana z jedną lub
dwoma grupami karbonylowymi.
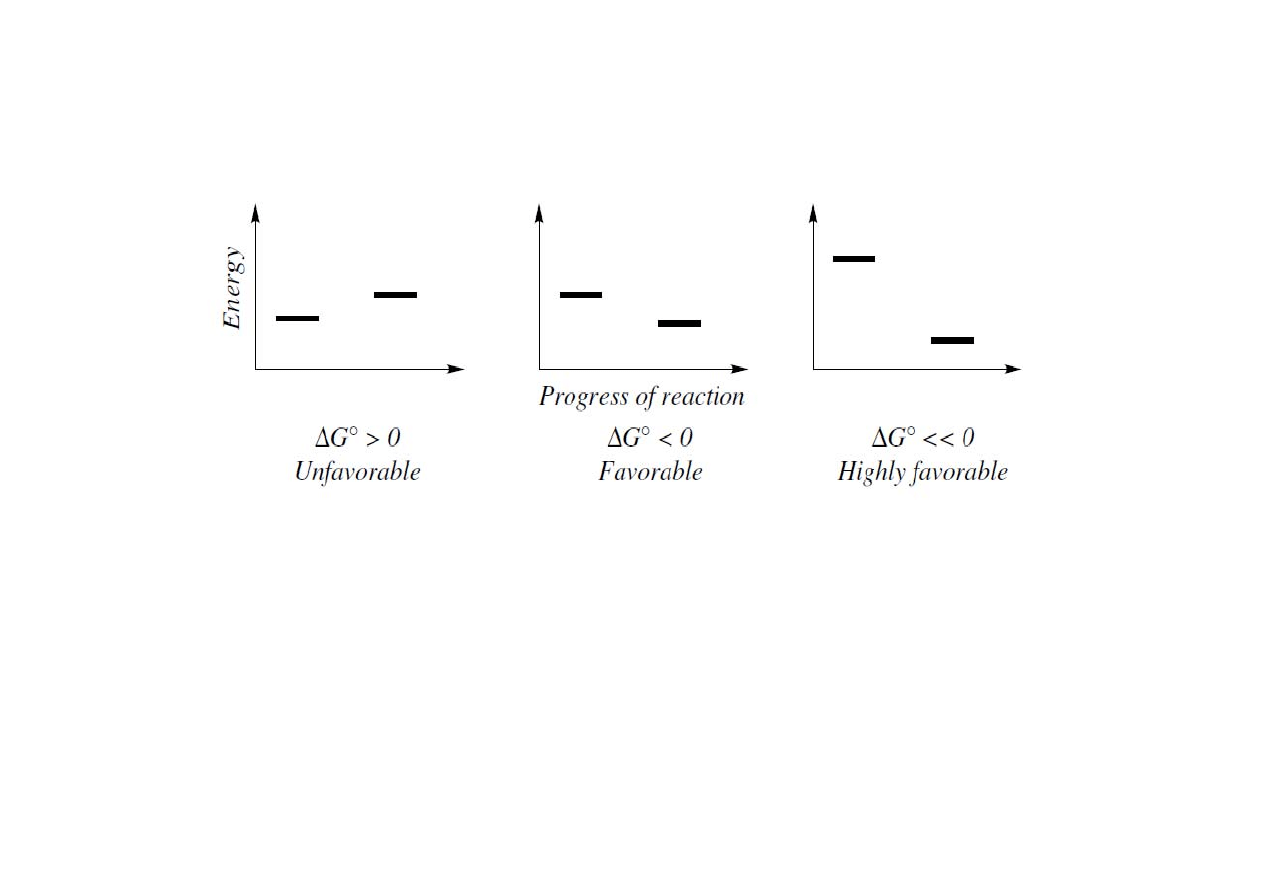
Kinetyka i termodynamika (profile energii)
• reakcja faworyzowana lub utrudniona
Reakcja jest uprzywilejowana gdy energia swobodna jest mniejsza od zera.
Energia swobodna jest zależna od entalpii (∆H) i entropii (∆S), ∆G
o
= ∆H
o
-T∆S
o
. W
praktyce to entalpie nie energie swobodną wykorzystuje się do określenia czy
reakcja jest preferowana czy nie. Reakcja z ∆H
o
< 0 jest egzotermiczna, ∆H
o
> 0
endotermiczna.
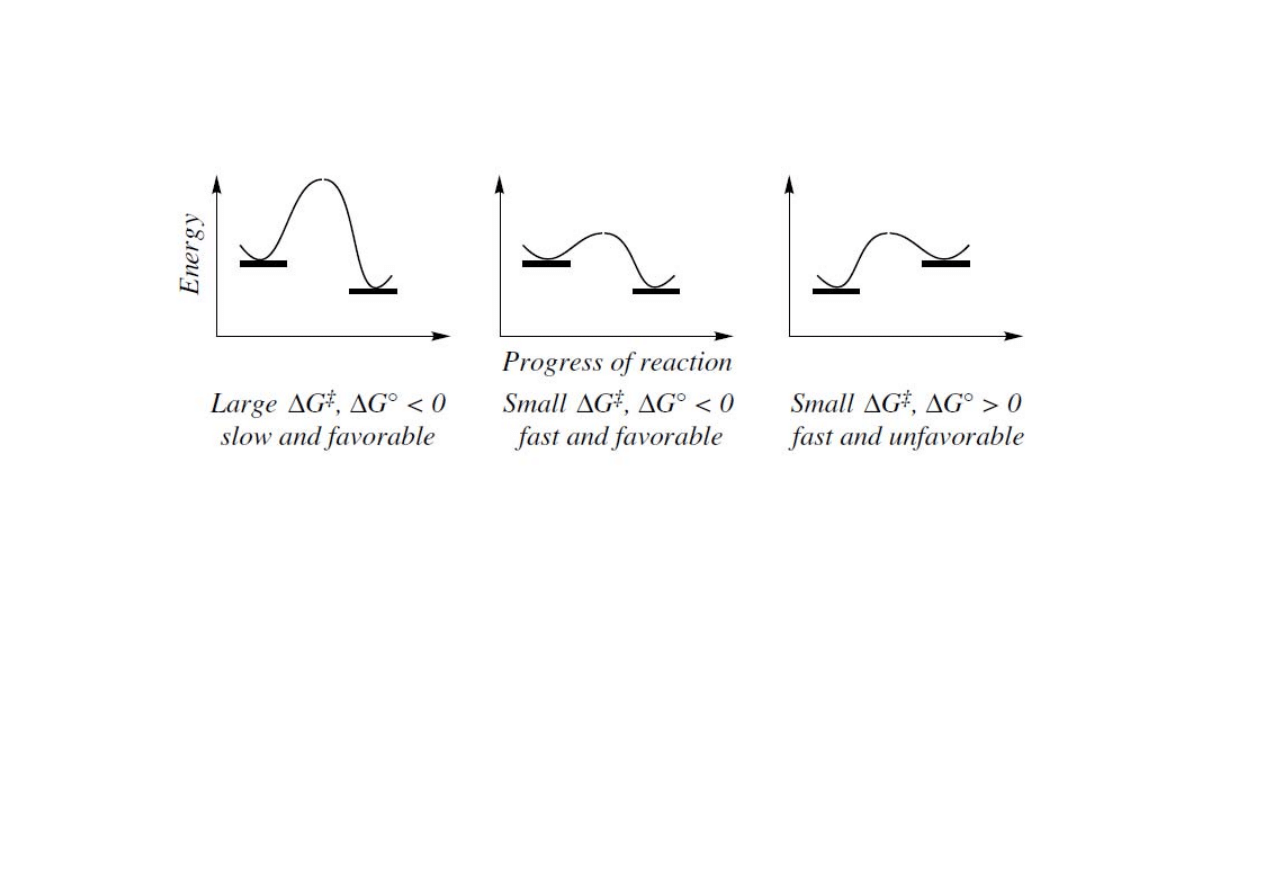
Kinetyka i termodynamika
•
reakcja szybka czy wolna
Substraty po przekroczeniu bariery energetycznej przechodzą w produkty. Energia
potrzebna by substraty osiągnęły szczyt bariery energetycznej to energia aktywacji,
a szczyt bariery, w którym reagenty mogą równie łatwo wrócić do substratów lub
przejść do produktów nazywamy stanem przejściowym. Szybkość reakcji jest
zależna od wielkości bariery aktywacji.
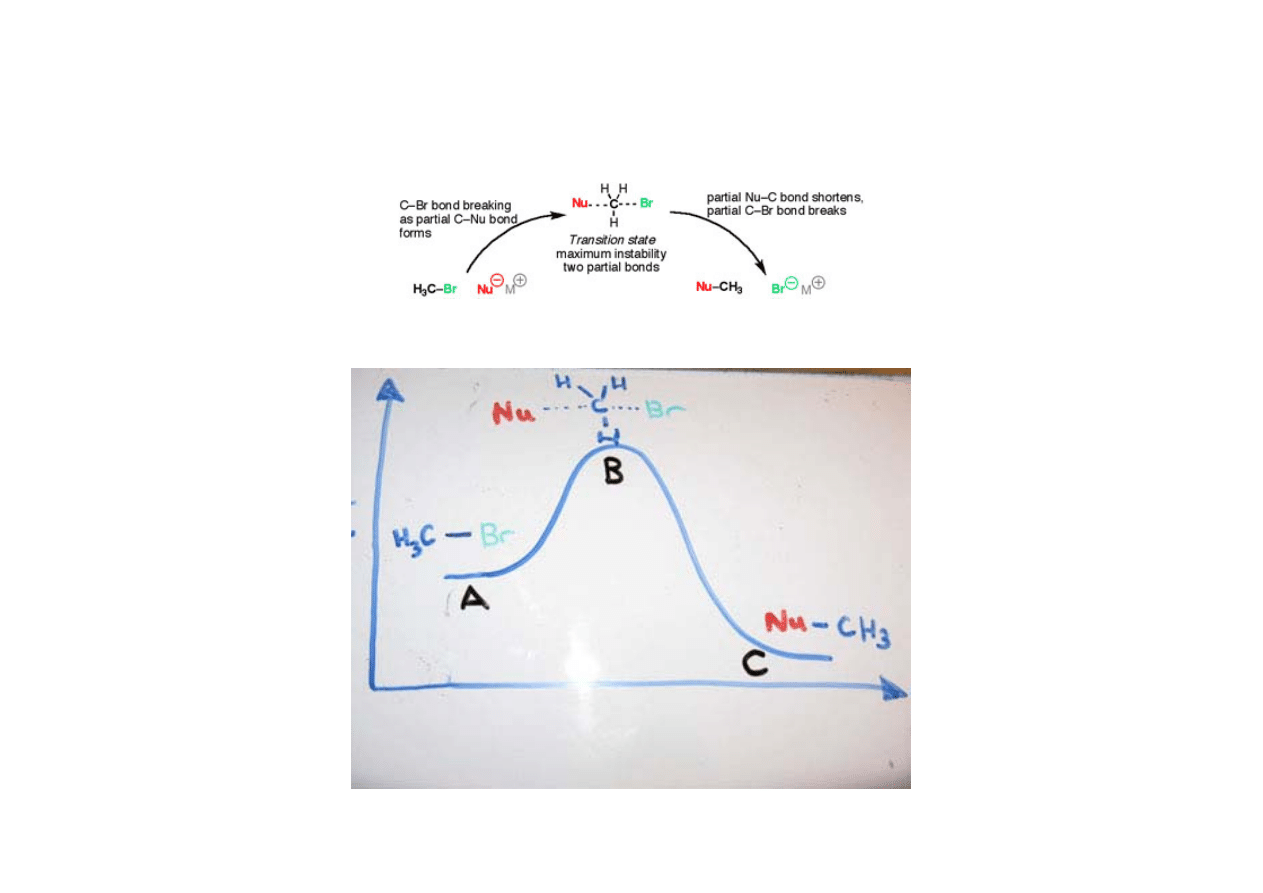
Kinetyka i termodynamika
•
stan przejściowy
Kinetyka i termodynamika
•
stan przejściowy
Kinetyka i termodynamika
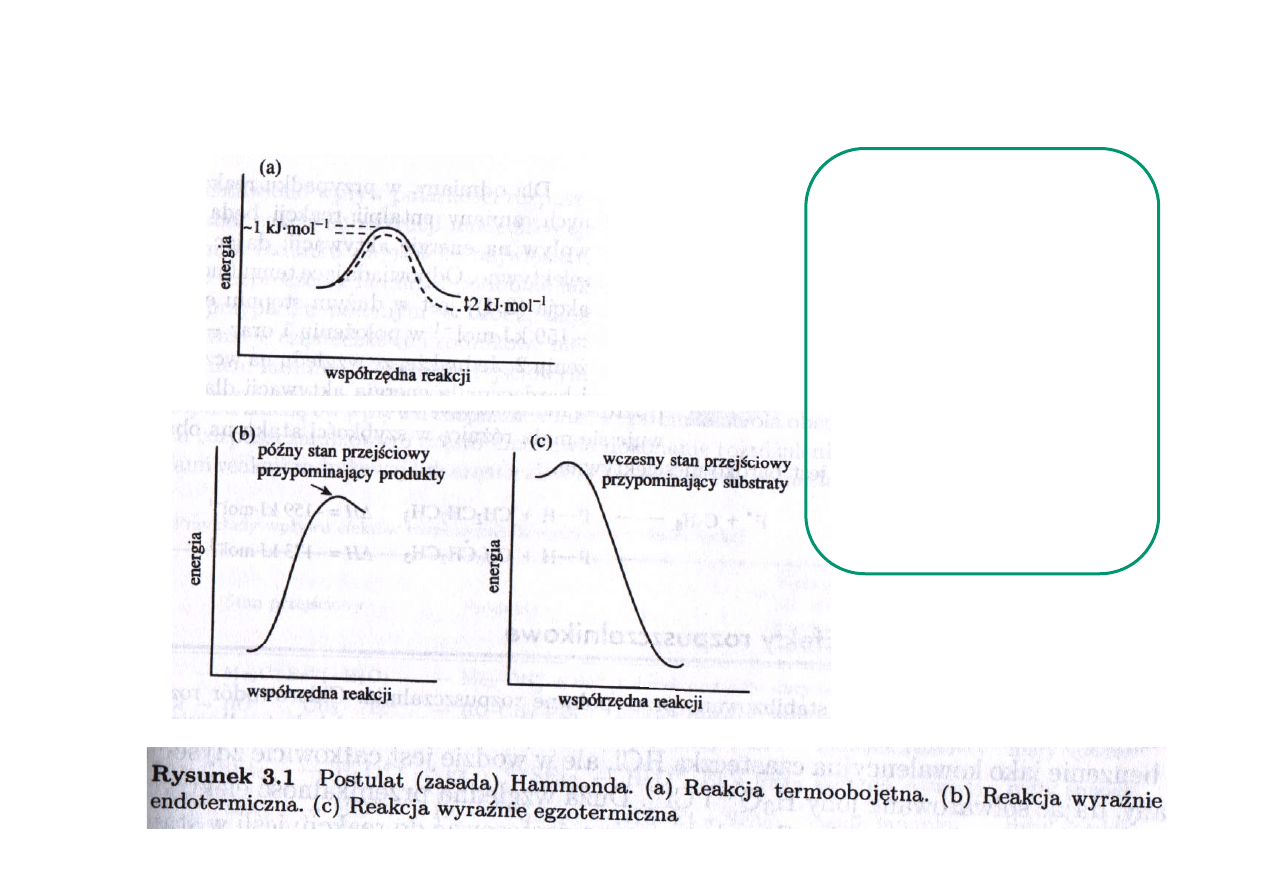
•
postulat Hammonda (wczesny i późny stan przejściowy)
Reakcje silnie egzotermiczne
charakteryzują się wczesnym
stanem przejściowym i
wykazują małą selektywność.
Reakcje silnie endotermiczne
charakteryzują się późnym
stanem przejściowym i
wykazują wysoką
selektywnością.
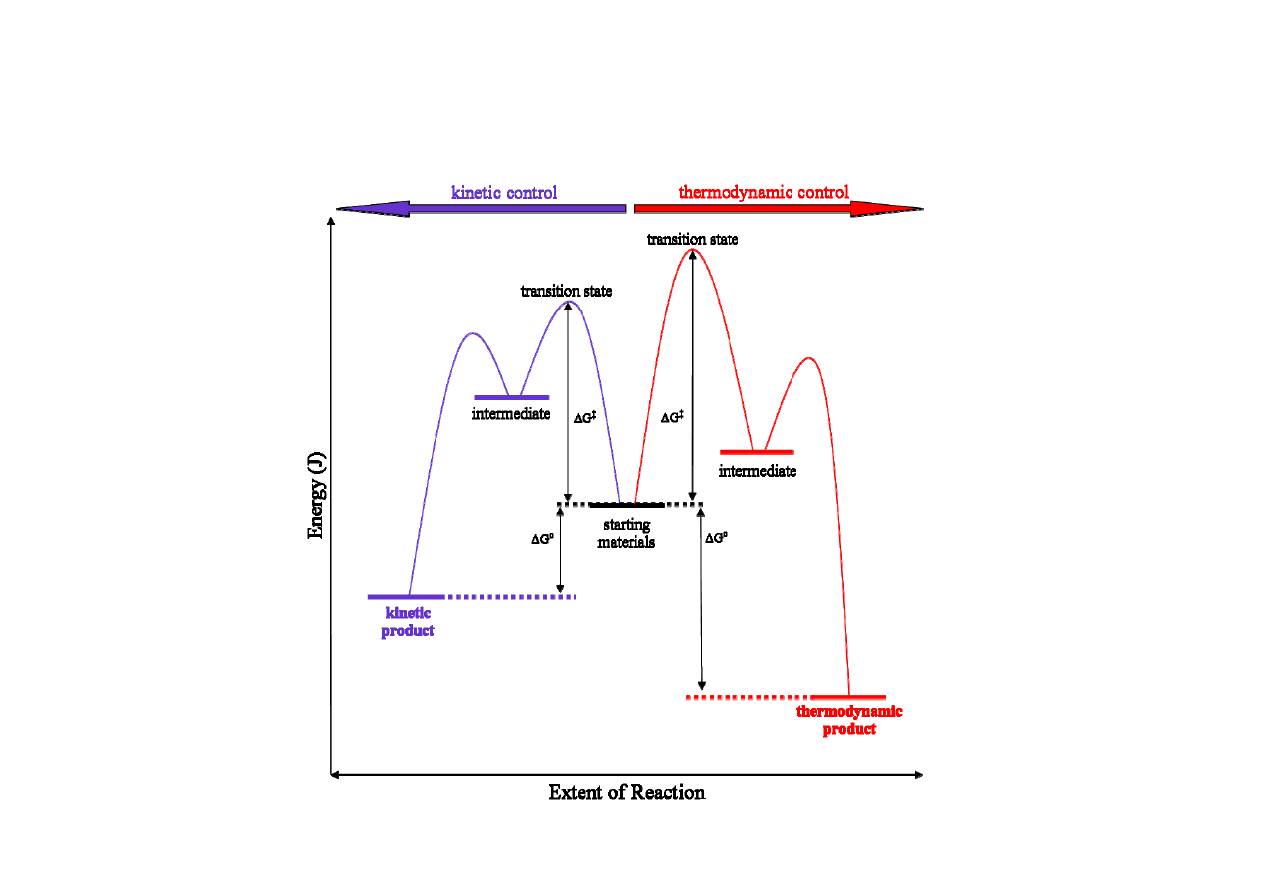
Kontrola kinetyczna i termodynamiczna w reakcjach organicznych
•
Gdy w niskiej temperaturze powstaje jeden produkt, a w podwyższonej inny
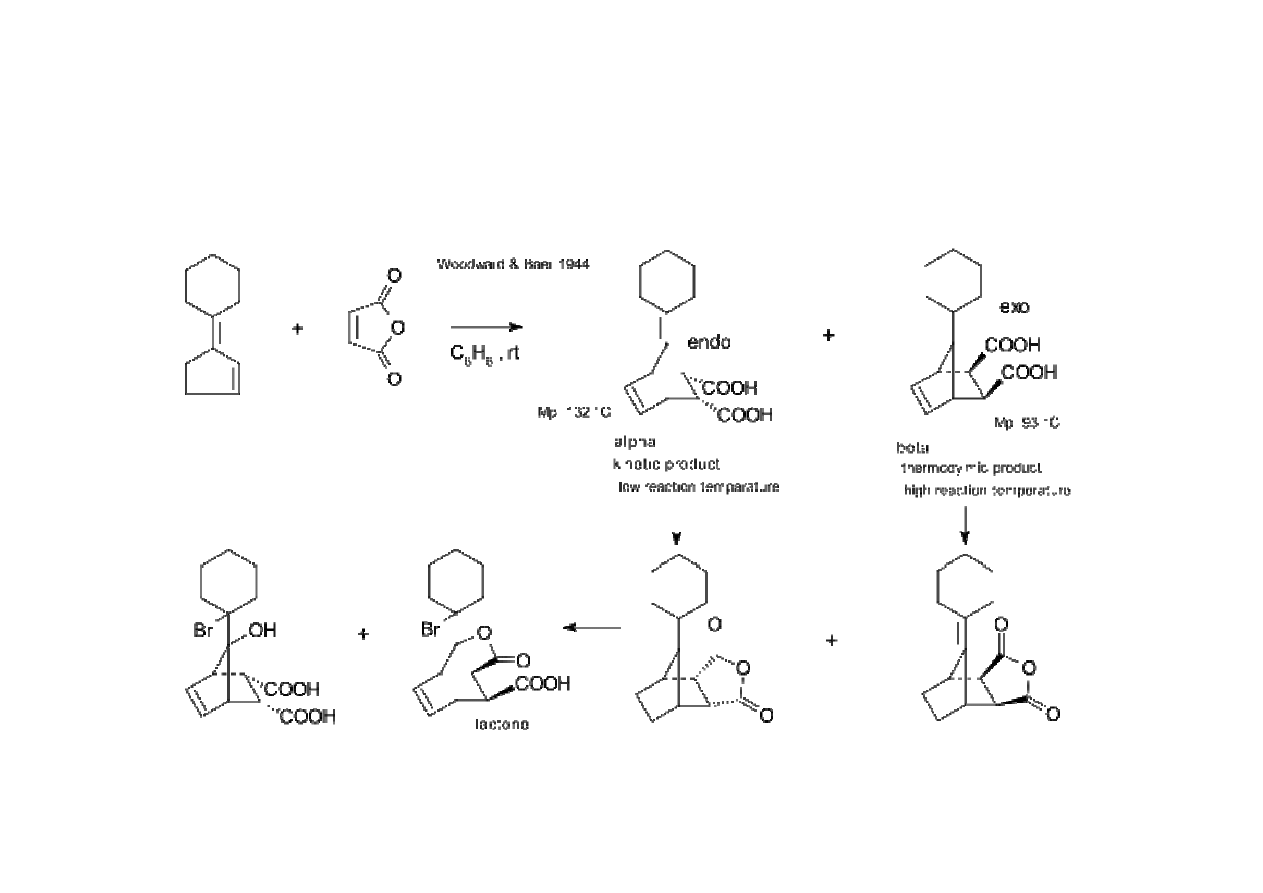
Kontrola kinetyczna i termodynamiczna w reakcjach organicznych
•
pierwsze doniesienie o kontroli kinetycznej i termodynamicznej
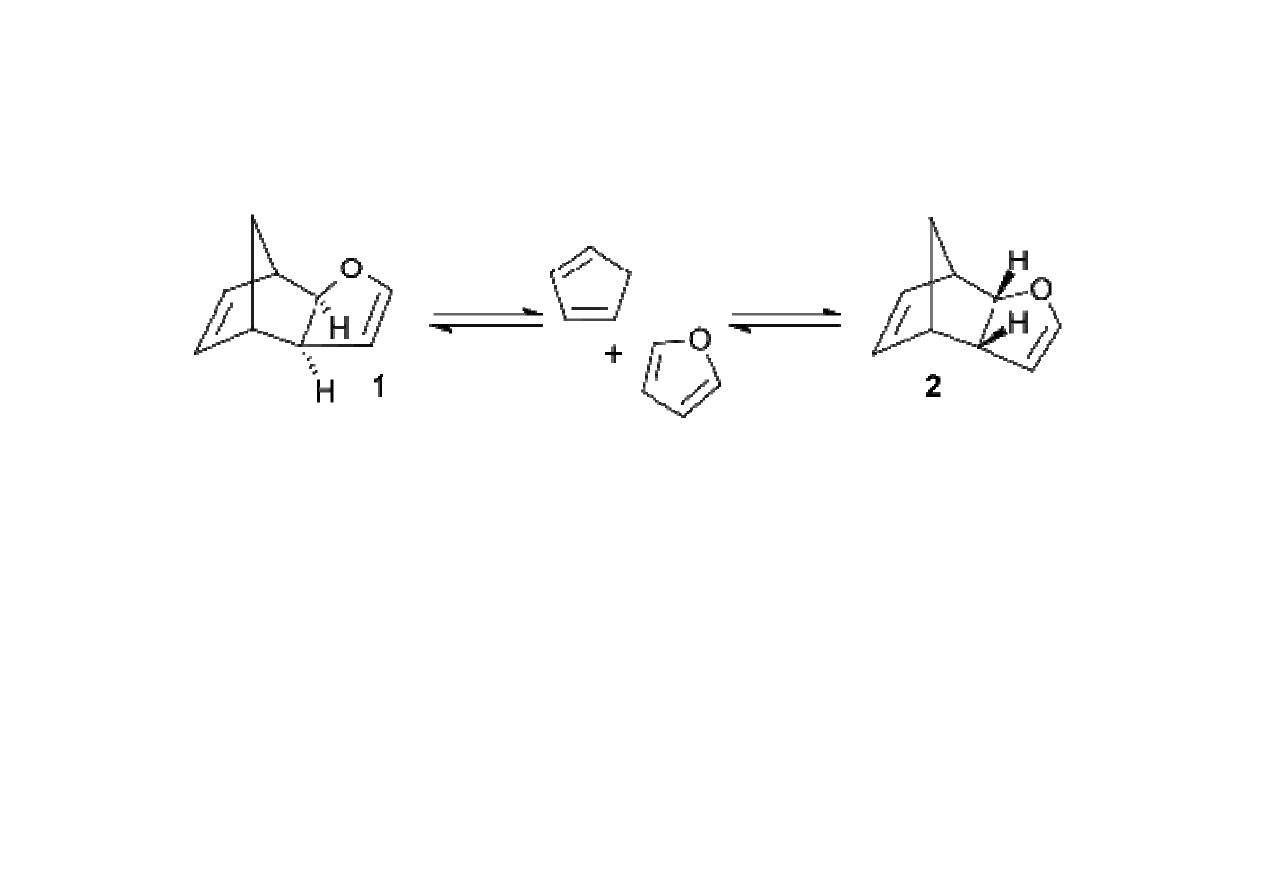
Kontrola kinetyczna i termodynamiczna w reakcjach organicznych
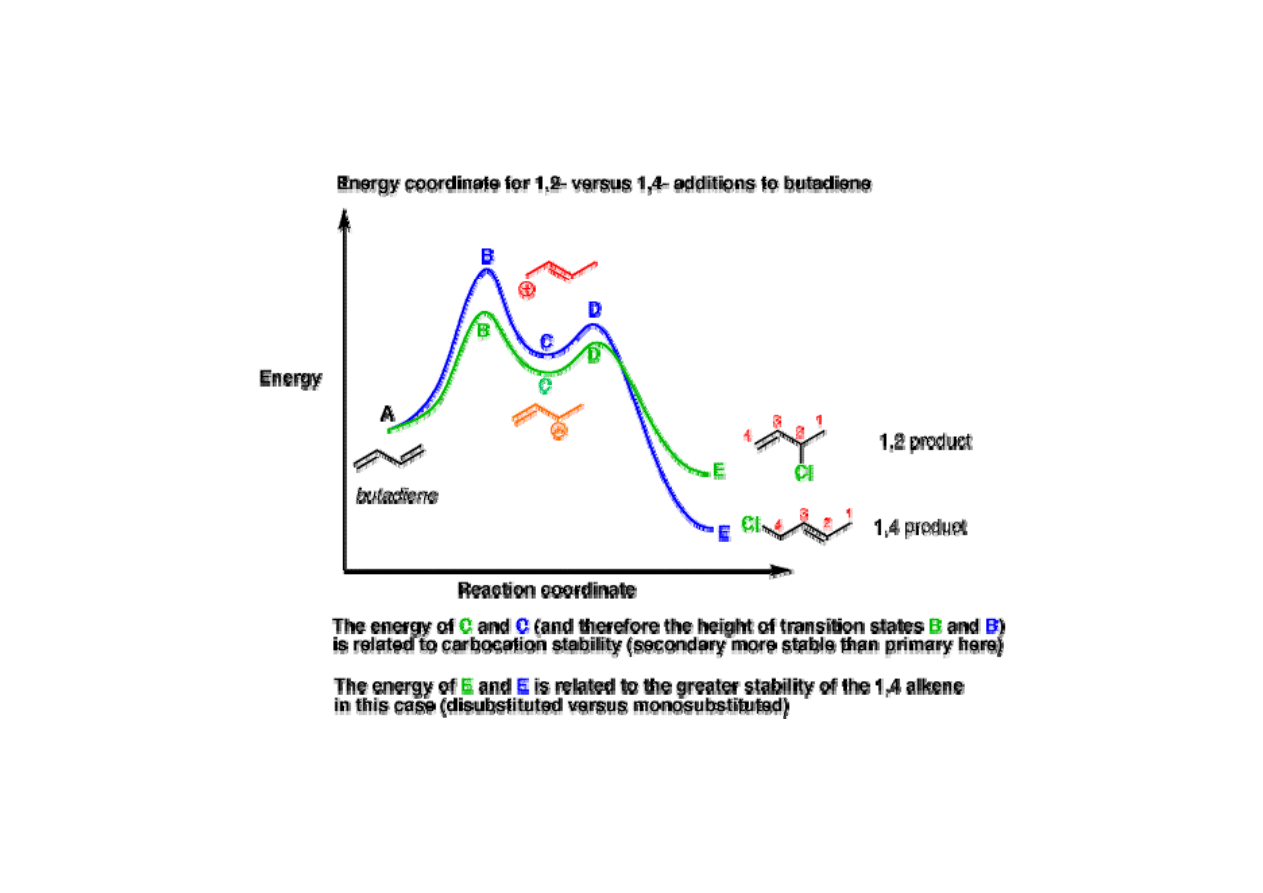
• [4+2] cykloaddycja
W niższej temperaturze powstaje produkt endo 2, w wyższej produkt
termodynamicznie trwalszy egzo 1. Produkt egzo posiada niższe zawady
przestrzenne, a w stanie przejściowym prowadzącym do produktu 2 występuje
skuteczniejsze nakładanie orbitali tworzących nowe wiązania.
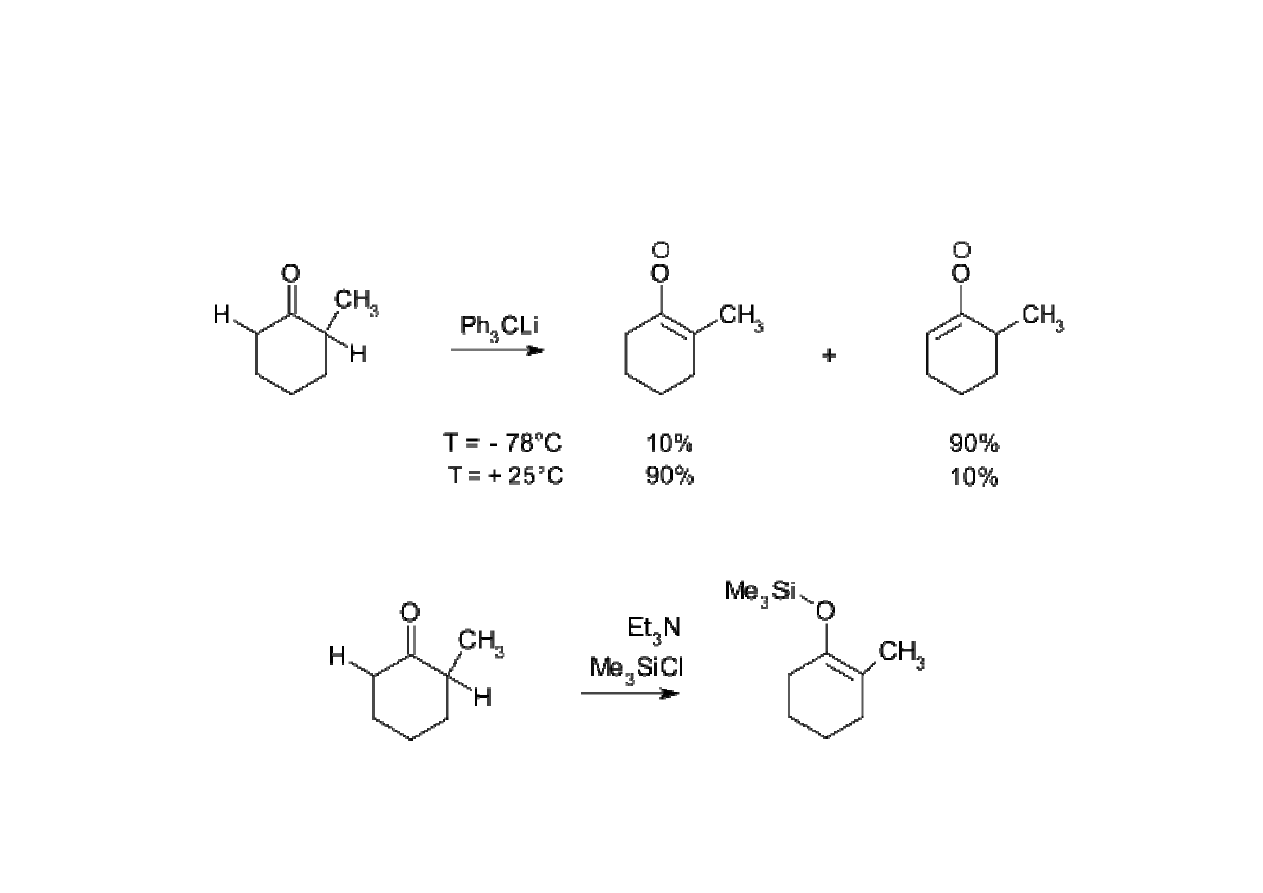
Kontrola kinetyczna i termodynamiczna w reakcjach organicznych
• deprotonowanie niesymetrycznych ketonów
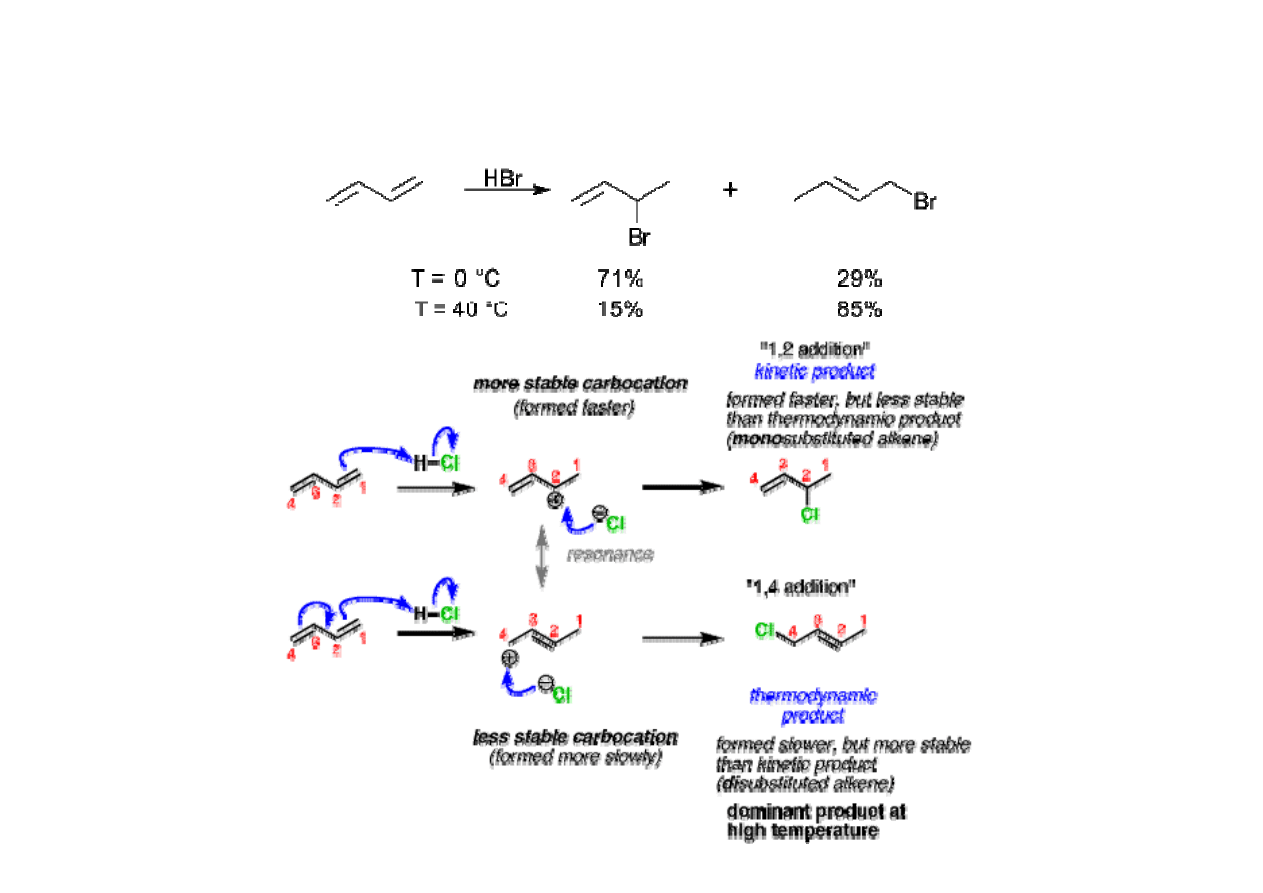
Kontrola kinetyczna i termodynamiczna w reakcjach organicznych
• addycja elektrofilowa

Klasyfikacja przemian w chemii organicznej
• Reakcje addycji
•Reakcje eliminacji
•Reakcje substytucji
• Reakcje przegrupowania
Klasyfikacja reakcji chemicznych
• W reakcjach addycji dwa substraty łączą się dając jeden produkt.
Zwykle wiązanie π, które jest jednym z substratów zostaje
zastąpione dwoma wiązaniami σ
Klasyfikacja reakcji chemicznych
• W reakcjach eliminacji jeden substrat ulega podziałowi na dwa
produkty. Zwykle dwa wiązania σ w materiale wyjściowym zostają
zastąpione przez nowe wiązanie π
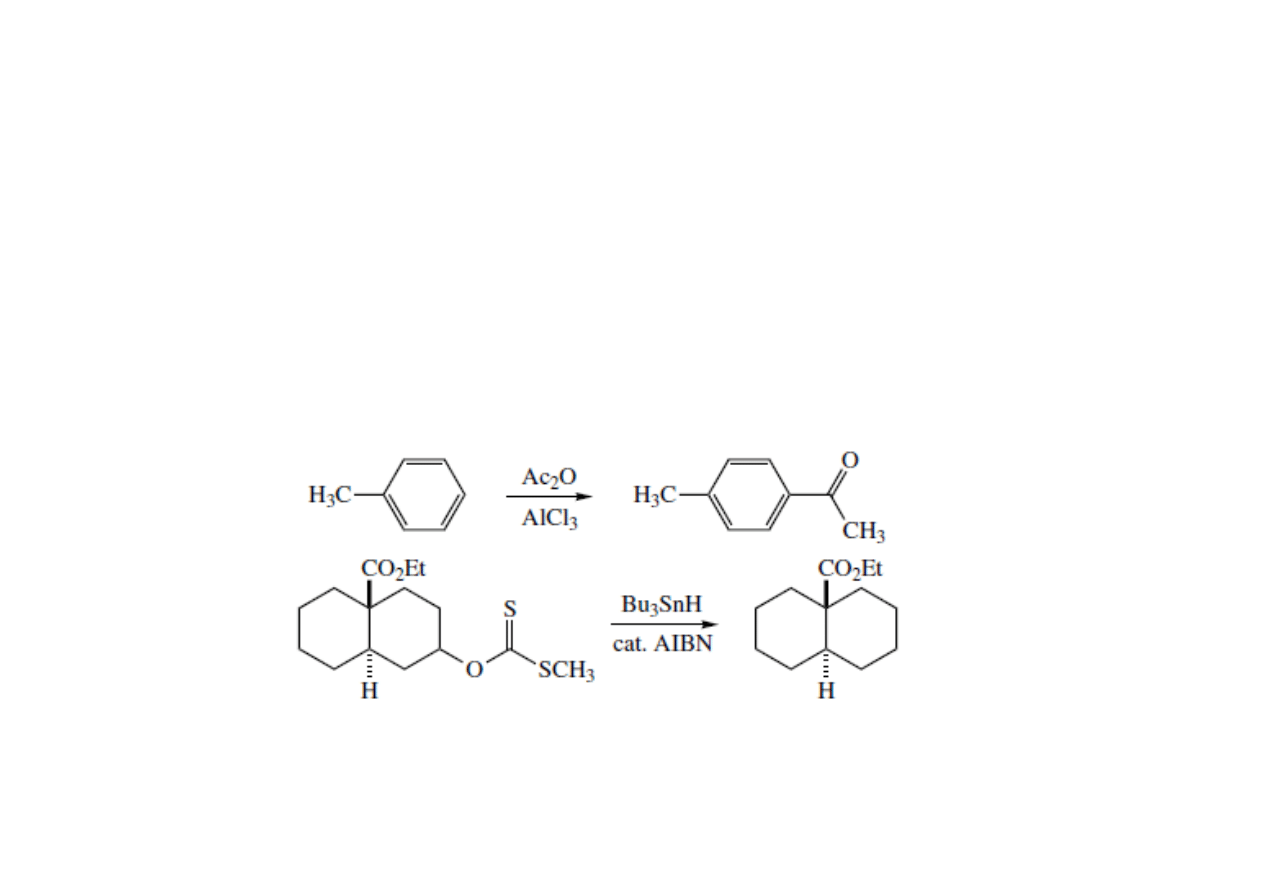
Klasyfikacja reakcji chemicznych
• W reakcjach substytucji atom lub grupa związana wiązaniem σ z
resztą cząsteczki zostaje zastąpiona przez inny σ-związany atom lub
grupę.
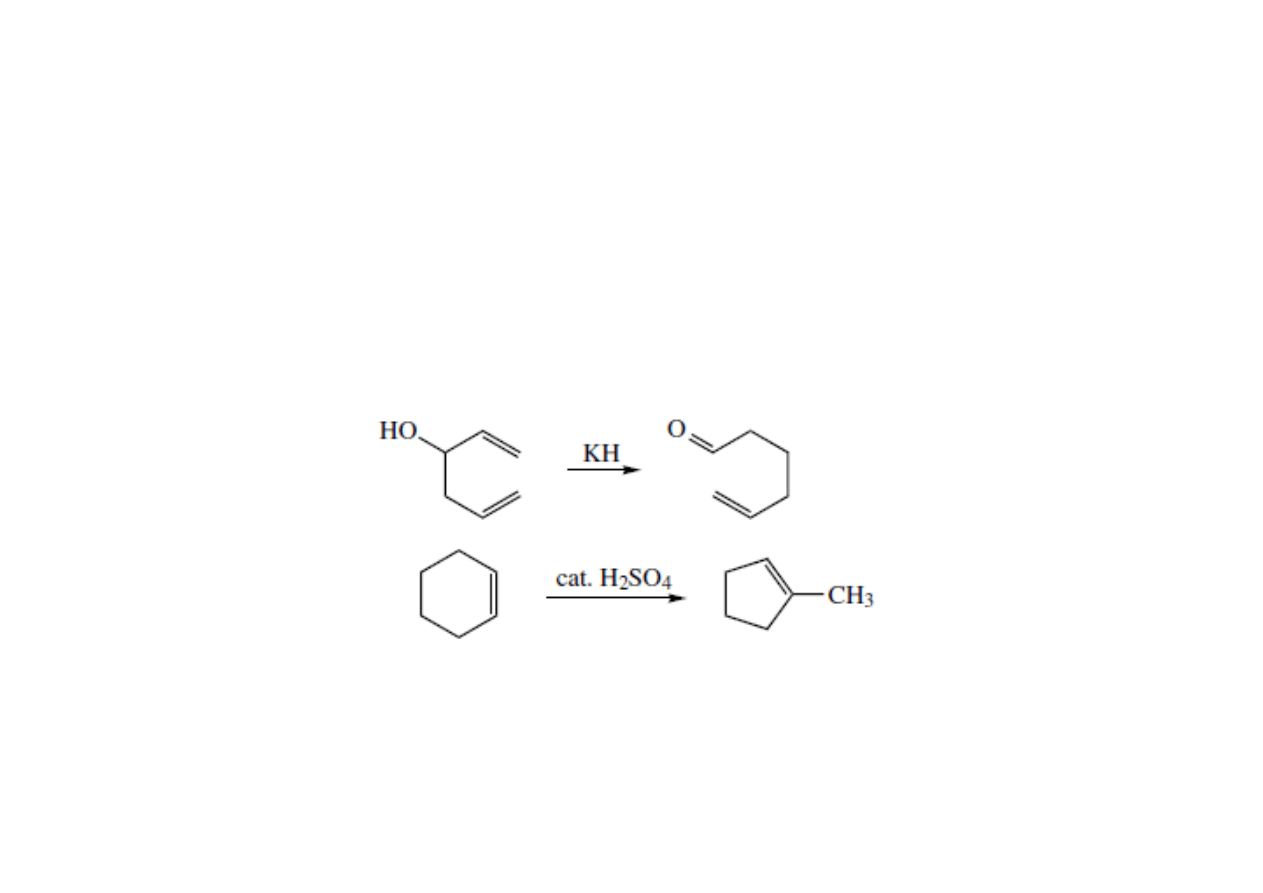
Klasyfikacja reakcji chemicznych
• W reakcjach przegrupowania pojedynczy materiał wyjściowy daje
jeden produkt o innej strukturze.

Klasyfikacja mechanizmów reakcji chemicznych
• Reakcje polarne – procesy te polegają na ruchu par
elektronowych z obszarów o wysokiej gęstości elektronowej
(nukleofile) do obszarów o niskiej gęstości elektronowej (elektrofile),
lub z pełnego orbitalu na orbital pusty.
• Reakcje wolnorodnikowe polegają na ruchu pojedynczych
elektronów. Nowe wiązanie powstaje wskutek połączenia dwóch
połowicznie zapełnionych (half-filled) orbitali.
• Reakcje pericykliczne charakteryzują się kołowym ruchem
elektronów.
• Reakcje promowane lub katalizowane metalami
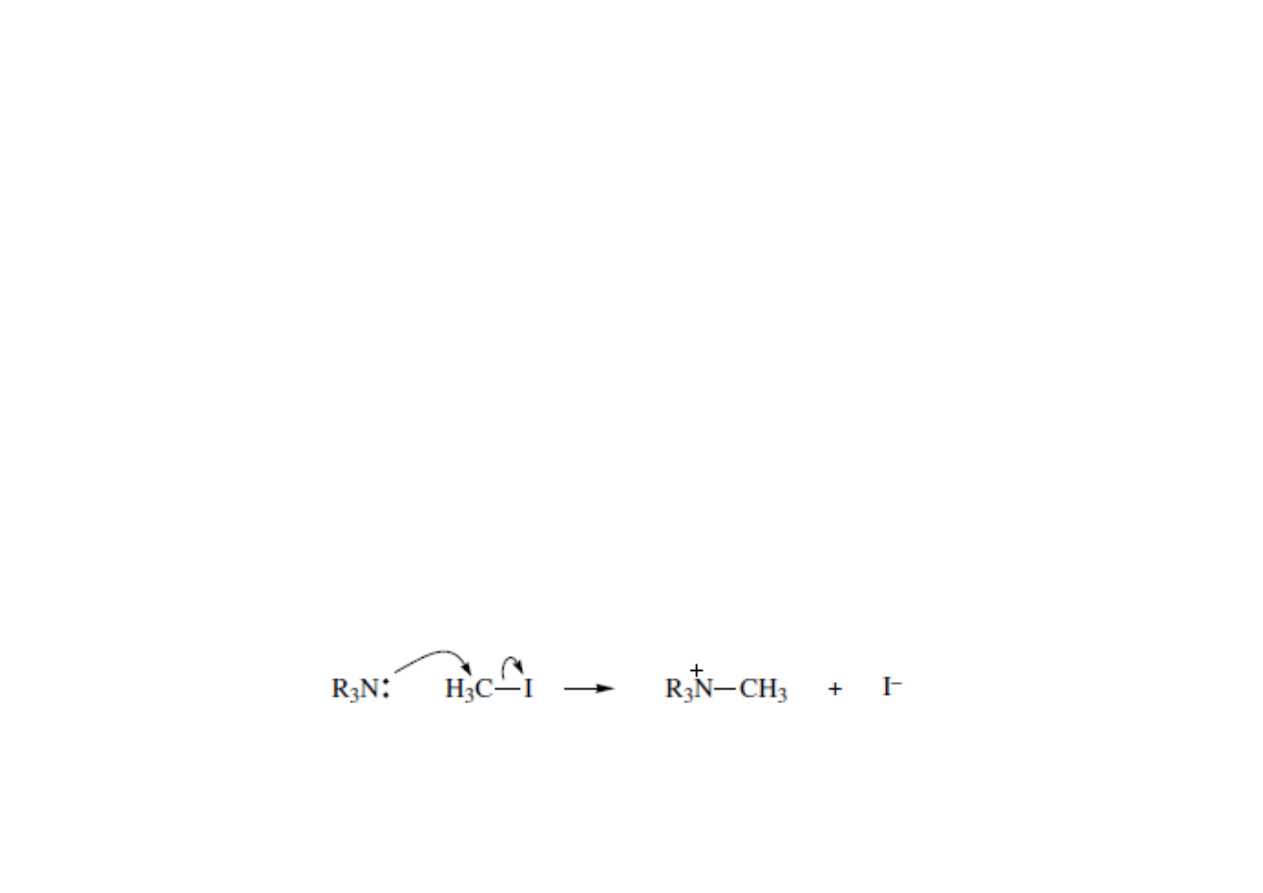
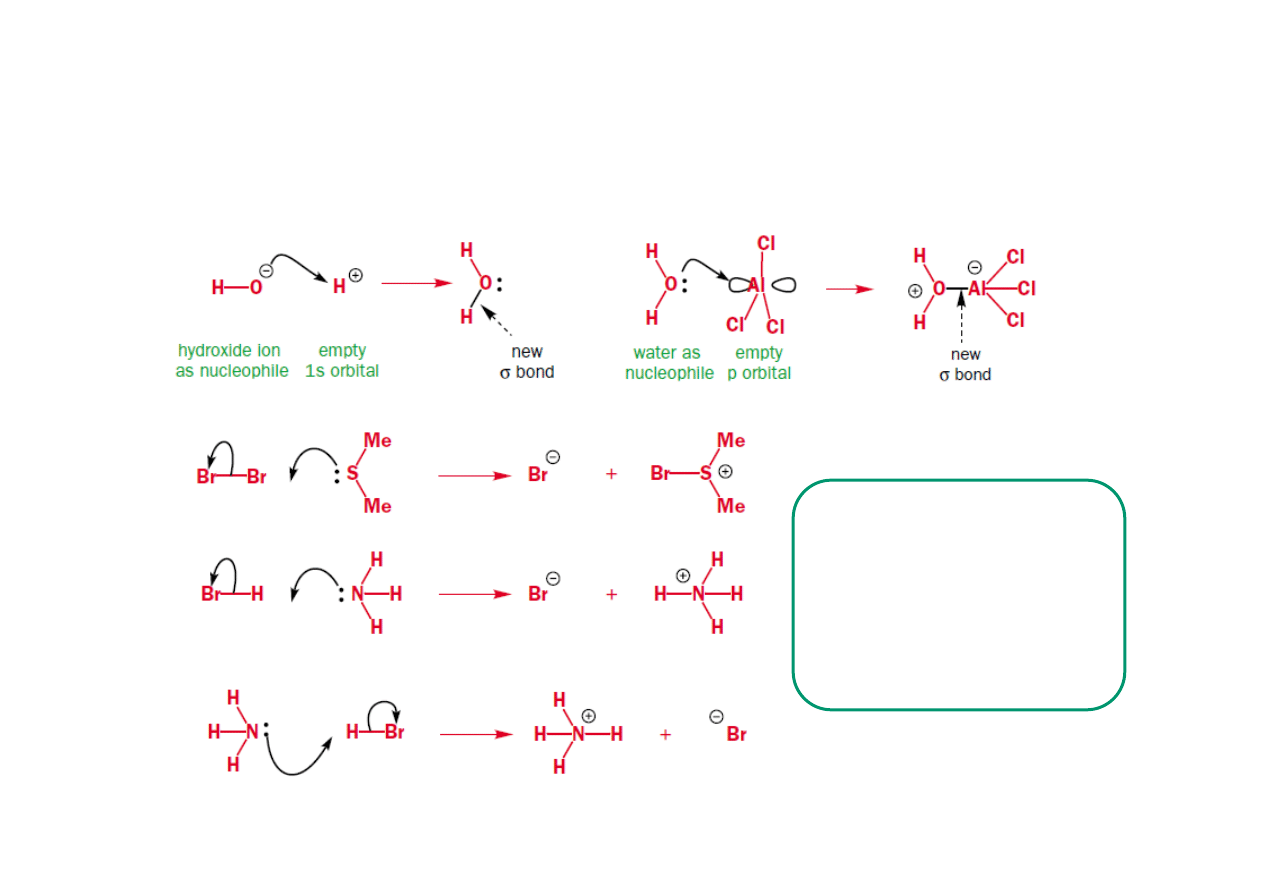
Mechanizmy Polarne – reakcje nukleofili z elektrofilami biegną zwykle
w kwaśnych lub zasadowych warunkach.
• Nukleofile to związki posiadające wolną aktywną parę elektronową
dostępną by wytworzyć nowe wiązanie. Nukleofil może być obojętny
elektrycznie lub naładowany ujemnie. Istnieją trzy typy nukleofili:
nukleofile posiadające wolna parę elektronową, σ-nukleofile i π-
nukleofile.
• Nukleofile posiadające wolna parę elektronową. Wolna para jest
wykorzystywane do tworzenia nowego wiązania z elektrofilem. Alkohole
(ROH), aniony oksoniowe, aminy, aniony chlorkowe, tiole, fosfiny.
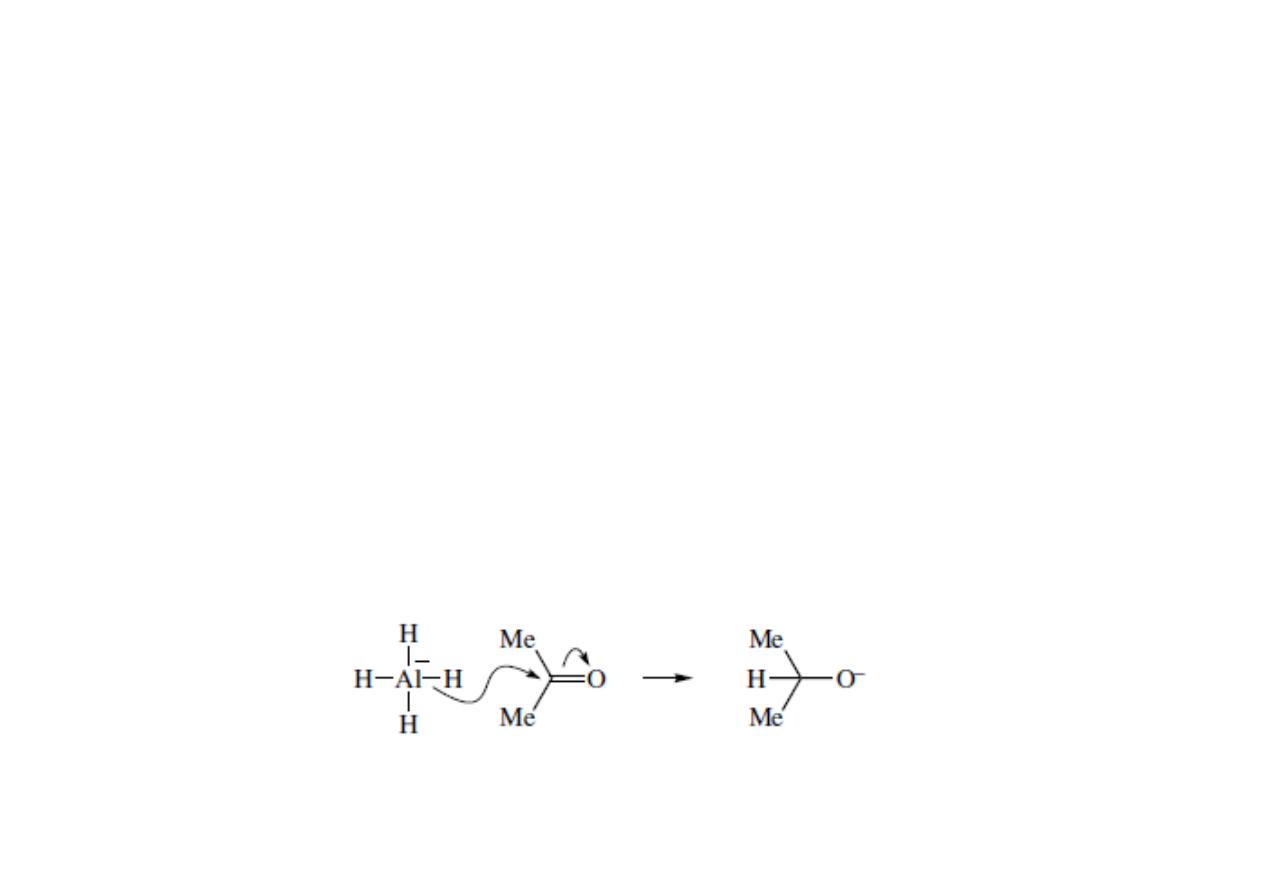
• σ-nukleofile – posiadają wiązanie między niemetalem a metalem.
Elektrony tworzące wiązanie pierwiastkiem (niemetalem) a metalem
zostają użyte do wytworzenia nowego wiązania między niemetalem, a
elektrofilem. Formalny ładunek atomu nukleofilowego się nie zmienia, a
metalu wzrasta o 1. Atomem nukleofilowym może być heteroatom
(NaNH
2
, KOH), związki metaloorganiczne (zw. Grignarda, Gilmana, lito-
czy miedzioorganiczne) lub wodór jak w kompleksach wodorków
NaBH
4
, LiAlH
4
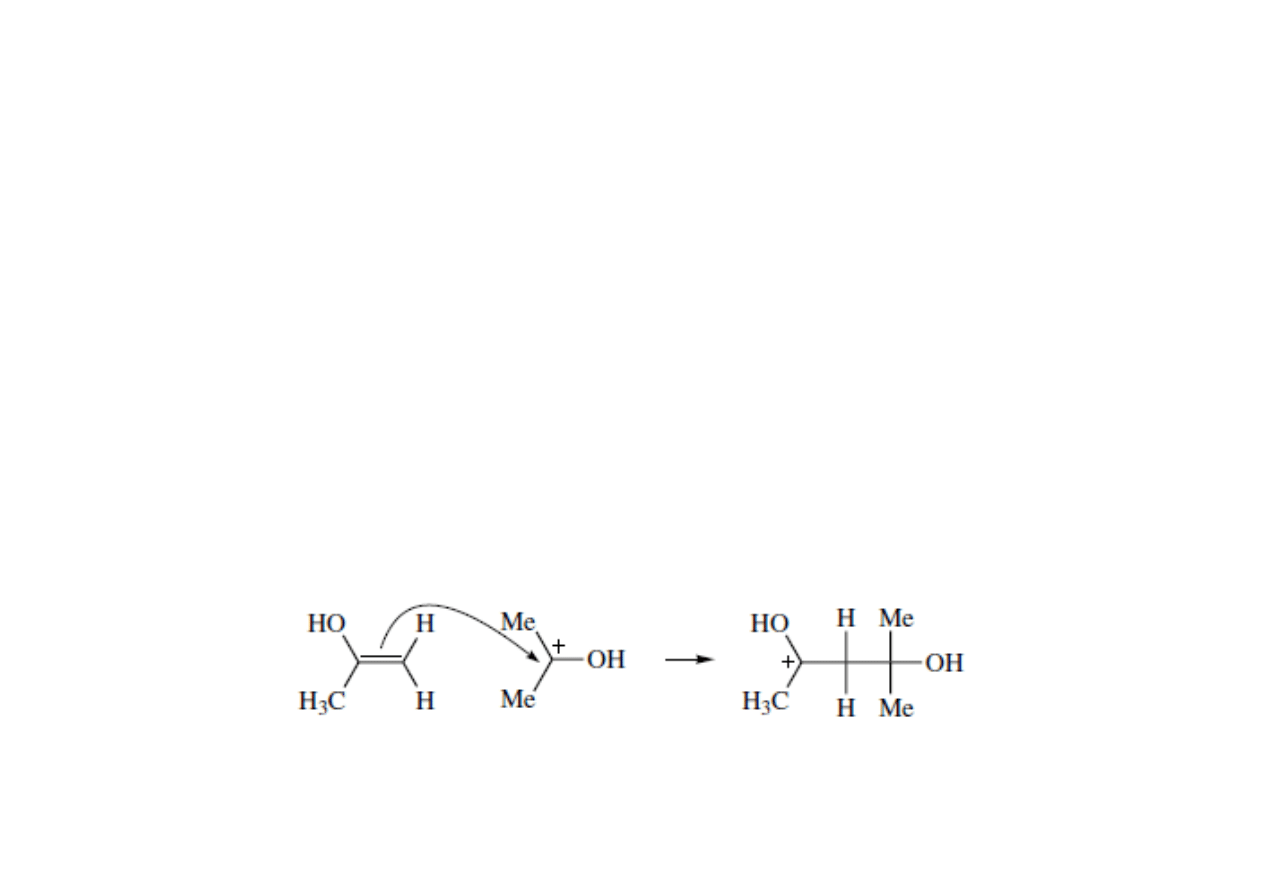
• π-nukleofile – wykorzystują parę elektronową wiązania π do
wytworzenie wiązania σ między jednym atomem z wiązania π, a
atomem elektrofilowym. Formalny ładunek nukleofilowego atomu w
wiązaniu π się nie zmienia lecz drugi atom zespołu π staje się ubogi w
elektrony. Proste alkeny i areny są słabymi π nukleofilami podczas gdy
wiązania π bezpośrednio połączone z heteroatomami (enaminy,
enolany, etery winylowe) to aktywne π nukleofile.
Własności nukleofili
• Nukleofilowość wzrasta posuwając się w dół układu okresowego,
podczas gdy zasadowość maleje. Tak więc, I
-
jest świetnym nukleofilem
podczas gdy Cl
-
słabym, Et
2
S to bardzo dobry nukleofil a Et
2
O bardzo
słaby.
• Nukleofilowość maleje dramatycznie ze wzrostem zawady
przestrzennej wokół atomu nukleofilowego.
• Delokalizacja ładunku zdecydowanie obniża zasadowość, a
nieznacznie nukleofilowość.
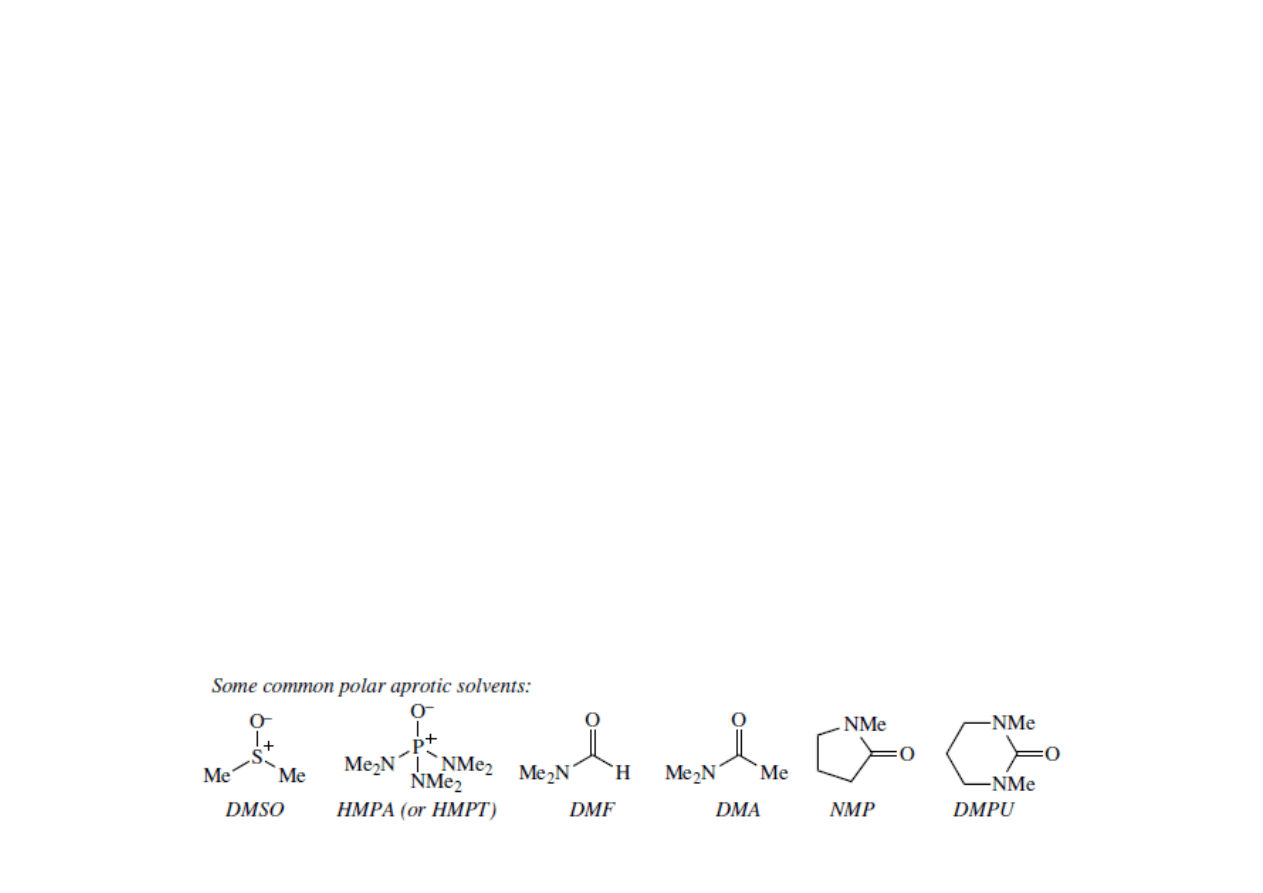
• Brak wiązania wodorowego w aprotycznych rozpuszczalnikach
polarnych zwiększa zarówno nukleofilowość jak i zasadowość.
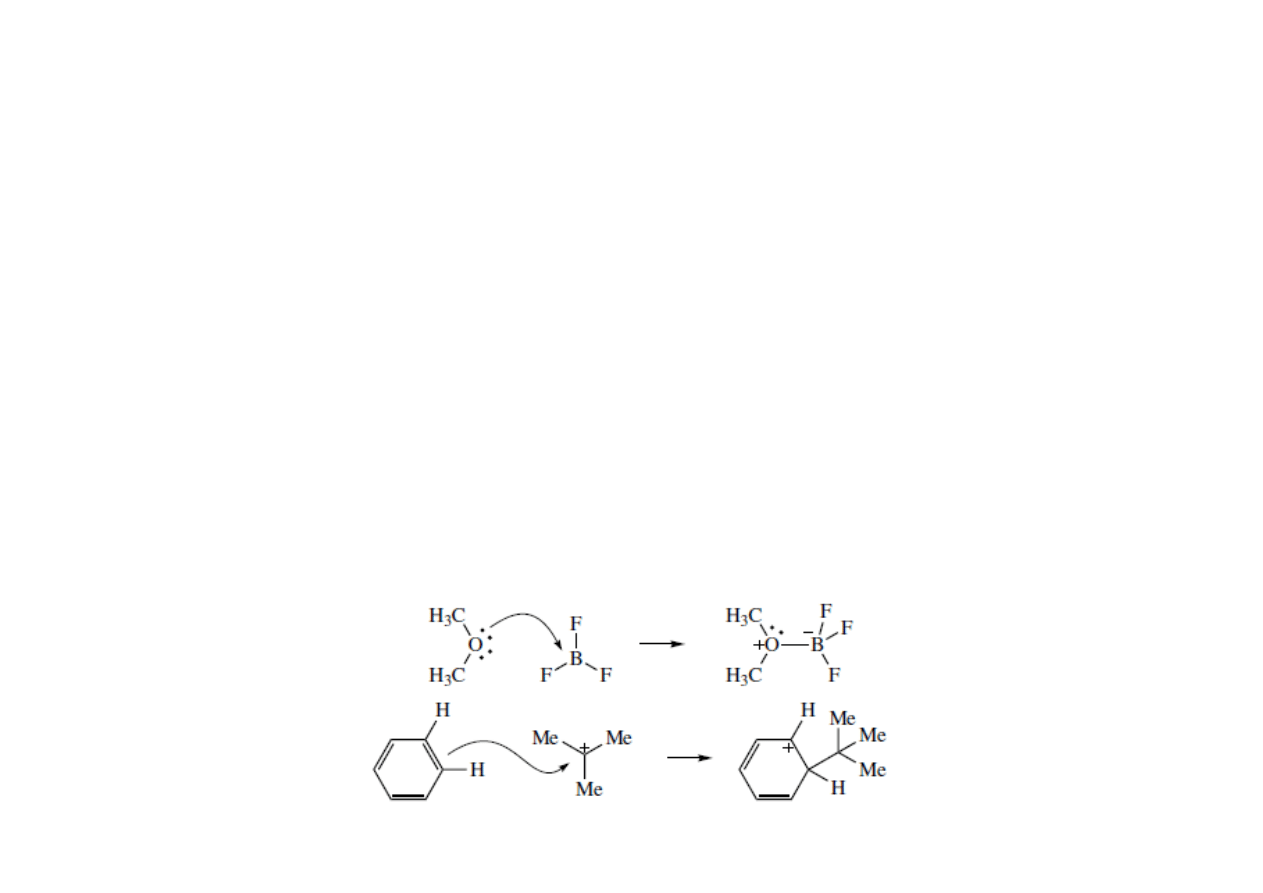
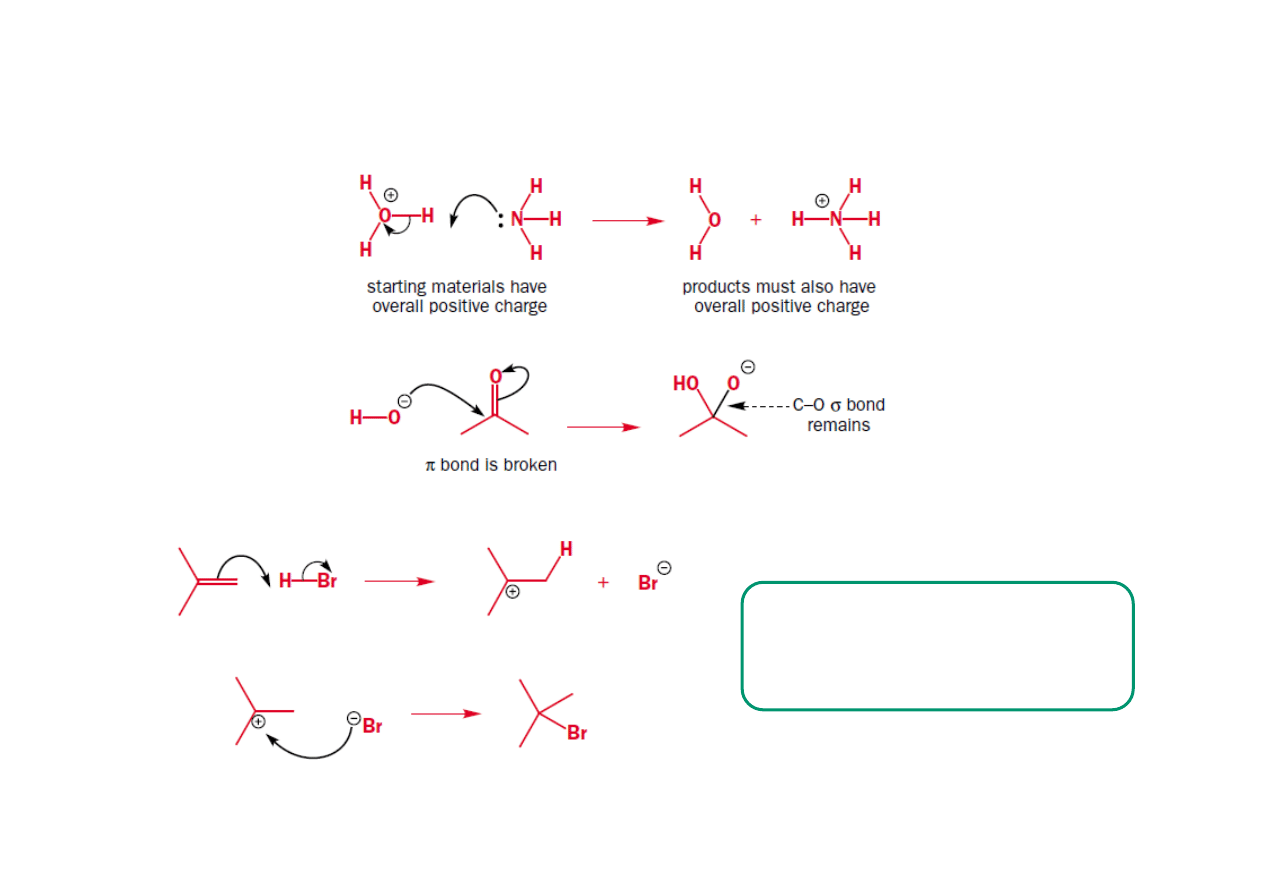
Elektrofile i grupy upuszczające.
• Elektrofile są to związki posiadające niskoenergetyczny wolny orbital
dostępny do wytworzenia nowego wiązania. Elektrofile mogą być
obojętne lub posiadać ładunek dodatni. Mamy trzy typy elektrofili:
elektrofile będące kwasami Lewisa, π elektrofile i σ elektrofile.
• Elektrofile będące kwasami Lewisa posiadają atom E który nie ma
oktetu elektronowego, a posiada niskoenergetyczny niewiążący orbital
(zwykle p). Wolna para elektronowa nukleofila jest wykorzystywana
przez E by wytworzyć nowe wiązanie i uzupełnić elektrony do oktetu.
Elektrofile i grupy upuszczające.
• π elektrofile elektrofilowy atom E posiada oktet lecz jest połączony
przez wiązanie π z atomem lub grupą, która może przyjąć parę
elektronową
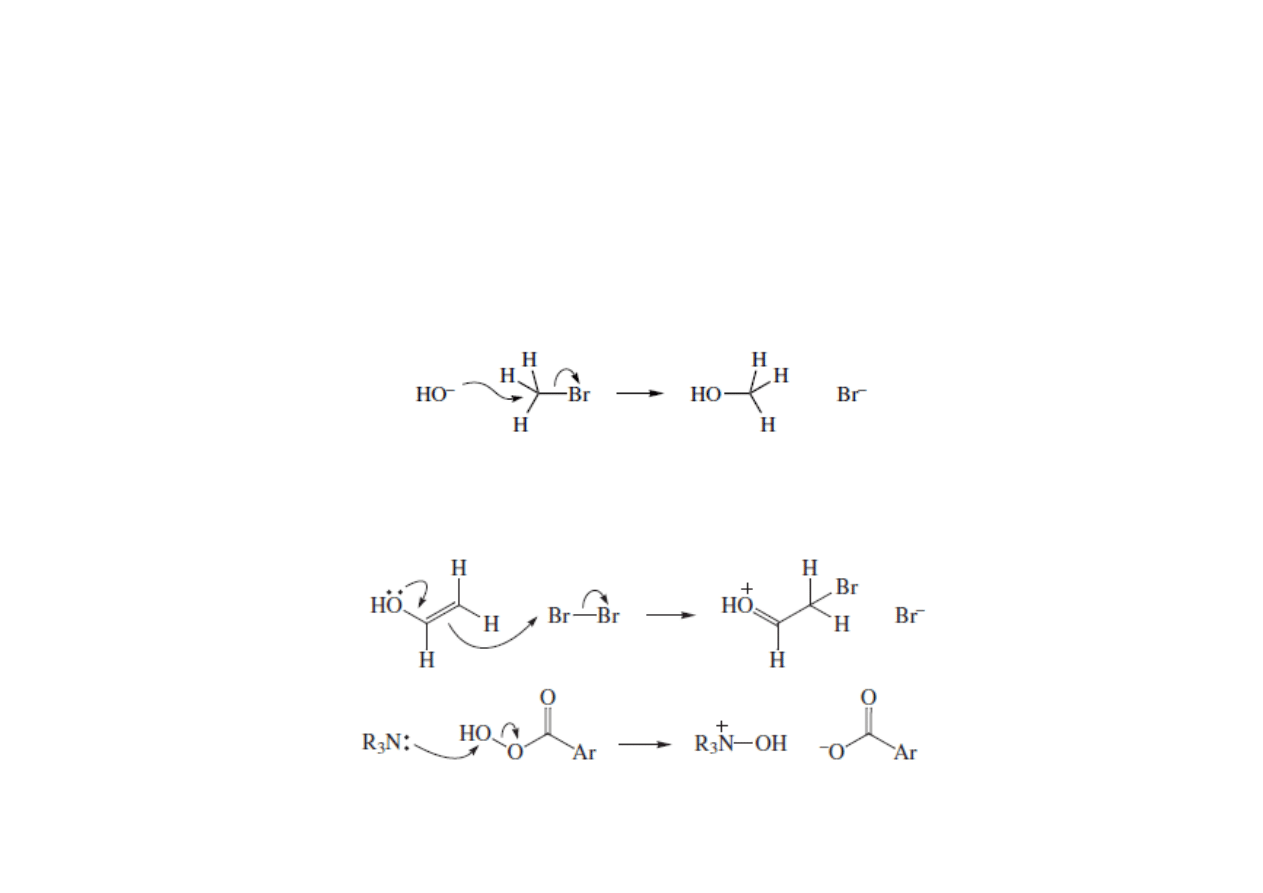
Elektrofile i grupy upuszczające.
• σ elektrofile mają strukturę E-X. Elektrofilowy atom E posiada oktet
ale jest połączony wiązaniem σ z atomem bądź grupą X zwaną grupą
odchodzącą
Elektrofile i grupy upuszczające.
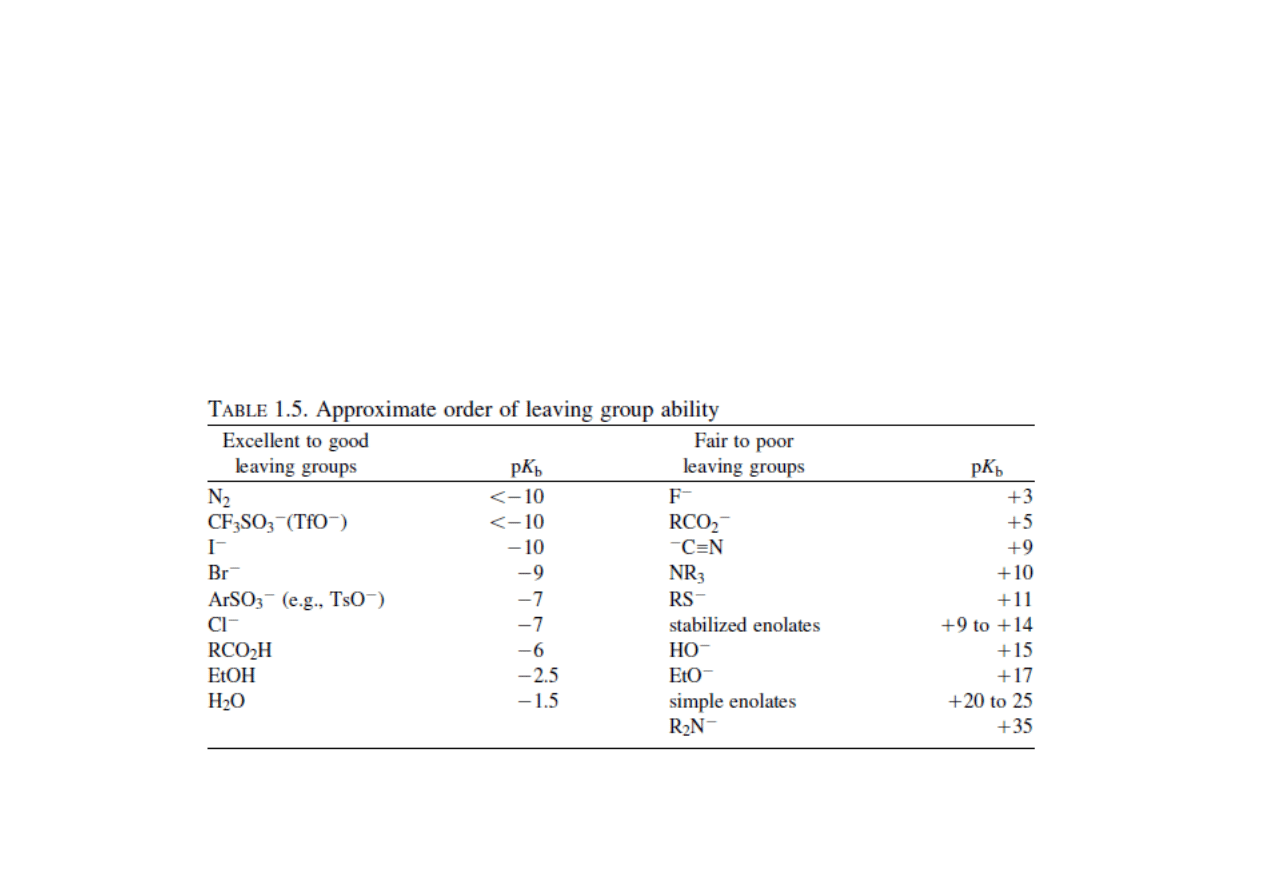
• Grupy opuszczające można podzielić na dwie rodziny. Pierwsza z
nich to grupy dobrze opuszczające, druga to grupy źle opuszczające.
Skłonność danej grupy do przynależności do jednej z dwóch
powyższych rodzin jest ściśle powiązana z pK
b
grupy.
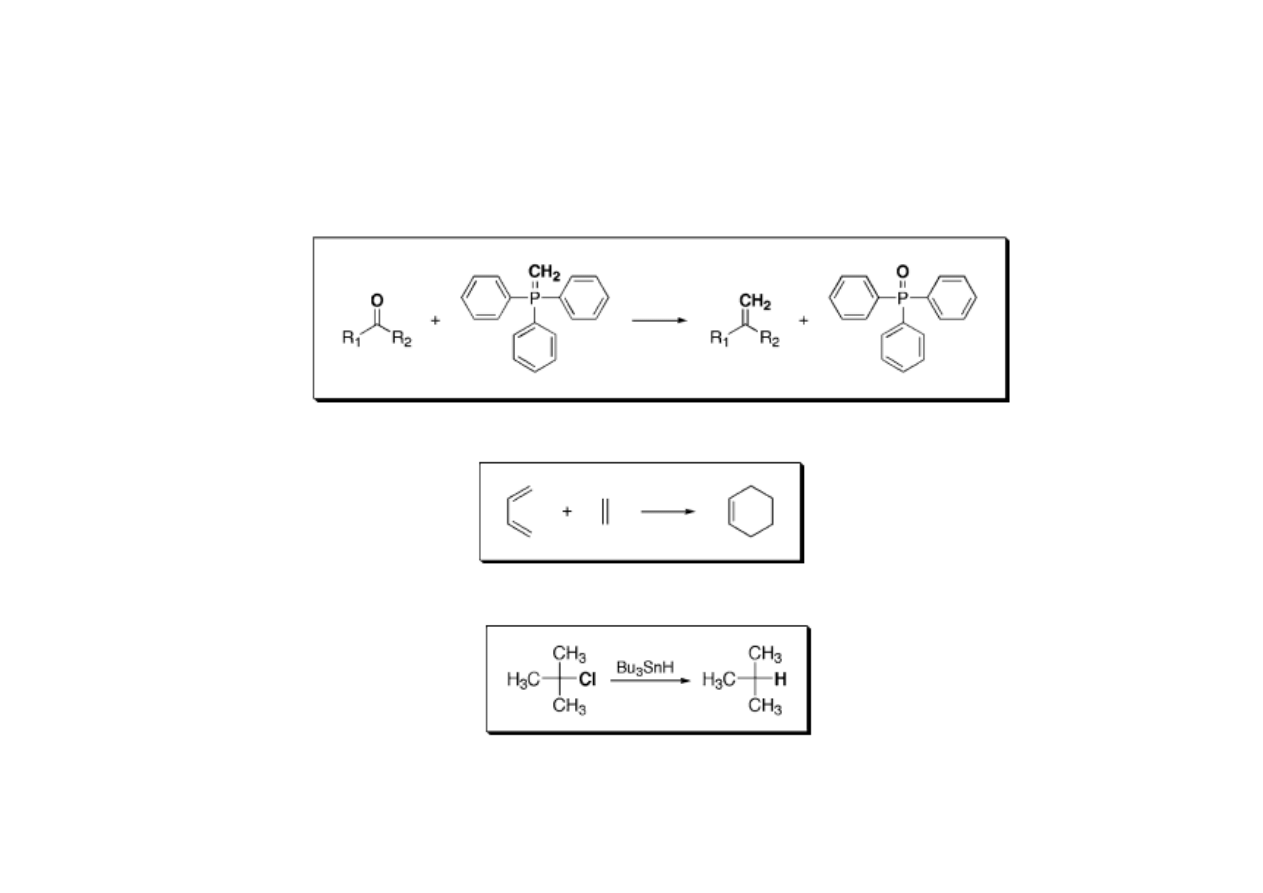
Reakcje wolnorodnikowe
• Prawie wszystkie reakcje rodnikowe są reakcjami łańcuchowymi.
Główne produkty reakcji powstają w etapie propagacji. Tylko niewielka
ilość produktów ubocznych pochodzi z reakcji inicjacji i terminacji.
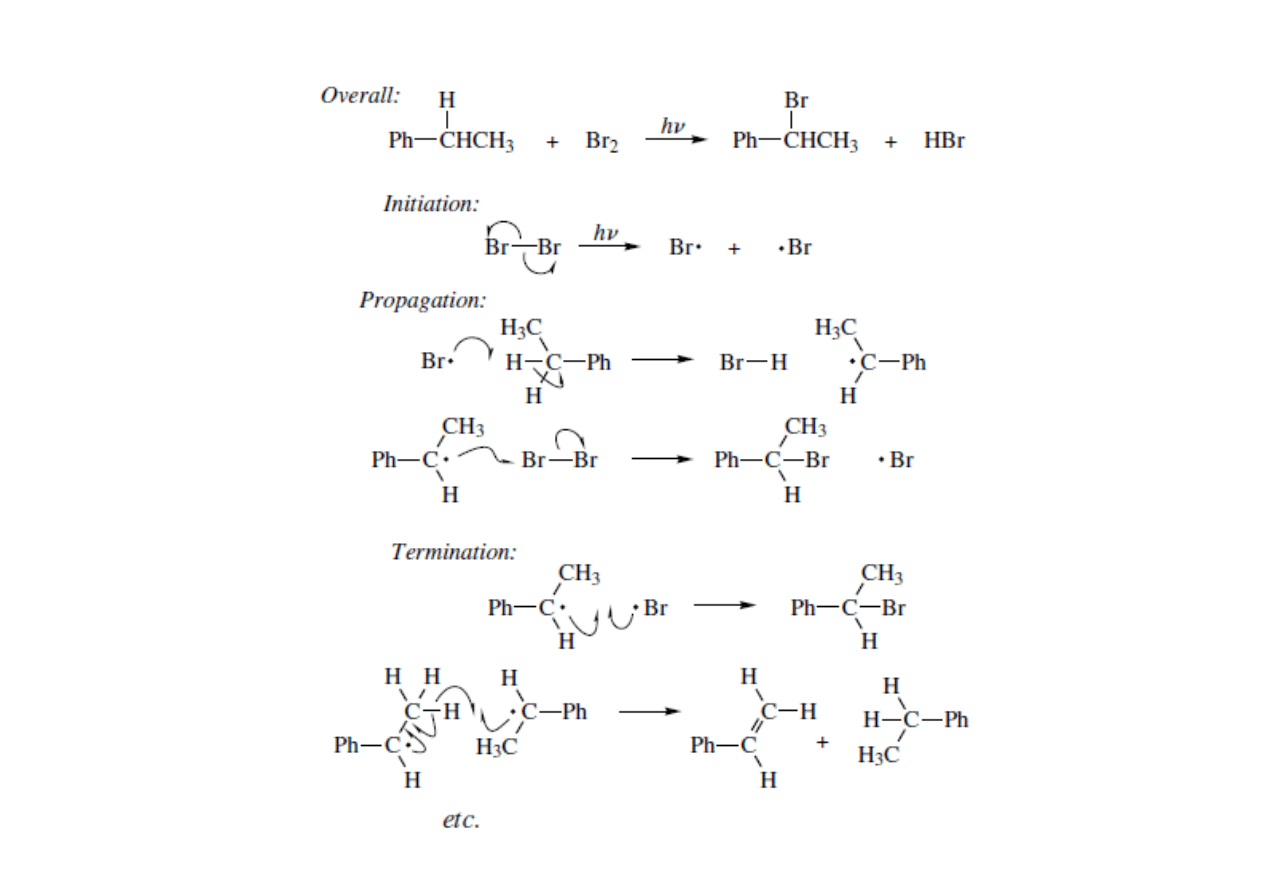
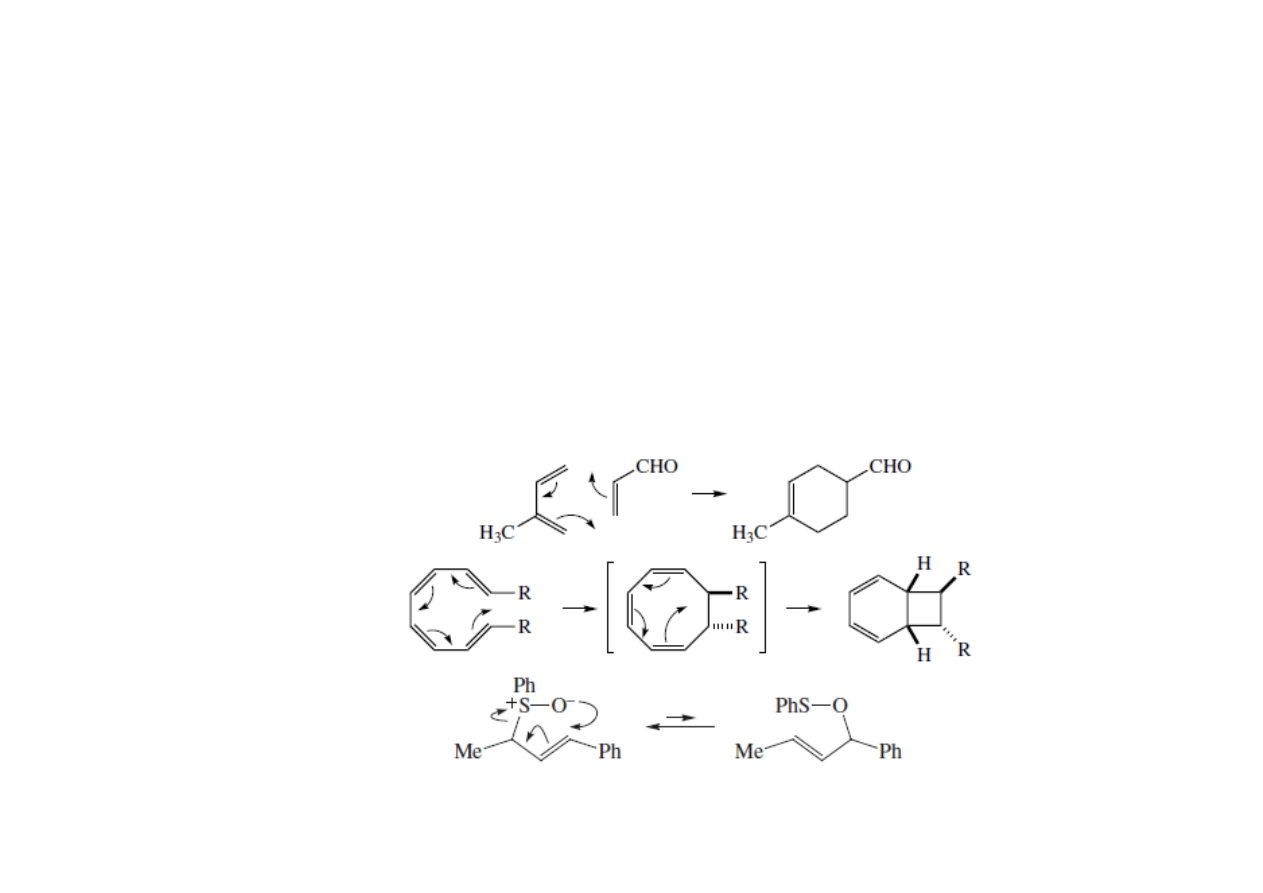
Reakcje pericykliczne
• Reakcje perycykliczne powodują utworzenie lub zerwanie co najmniej
jednego wiązania podwójnego. Często substraty lub produkty
zawierają dwa sprzężone wiązania π.
• Reakcje pericykliczne są stereospecyficzne. Czyli, że z trans
wiązania podwójnego powstaje jeden diestereoizomer, a z izomeru cis
drugi

Podsumowanie
Jak zacząć pisać mechanizm reakcji?
1.Zaznacz ciężkie atomy w substratach i produktach
2.Zanotuj które wiązania σ uległy zerwaniu na drodze z substratów
do produktów
3.Zaklasyfikuj sumaryczny przebieg reakcji (addycja, substytucja,
eliminacja, przegrupowanie). Wiele procesów może składać się z
dwóch lub więcej reakcji cząstkowych
4.Patrząc na warunki reakcji zakwalifikuj mechanizm (polarny w
warunkach kwaśnych lub zasadowych, wolnorodnikowy czy
promowany metalem)
5.Jeśli mechanizm jest polarny ustal nukleofilowość, elektrofilowość i
kwasowość atomów gdzie wiązanie σ będzie tworzone lub zrywane.
Wyszukiwarka
Podobne podstrony:
bf wyklad 2
bf wyklad 4
bf wyklad 5a
bf wyklad 5b
Napęd Elektryczny wykład
wykład5
Psychologia wykład 1 Stres i radzenie sobie z nim zjazd B
Wykład 04
geriatria p pokarmowy wyklad materialy
ostre stany w alergologii wyklad 2003
WYKŁAD VII
Wykład 1, WPŁYW ŻYWIENIA NA ZDROWIE W RÓŻNYCH ETAPACH ŻYCIA CZŁOWIEKA
Zaburzenia nerwicowe wyklad
Szkol Wykład do Or
Strategie marketingowe prezentacje wykład
Wykład 6 2009 Użytkowanie obiektu
wyklad2
więcej podobnych podstron