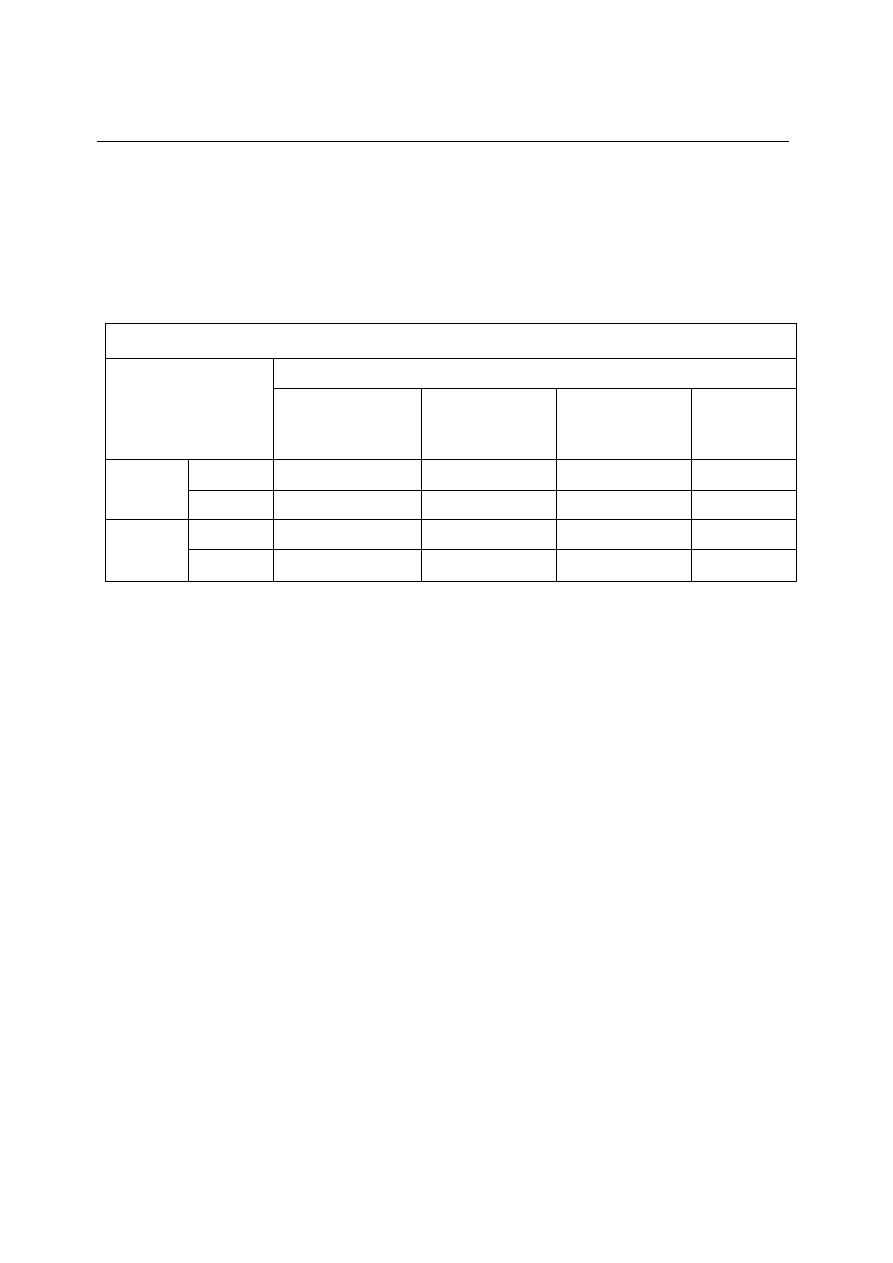
1
ZAKŁAD BIOCHEMII
UMCS
BIOCHEMIA II
I rok II stopnia
Biochemia
BADANIE MIODU
Wstęp
Miód naturalny jest produktem wytwarzanym przez pszczoły z nektaru kwiatów lub spadzi.
Podstawowy skład chemiczny miodu sztucznego i naturalnego
Rodzaj miodu
Składniki [%]
cukier
inwertowany
(min.)
sacharoza (maks.)
dekstryny (maks.)
woda (maks.)
Sztuczny
płynny
47
30
brak
21
stały
74
5
brak
21
Naturalny
nektarowy
70
5
3
20
spadziowy
60
10
10
20
Miód naturalny jest wytwarzany przez pszczoły z nektarów kwiatowych lub spadzi (substancji
wydalanej przez mszyce żerujące na drzewach). Przekształcanie nektaru lub spadzi w miód (dojrzewanie)
następuje w organizmie pszczoły, a następnie w plastrach. Polega ono na odparowaniu wody oraz szeregu
przemian biochemicznych; m.in. enzymatycznym rozkładzie sacharozy na glukozę i fruktozę. Świeży miód ma
konsystencję gęstego syropu, który w czasie przechowywania krystalizuje. Dojrzały miód posiada wysoką
wartość odżywczą i dietetyczną. Nie stanowi wprawdzie bogatego źródła witamin, ale za to zawiera duże ilości
łatwo przyswajalnych cukrów prostych, kwasy organiczne, enzymy i sole mineralne (m.in. sole wapnia, potasu i
magnezu), a także substancję hamującą rozwój drobnoustrojów, inhibinę. Dzięki tym składnikom miód,
zwłaszcza spadziowy, ma właściwości lecznicze. Właściwości organoleptyczne i skład chemiczny miodu zależą
od rodzaju nektaru lub spadzi, sposobu wydobywania miodu z plastra (na zimno lub na gorąco) oraz stopnia
dojrzałości. Wyróżnia się miody płynne, tzw. patoki i zestalone krupce.
Wykonanie:
1. Oznaczanie liczby diastazowej
Aktywność diastatyczną oznacza się na podstawie hydrolizy skrobi pod wpływem enzymów amylolitycznych
znajdujących się w miodzie. Stopień odbudowy ustala się przez reakcję skrobi z jodem, stosując obserwację
wizualną lub fotometryczny pomiar zabarwienia roztworu. Liczba diastazowa jako miara aktywności jest to
liczba cm
3
1% roztworu skrobi odbudowywanej przez amylazy zawarte w 1 gramie miodu w czasie 1 godziny, w
temperaturze 45 - 50°C. Poszczególne metody oznaczania aktywności diastatycznej różnią się sposobem
wykonania oznaczenia. W niektórych nie uwzględnia się doprowadzania pH roztworu do wielkości

2
umożliwiającej optymalne działanie enzymów.
Przygotowanie skrobi:
Przed sporządzeniem roztworu skrobię ziemniaczaną oczyścić w następujący sposób: 20 g skrobi przenieść do
kolby stożkowej o pojemności 500 cm
3
, dodać 100 cm
3
96% etanolu, 7 cm
3
2-molowego roztworu kwasu
solnego i gotować 1 godzinę w łaźni wodnej pod chłodnicą zwrotną. Kolba powinna być zanurzona w łaźni
powyżej poziomu znajdującej się w niej cieczy. Następnie zawartość kolby ochłodzić i przesączyć przez lejek
Buchnera. Zebraną na sączku skrobię przemyć 96% etanolem do zaniku reakcji na chlorki, a potem dwukrotnie
eterem etylowym. Przemytą skrobię suszyć w temperaturze 35°C. Do badania przygotowuje się 1% roztwór
skrobi.
Przygotowanie roztworu miodu:
Odważyć 10 g miodu. Rozpuścić w kolbie miarowej o pojemności 100 cm
3
w ok. 25 cm
3
świeżo przegotowanej
i ostudzonej wody i zobojętnić wobec 1-2 kropli 1% alkoholowego roztworu fenoloftaleiny za pomocą 0,05-
molowego NaOH. Po zobojętnieniu zawartości kolby uzupełnić do kreski wodą destylowaną.
Wykonanie oznaczenia:
1) Do 12 ponumerowanych probówek wlewać kolejno:
0,02 molowy roztwór kwasu octowego
0,1 molowy roztwór chlorku sodu 1% roztwór skrobi
przygotowany roztwór miodu
wodę destylowaną nasyconą toluenem (5 kropi toluenu w 100 cm
3
wody) Ilości roztworów, jakie
należy wlewać do probówek podaje tabela 1.
2) Probówki po wymieszaniu zawartości umieścić jednocześnie w termostacie o temperaturze 45 - 50°C
na 1 godzinę.
3) Po wyjęciu ochłodzić je w wodzie z lodem aby zahamować działanie enzymów i do każdej dodać po
0,05 cm
3
(1 kropla) 0,1-molowego roztworu jodu.
4) Po wymieszaniu zawartości obserwować zabarwienie roztworu.
Odczytanie wyniku:
Zanotować numer probówki, w której barwa płynu jest purpurowa (brązowo-purpurowa), bez odcienia
niebieskiego lub fioletowego.
Z tablicy odczytać liczbę diastazową. W probówkach, w których skrobia nie ulega hydrolizie, pozostaje
zabarwienie niebieskie. Liczba diastazowa miodu spożywczego powinna przekraczać wartość 8, natomiast
miodu piekarniczego ok. 5.

3
Numer
probówki
Roztwór
miodu
Woda
0,02-molowy
CH
3
COOH
0,1-molowy
NaCl
Roztwór
skrobi
Razem cm
3
Liczba
diastazowa
1
10,0
4,0
0,5
0,5
1,0
16
1,0
2
10,0
2,5
0,5
0,5
2,5
16
2,5
3
10,0
0,0
0,5
0,5
5,0
16
5,0
4
7,7
2,3
0,5
0,5
5,0
16
6,5
5
6,0
4,0
0,5
0,5
5,0
16
8,3
6
4,6
5,4
0,5
0,5
5,0
16
10,9
7
3,6
6,4
0,5
0,5
5,0
16
13,9
8
2,8
7,2
0,5
0,5
5,0
16
17,9
9
2,1
7,9
0,5
0,5
5,0
16
23,8
10
1,7
8,3
0,5
0,5
5,0
16
29,4
11
1,3
8,7
0,5
0,5
5,0
16
38,5
12
1,0
9,0
0,5
0,5
5,0
16
50,0
2. Wykrywanie zafałszowania miodu
Miód jako produkt naturalny, cieszący się dużym popytem często jest fałszowany innymi, tańszymi środkami
słodzącymi, jak np. sztuczny cukier inwertowany czy syrop ziemniaczany (skrobiowy).
Wykrywanie syropu ziemniaczanego według Fiehego
Dekstryny syropu ziemniaczanego wytrącają się z zakwaszonego roztworu miodu pod wpływem alkoholu
etylowego. W tych warunkach niskocząsteczkowe dekstryny miodu pozostają w roztworze. Dekstryny miodów
spadziowych po dodaniu samego alkoholu etylowego mogą powodować zmętnienia; zapobiega temu
zakwaszenie roztworu kwasem solnym.
Wykonanie oznaczenia:
1) Odważyć w zlewce 5g miodu
2) Dodać 10 cm
3
wody destylowanej i ogrzewać na łaźni wodnej
3) Po rozpuszczeniu miodu do roztworu dodać 0,5 cm
3
10% roztworu taniny w celu wytrącenia białek
4) Ochłodzić i oddzielić osad przez wirowanie
5) 2 cm
3
klarownego przesączu zakwasić w kolbce 50 ml 2 kroplami stężonego kwasu solnego i dodać 20
cm
3
96% etanolu
Wystąpienie mlecznego zmętnienia lub białego osadu wskazuje na obecność dekstryn syropu
ziemniaczanego.
Wykrywanie skrobi
Skrobię wykrywa się na podstawie charakterystycznej reakcji z jodem.
1) Miód rozcieńczyć wodą w stosunku 1 : 4 i ogrzewać do wrzenia
2) Po ochłodzeniu dodać 2-3 krople roztworu jodu (lg jodu i 2g jodku potasu w 300 ml wody
destylowanej)
3) Wytrząsać i obserwować zabarwienie
4) Pojawienie się zabarwienia niebieskiego świadczy o obecności skrobi
Uwaga: Roztwór miodu przed dodaniem jodu powinien być dobrze ochłodzony, ponieważ w temperaturze
wyższej niż pokojowa zabarwienie szybko znika.

4
Wykrywanie zafałszowania melasą
Zafałszowanie melasą powoduje zmiany składu chemicznego miodu. Znacznie wzrasta zawartość sacharozy, a
ponadto zmienia się skład substancji mineralnych, ponieważ melasa zawiera duże ilości potasu i chlorków.
Wykonanie oznaczenia:
1) Około 5g miodu rozcieńczyć podwójną ilością wody destylowanej i zakwasić kroplami kwasu
azotowego HNO
3
2) Po dodaniu do tej mieszaniny kilku kropel roztworu azotanu srebra AgNO
3
3) W miodzie zafałszowanym wytrąca się biały, serowaty osad chlorku srebra AgCl rozpuszczalny w
amoniaku. W miodzie naturalnym może powstać jedynie lekkie zmętnienie.
Wykrywanie zafałszowania miodu sacharozą
Najczęściej spotykanym zafałszowaniem miodu jest dodanie do niego sacharozy. Wprawdzie Polska Norma
dopuszcza ilość sacharozy w miodzie do 5%, ale i to już jest zbyt dużo, gdyż krajowe miody naturalne zawierają
tego cukru przeciętnie 1,8 -2%.
Wykonanie oznaczenia:
1) 10g miodu rozpuścić w wodzie i dopełnić w kolbie miarowej do 250 cm
3
. Zatkać korkiem i dokładnie
wymieszać.
2) Pobrać 5 cm
3
roztworu (8 cm
3
w przypadku miodu spadziowego), wlać do kolby stożkowej o
pojemności 100 cm
3
, w której znajduje się już po 5 cm
3
roztworów Fehlinga I i II
3) Ogrzać do wrzenia
Jeżeli po 2 minutach gotowania roztwór zmienia swoją barwę na ceglastą a po odstaniu wierzchnia warstwa staje
się bezbarwna, miód nie zawiera nadmiaru sacharozy. Jeżeli płyn nad osadem zachowuje odcień siny, można
wnosić o zafałszowaniu miodu sacharozą.
Zaliczenie ćwiczenia:
Przedstawić opis ćwiczenia w zeszycie wraz z wynikami doświadczeń i obliczeniami.
Wyszukiwarka
Podobne podstrony:
DIETETYKA Badanie aktywnosci proteaz.miodu 24.01.2011, Dietetyka 1 Rok, Biochemia
3 ćwiczenia BADANIE asfaltów
BADANIEepipelne
BADANIA 3
BADANIA PRZESIEWOWE 2
badania laboratoryjne 6
Badania obserwacyjne prospektywne (kohortowe)
Badanie korelacji zmiennych
badanie dla potrzeb fizjoterapii
05 Badanie diagnostyczneid 5649 ppt
Badanie nerwow czaszkowych
Badanie Prezentacja
więcej podobnych podstron