
HELOWCE
opracował: JAROSŁAW SUKIENNIK

Ogólna charakterystyka
• znajdują się w 18 grupie układu okresowego (dawniej VIII
grupa główna – 8 A)
• są to pierwiastki bloku
p
(wyjątek hel [
He
] blok
s
)
• zawierają po
8 elektronów na ostatniej powłoce
za wyjątkiem
helu
, który ma
2 elektrony
na swojej jedynej powłoce
• konfiguracja ostatniej powłoki wygląda ogólnie
-
n
s
2
n
p
6
gdzie „
n
” oznacza numer okresu
- wyjątek stanowi
hel
którego
konfiguracja
wygląda następująco
1s
2
• są to gazy bezbarwne, nie posiadają także smaku i zapachu
• mają niskie temperatury topnienia i parowania
• wykazują najmniejszą reaktywność ze wszystkich pierwiastków
ze względu na trwałą konfigurację elektronową (8 elektronów
na ostatniej powłoce; hel 2 elektrony)
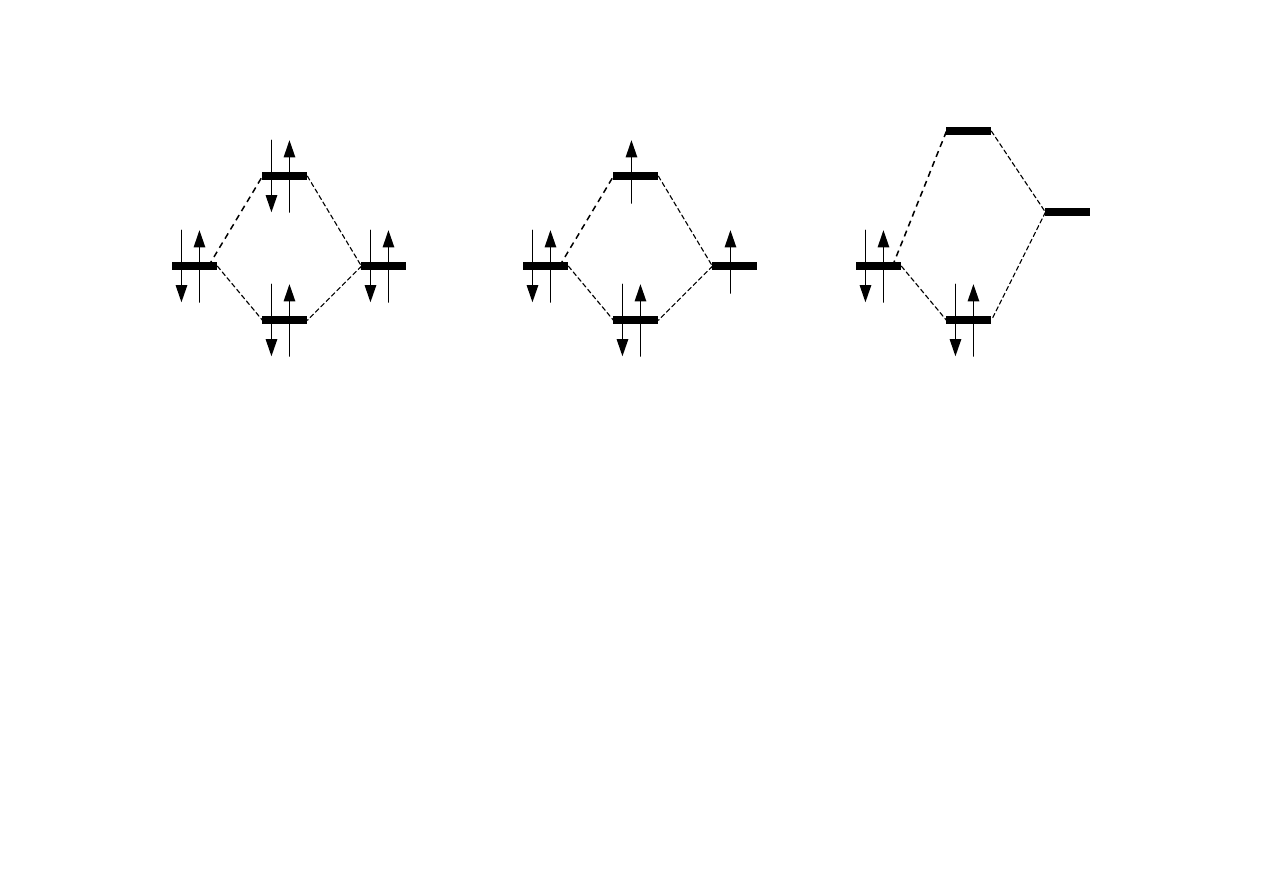
• hipotetyczna cząsteczka He
2
zawierałaby niekorzystny układ
elektronów na orbitalu wiążącym i antywiążącym:
[(σ1s)
2
(σ*1s)
2
] i przedstawiałaby układ bogatszy w energię niż
dwa osobne at. helu
• konfiguracja cząsteczki He
2
+
[(σ1s)
2
(σ*1s)
1
] jest trwalsza niż
układ złożony z atomu He i jonu He
+
• układ HeH
+
jest dość trwałym układem i nie zawiera
elektronów na orbitalu antywiążącym; konfiguracja: (σ1s)
2
Schemat orbitali w hipotetycznej cząsteczce He
2
oraz w jonach He
2
+
i HeH
+
He
He
2
He
He
He
2
+
He
+
He
HeH
+
H
+

• Jony He
2
+
i HeH
+
powstają podczas wyładowań
elektrycznych które dostarczają energii koniecznej
do zjonizowania atomu He lub w drugim przypadku
do jonizacji atomu H. Obecność ich potwierdzają
badania spektroskopowe.
• Wykryto także obecność jonów innych gazów
szlachetnych jak: Kr
2
+
oraz NeXe
+
.
• Jednoatomowe cząsteczki helowców mogą na
siebie oddziaływać tylko słabymi oddziaływaniami
dyspersyjnymi.

Karta historyczna
Do 1962 roku nie znano żadnego trwałego związku w
którym występował jakikolwiek gaz szlachetny. Neil Bartlet
zauważył, że energia jonizacji ksenonu (1170 kJ/mol) jest
niemal taka sama jak energia jonizacji tlenu (1165 kJ/mol).
A skoro silny utleniacz tj. heksafluorek platyny PtF
6
potrafi
utworzyć z tlenem heksafluoroplatynian(VI) dioksydenylu
(O
2
)
+
(PtF
6
)
-
to będzie on mógł też utworzyć związek z
ksenonem. Bartlet uzyskał w ten sposób w temperaturze
pokojowej heksafluoroplatynian(VI) ksenonu: Xe
+
(PtF
6
)
-
-
czerwony proszek. Dało to początek prób syntezy związków
chemicznych zawierających w cząsteczkach helowiec.

Zawartość helowców w powietrzu
5,2 · 10
-4
1,8 · 10
-3
0,934
1,14 · 10
-3
8,7 · 10
-6
10
-16
Hel (He)
Neon (Ne)
Argon (Ar)
Krypton (Kr)
Ksenon (Xe)
Radon (Rn)
Zawartość, % obj.
Pierwiastek
We wszystkich stanach skupienia występują jako
cząsteczki jednoatomowe.

Dlaczego argonu jest tak dużo?
Argon powstaje nieustannie w wyniku reakcji
promieniotwórczych
.
Ar
K
40
18
0
1
40
19
+
⇒
−
β
Ze względu na dużą zawartość tego izotopu
potasu w litosferze stężenie argonu w atmosferze jest
stosunkowo stałe. Stąd opłacalność jego pozyskiwania
metodą destylacji frakcyjnej powietrza.
Jedno z
najpopularniejszych
zastosowań helu

Podstawowe właściwości helowców
10,75
12,13
14,0
15,76
21,56
24,58
e. jonizacji
[eV
.
atom
-1
]
211,1
165,1
119,8
87,3
27,1
4,2
t. wrzenia [K]
202,1
161,4
116
83,8
24,5
1,05*
t. topnienia [K]
(222)
131,29
83,80
39,95
20,18
4,002
Masa at.
6s
2
6p
5
5s
2
5p
6
4s
2
4p
6
3s
2
3p
6
2s
2
2p
6
1s
2
konfiguracja
Rn
Xe
Kr
Ar
Ne
He
symbol
Radon
Ksenon
Krypton
Argon
Neon
Hel
⋅⋅
* pod ciśnieniem 2.5 MPa (25 atm.)

Właściwości i zastosowania helu
• występuje w znacznych ilościach w gazie ziemnym. Zawartość helu
może tam dojść nawet do 7%. Uzyskuje się go właśnie przez
destylację gazu ziemnego.
• hel powstaje ciągle w wyniku przemian α w szeregach promienio-
twórczych np.
Powstające tu jądro
helu pobiera elektrony z otoczenia.
• jest niepalny i ma dużą nośność, więc stosuje się go do napełniania
balonów i sterowców.
• mieszanina 80% O
2
i 20% He stosowana jest jako gaz dla nurków.
Nie rozpuszcza się on jak azot we krwi i podczas gwałtownego
wynurzenia nie tworzy banieczek zamykając naczynia krwionośne.
Zapobiega więc chorobie kesonowej.
• służy jako gaz ochronny podczas spawania beztlenowego
• ze względu na niską temperaturę wrzenia wykorzystuje się go jako
chłodziwo w elektrowniach atomowych i w układach
nadprzewodzących.
Th
He
U
234
90
2
235
92
+
⇒
+

Obecnie, sterowce
wypełnia się helem.
Jest on gazem dużo
bezpieczniejszym niż
wodór i znacznie
wolniej dyfunduje
przez poszycie.

Dawniej stosowano wodór i kończyło się to jak wyżej.

NEON
• otrzymywany w procesie destylacji frakcyjnej
powietrza.
• stosuje się go w lampach jarzeniowych: czerwono –
pomarańczowe światło
• do lamp w reklamach świetlnych oraz jako gaz
wypełniający lampy kineskopowe
• jest chłodziwem 40 razy bardziej wydajnym niż hel
• znane są jego nietrwałe połączenia z wodą,
toluenem i fenolem
• udało się też wykryć nietrwałe jony neonu tj. Ne
+
,
(NeAr)
+
, (NeH)
+
oraz (HeNe)
+

ARGON
• jego zawartość procentowa w powietrzu wynosi około 0.93%,
stąd opłacalność otrzymywania go metodą destylacji frakcyjnej
• powstaje podczas rozpadu jąder jednego z izotopów potasu
Ar
K
40
18
0
1
40
19
+
⇒
−
β
• stosuje się go do wytwarzania obojętnej atmosfery ochronnej
podczas spawania stopów glinu
• napełnia się nim żarówki i lampy jarzeniowe co daje niebieskawy
kolor światła
• napełnia się nim też liczniki do wykrywania promieniowania
jonizującego.
• potrafi tworzyć nietrwałe hydraty
O
H
Ar
2
6
⋅
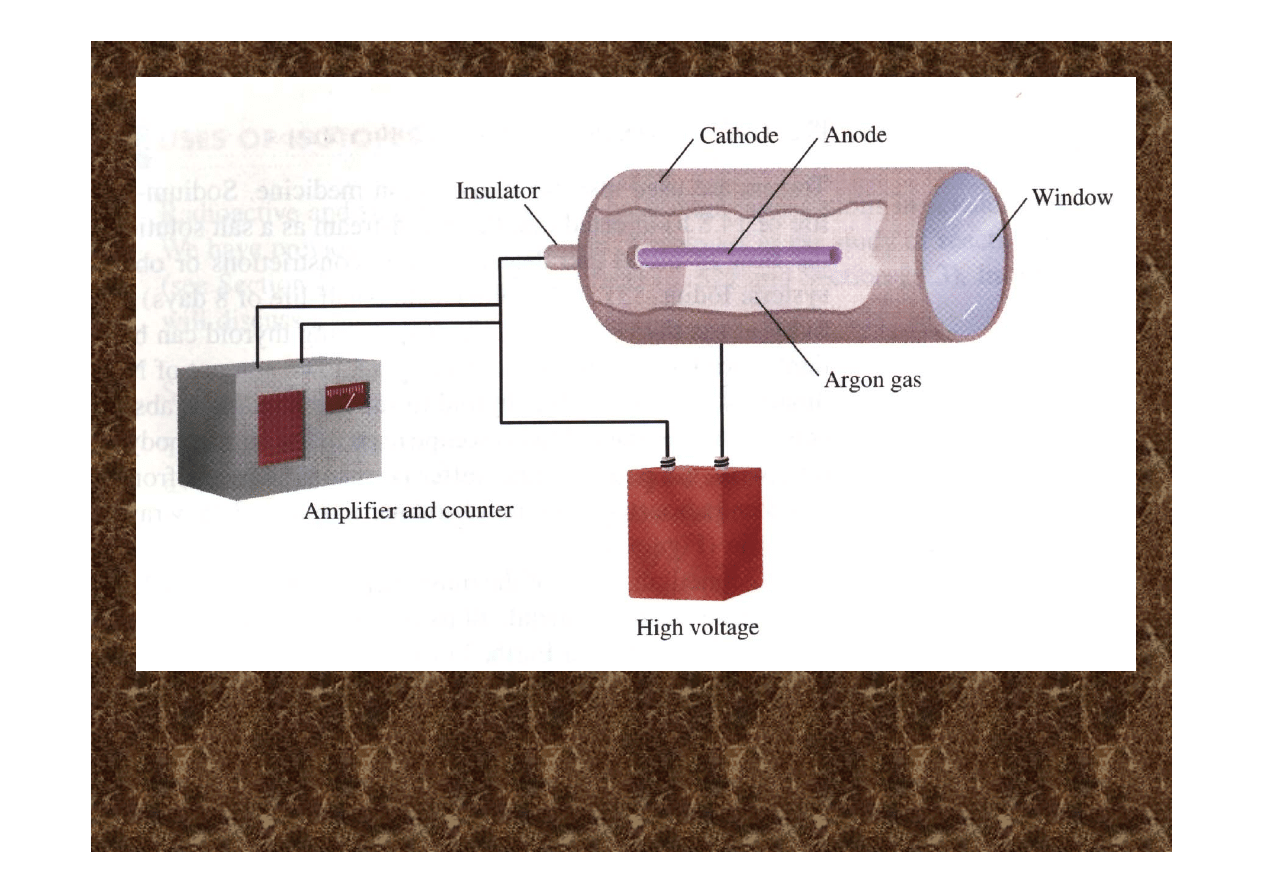
Przykład licznika wykorzystującego argon

KRYPTON
• uzyskuje się go przez destylację frakcyjną powietrza
• w mieszance z argonem wykorzystuje się go w lampach
fluorescencyjnych i stroboskopowych
• stosuje się go w radioanalizie chemicznej i medycynie
• używa się go również do produkcji lamp fotgraficznych
• jest stosunkowa drogim gazem 1dm
3
kosztuje około 100 zł
• można wyróżnić sześć stałych izotopów tego pierwiastki
• znane są jony tego pierwiastka tj. ArKr
+
, KrXe
+
, KrH
+
• tworzy także nietrwałe hydraty
• powstaje również w reaktorach atomowych.
O
H
Kr
2
6
⋅
n
Ba
Kr
n
U
2
141
56
92
36
235
92
+
+
→
+

Krypton stosuje się w lampach stroboskopowych
wykorzystywanych w dyskotekach, a także lampach
oświetlających pasy na lotniskach

Związki kryptonu
• potrafi tworzyć związki z fluorem w niskiej temperaturze i obecności
wyładowań elektrycznych
• kwas kryptonowy i jego sól
- H
2
KrO
4
- BaKrO
4
4
2
.
192
,
F
lub
2
KrF
KrF
Kr
elektr
wyłyładowa
C
t
>
−
=
o

KSENON
• nie tworzy hydratów z wodą a jedynie się w niej rozpuszcza.
• tworzy najwięcej trwałych związków chemicznych ze wszystkich
helowców z innymi pierwiastkami
• izotopy
133
Xe i
135
Xe powstają cały czas w reaktorach jądrowych, np.
n
Sr
Xe
U
2
95
38
138
54
235
92
+
+
→
• znane są związki ksenonu z fluorem, wodorem, deuterem i tlenem.
Część z tych związków posiada barwę.
• tlenki ksenonu są używane jako silne utleniacze
• izotop
133
Xe stosuje się w radioskopii
• stosuje się go do napełniania żarówek dużej mocy oraz do produkcji
lamp błyskowych.
• nadkseniany metali są najsilniejszymi ze znanych utleniaczy
• XeO
3
ma właściwości wybuchowe
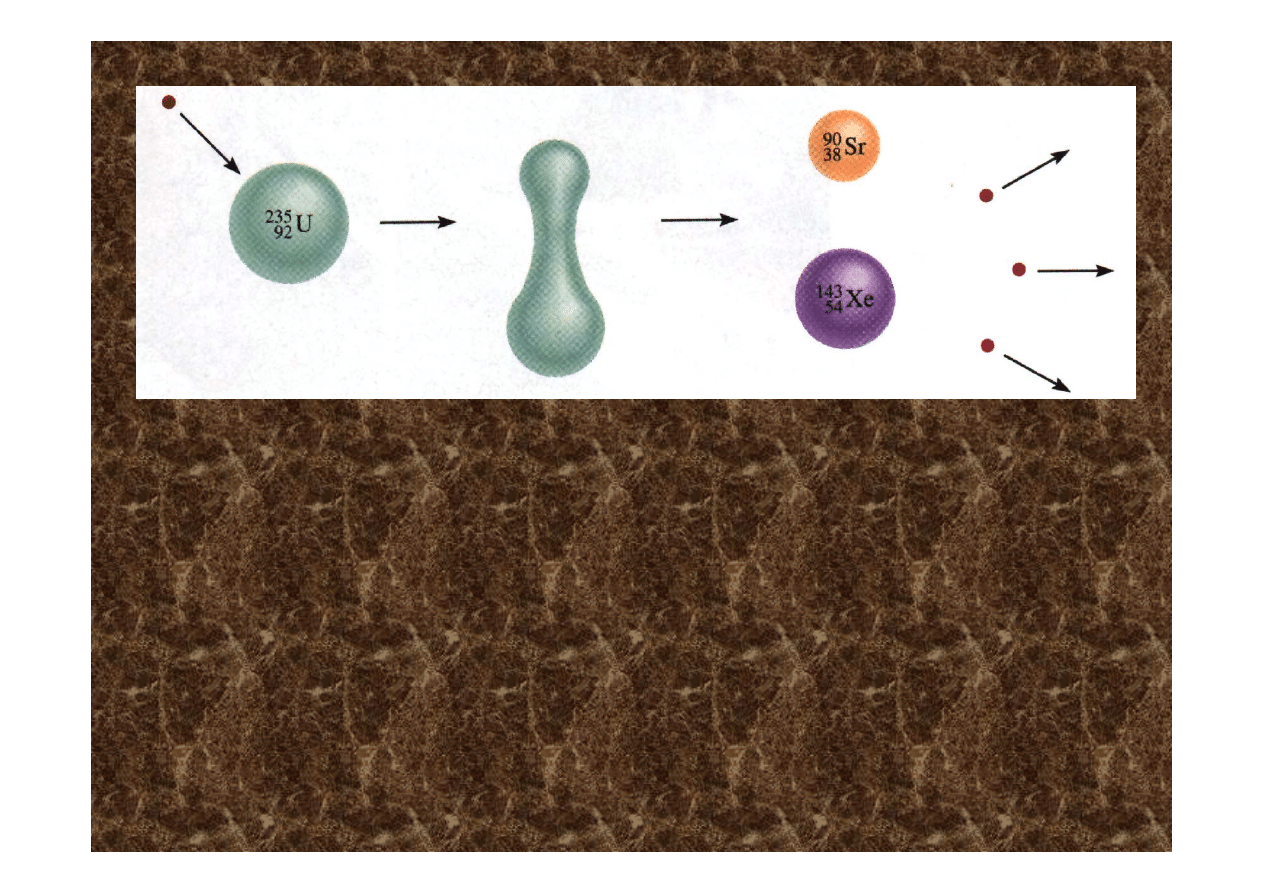
Obrazowe przedstawienie reakcji rozczepienia uranu
w której powstaje stront i ksenon

Reakcje ksenonu
XeF
4
---- produkt główny, kolor biały
XeF
2
----
produkt uboczny, kolor biały
XeF
6
----
produkt uboczny, bezbarwny
Xe + X F
2
Reakcja zachodzi w temperaturze 20ºC i pod ciśnieniem 6 atmosfer w obecności
katalizatorów niklowych.
XeO
4
+ 2H
2
O
H
4
XeO
4
kwas ksenonowy (VIII), bezbarwny
H
4
XeO
4
+ 4NaOH
Na
4
XeO
4
+ 4H
2
O nadksenonian sodu –
jeden z najsilniejszych znanych utleniaczy
2XeO
3
2Xe + 3O
2
trójtlenek ksenonu – substancja wybuchowa
t
∆

Schemat lampy
ksenonowej.

RADON
• najmniej trwały ze wszystkich gazów szlachetnych T
1
/
2
= około 4 dni
•
promieniotwórczy
• najcięższy znany gaz
• podczas jego chłodzenia poniżej temperatury zamarzania wykazuje
brylantową fosforescencję, która w miarę obniżania temperatury
przechodzi w żółtą a następnie w pomarańczowo-czerwoną
• często towarzyszy rudom uranowym
• tworzy nielotne związki z fluorem, ale ze względu na krótki okres
życia nie otrzymuje się ich w ilościach wagowych
• powstaje w reakcji tj.:
• występuje w niektórych naturalnych źródłach wodnych
• stosuje się go w medycynie do leczenia chorób stawów, obwodowego
układu nerwowego i zachorowań związanych z przemiany materii
+
+
→
2
4
2
222
86
226
88
He
Rn
Ra

BIBLIOGRAFIA
-
„Podstawy chemii nieorganicznej”- Adam Bielański
-
„Tablice chemiczne”- Witold Mizerski
-
„Chemia nieorganiczna”- F.A. Cotton, G. Wilkinson, P.L. Gaus
-
część materiału została opracowana na podstawie fragmentów
artykułów zaczerpniętych z portalu Wydawnictwa Szkolnego i
Pedagogicznego.
Jarosław Sukiennik © 2005
Document Outline
- HELOWCE
- Ogólna charakterystyka
- Schemat orbitali w hipotetycznej cz¹steczce He2 oraz w jonach He2+ i HeH+
- Zawartoœæ helowców w powietrzu
- Dlaczego argonu jest tak du¿o?
- Jedno z najpopularniejszych zastosowañ helu
- Podstawowe w³aœciwoœci helowców
- W³aœciwoœci i zastosowania helu
- NEON
- ARGON
- KRYPTON
- Zwi¹zki kryptonu
- KSENON
- Reakcje ksenonu
- RADON
- BIBLIOGRAFIA
Wyszukiwarka
Podobne podstrony:
Helowce i ich związki
12-helowceTECH, Materiały PG, Nieorgana
troche teorii, HELOWCE
Helowce – właściwości, otrzymywanie, występowanie(2)
Wodór i helowce
helowce
Helowce
Gazy szlachetne , Gazy szlachetne (helowce) - pierwiastki grupy 18 uk?adu okresowego
tekst do helowców, Chemia, Prezentacje
HELOWCE
Helowce, chemia
Helowce, Chemia, Chemia nieorganiczna
ZWIĄZKI HELOWCÓW
Związki Helowców
Helowce i ich związki
helowce
więcej podobnych podstron