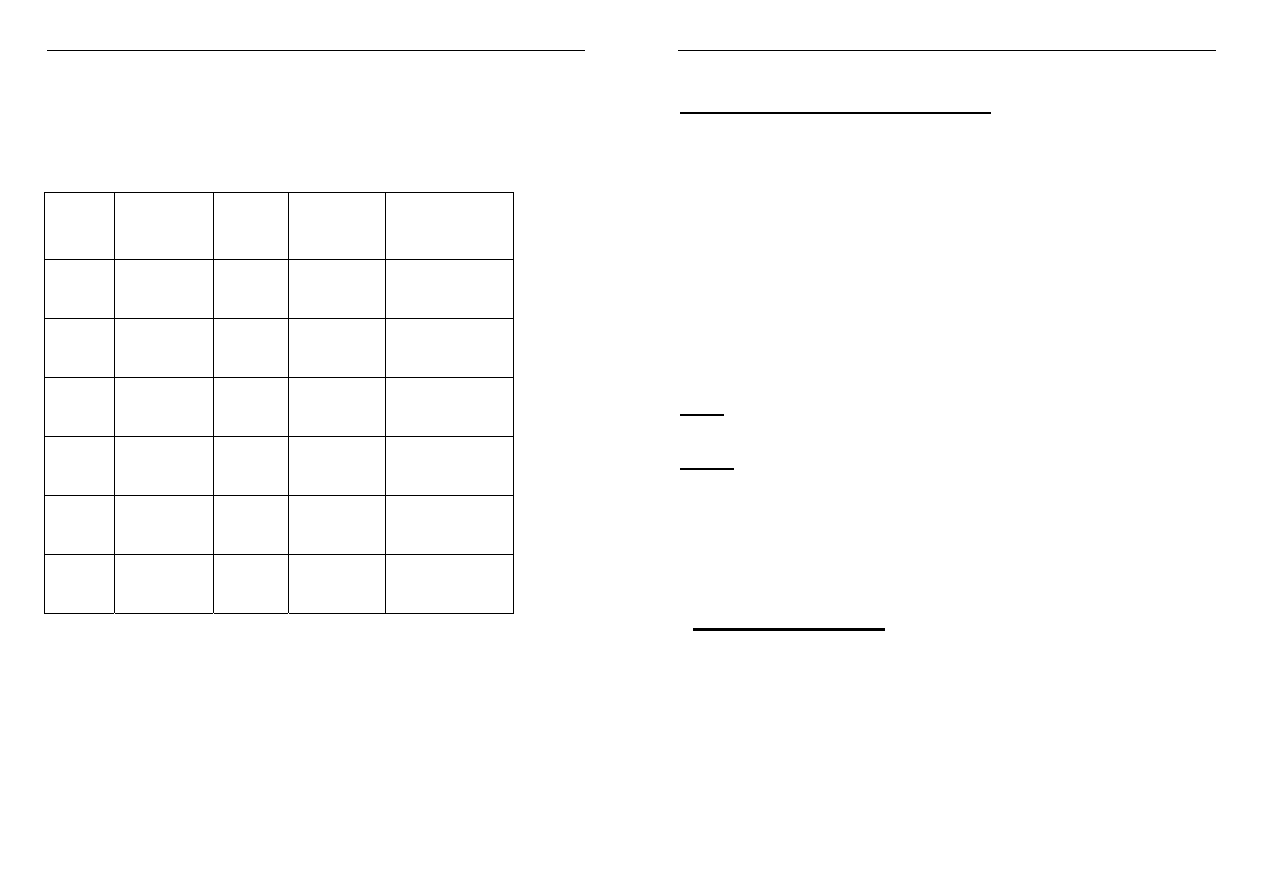
prof. dr hab. inż. Danuta Michalska-Fąk ; Chemia Nieorganiczna II – Seminarium – Kurs CHC1041s ; www.ch.pwr.wroc.pl/~d.michalska
15
HELOWCE (GAZY SZLACHETNE)
Ogólna charakterystyka
Symbol Nazwa
Walenc.
Konfig.
Elektr.
Temp.
wrzenia
(około)
zawartość w
powietrzu
( % obj.)
He
hel
1s
2
4,2 K 0,0005
Ne
neon
2s
2
p
6
27 K
0,0016
Ar
argon
3s
2
p
6
87 K
0,9325
Kr
krypton 4s
2
p
6
120 K 0,0001
Xe
ksenon
5s
2
p
6
165 K
8
x
10
-6
Rn
radon
6s
2
p
6
211 K
Bardzo trwałe konfiguracje elektronowe
Powietrze: N
2
77,4 K 78,09 %
O
2
90,2 K 20,95 %
inne (CO
2
, H
2
) ok. 0,03 %
Wszechświat: Hel jest 2-gim po wodorze
pod względem rozpowszechnienia
prof. dr hab. inż. Danuta Michalska-Fąk ; Chemia Nieorganiczna II – Seminarium – Kurs CHC1041s ; www.ch.pwr.wroc.pl/~d.michalska
16
Właściwości fizyczne helowców
Są to gazy bezbarwne, bez smaku i zapachu.
Hel wykazuje najniższą temperaturę wrzenia: 4,2 K
(= temp. skroplenia pod normalnym ciśnieniem),
dlatego ciekły hel stosowany jest do otrzymywania najniższych
temperatur, tzw. helowych w kriotechnice).
Skroplony hel występuje w 2 odmianach:
hel I – własności cieczy (poniżej 4K)
hel II – „ nadciekły”
powstaje w temp. 2,17 K i p = ok. 5 000
Pa
ma bardzo małą lepkość i bardzo dobre
przewodnictwo cieplne
(1000 razy większe od przewodnictwa miedzi)
- stan nadciekły helu
prof. dr hab. inż. Danuta Michalska-Fąk ; Chemia Nieorganiczna II – Seminarium – Kurs CHC1041s ; www.ch.pwr.wroc.pl/~d.michalska
17
Helowce występują w postaci cząsteczek
jednoatomowych
cząsteczka He
2
jest nietrwała
He
2
He
2
+
HeH
+
jest mniej trwały trwalszy trwalszy
niż dwa atomy niż He i He
+
niż He i H
+
helu oddzielnie
Jony He
2
+
i HeH
+
powstają w czasie wyładowań
atmosferycznych.
prof. dr hab. inż. Danuta Michalska-Fąk ; Chemia Nieorganiczna II – Seminarium – Kurs CHC1041s ; www.ch.pwr.wroc.pl/~d.michalska
18
Otrzymywanie helowców
a) frakcjonowana destylacja powietrza
- wszystkie helowce z wyjątkiem radonu
b) He uzyskuje się też z gazu ziemnego
c) He i Ar powstają wskutek naturalnych
przemian promieniotwórczych, np.
226
Ra →
222
Rn +
4
He przemiana
α (
4
He)
40
K →
40
Ar +
0
β
+
Radon (Rn) jest naturalnym pierwiastkiem
promieniotwórczym. Znane są 23 izotopy Rn
3 główne izotopy radonu:
T
1/2
------------
radon
222
Rn (z szeregu U-Ra) 3,8 dnia
toron
220
Rn (Th - torowy) 56 s
aktynon
219
Rn (U-Ac aktynowy) 4 s

prof. dr hab. inż. Danuta Michalska-Fąk ; Chemia Nieorganiczna II – Seminarium – Kurs CHC1041s ; www.ch.pwr.wroc.pl/~d.michalska
19
Radon dyfunduje z podłoża (ze skorupy ziemskiej)
- najwięcej: w skałach granitowych
i w starych kopalniach rud uranu
- najmniej w skałach wapiennych
Jest 7,5 razy cięższy od powietrza
- akumuluje się w pomieszczeniach zamkniętych
wg zarządzenia Państwowej Agencji Atomistyki (1995 r)
dopuszczalne średnie roczne stężenie
222
Rn
w budynkach
do 200 Bq/m
3
(Bq = bekerel, jednostka aktywności ciała promieniotwórczego).
(nowe budynki muszą mieć atest radonowy)
prof. dr hab. inż. Danuta Michalska-Fąk ; Chemia Nieorganiczna II – Seminarium – Kurs CHC1041s ; www.ch.pwr.wroc.pl/~d.michalska
20
Właściwości chemiczne helowców
a) Rayleigh i Ramsey odkryli helowce
(1894-1898) ale nie udało im się wykryć żadnej reakcji
chemicznej tych pierwiastków – nieaktywne?
b) Bartlett, 1960:
+6 +1 +5
Xe + PtF
6
= XePtF
6
heksafluoro-
platynian(V)
ksenonu
Związek o barwie czerwono-pomarańcz.
Xe
+
[PtF
6
]
-
stały i trwały w temp. pokojowej.
Budowa jonowa w stanie stałym.
c) w latach 1960-64 otrzymano ponad
40 związków ksenonu, kryptonu i radonu
nadal nieznane są żadne związki He i Ne
prof. dr hab. inż. Danuta Michalska-Fąk ; Chemia Nieorganiczna II – Seminarium – Kurs CHC1041s ; www.ch.pwr.wroc.pl/~d.michalska
21
Związki Xe, Kr i Rn z fluorowcami
najważniejsze są fluorki ksenonu – z nich otrzymywane są inne
związki ksenonu
fluorki: XeF
2
, XeF
4
, XeF
6
KrF
4
powstają w czasie ogrzewania lub podczas wyładowań
elektrycznych :
Xe + F
2
= XeF
2
bezbarwne
ciała
XeF
2
+ F
2
= XeF
4
krystaliczne
XeF
4
+ F
2
= XeF
6
F
F Xe F
F
Struktura kwadratowa
prof. dr hab. inż. Danuta Michalska-Fąk ; Chemia Nieorganiczna II – Seminarium – Kurs CHC1041s ; www.ch.pwr.wroc.pl/~d.michalska
22
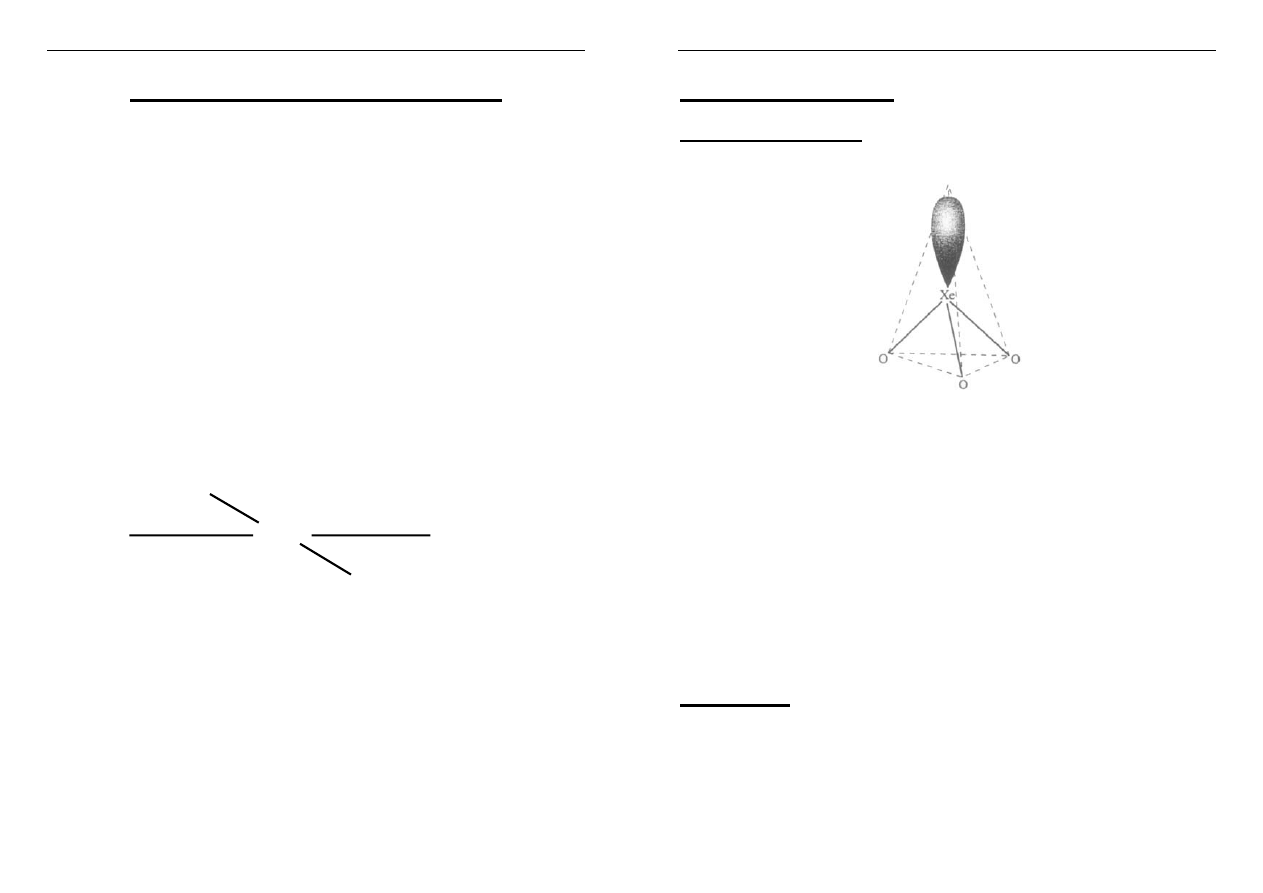
Związki Xe z tlenem
Tritlenek ksenonu: XeO
3
bezbarwne ciało stałe
struktura piramidy trygonalnej
powstaje: XeF
6
+ 3H
2
O = XeO
3
+ 6HF
(XeO
3
w r-rze wodnym jest silnym utleniaczem:
Mn
2+
ÆMnO
4
-
)
Oxofluorki: XeOF
4
XeO
2
F
2
Powstają: np. XeF
6
+ H
2
O = XeOF
4
+ 2HF
prof. dr hab. inż. Danuta Michalska-Fąk ; Chemia Nieorganiczna II – Seminarium – Kurs CHC1041s ; www.ch.pwr.wroc.pl/~d.michalska
23
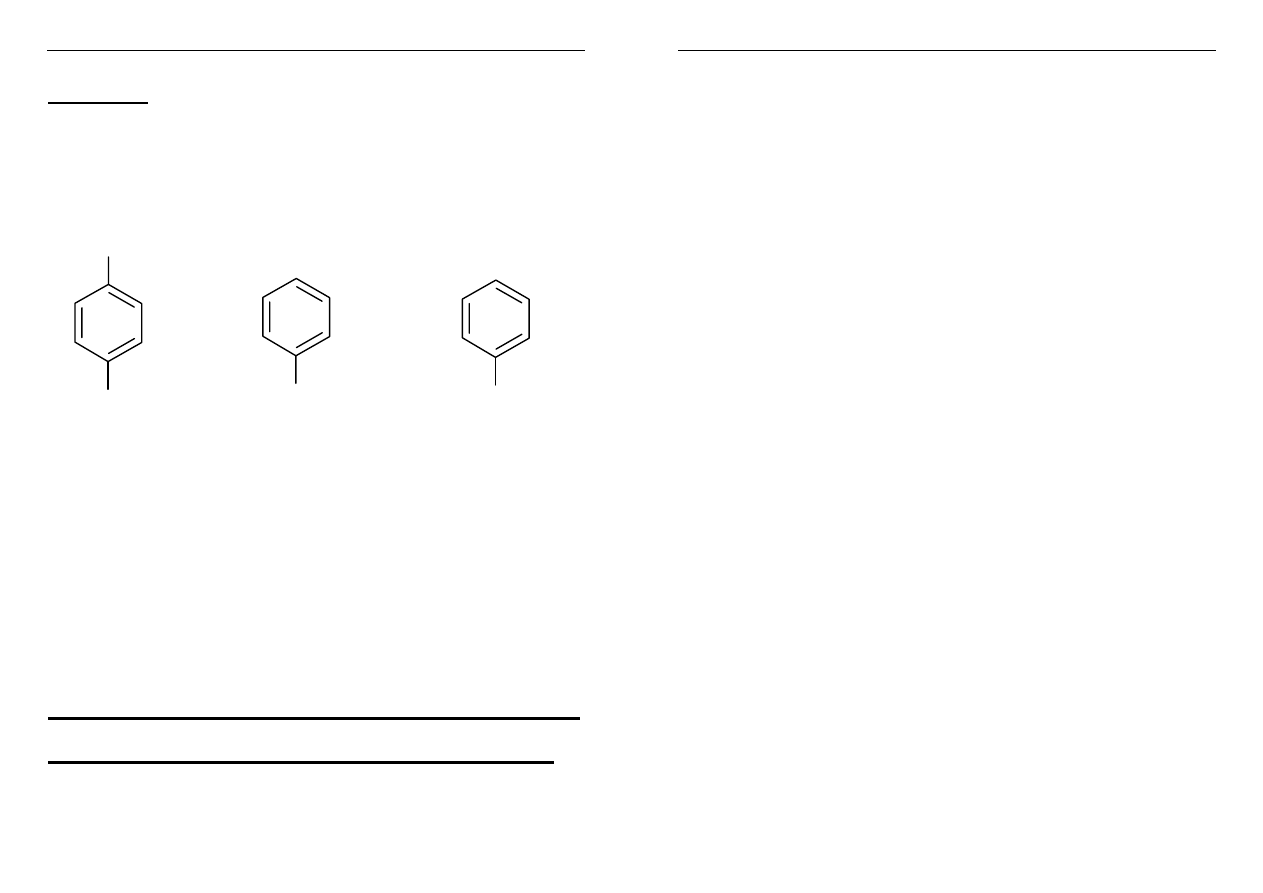
Klatraty
(od łacińskiego słowa clathratus –
zamknięty w klatce
Niektóre związki chemiczne, np.
OH
OH
OH
NH
2
hydrochinon fenol anilina
podczas krzepnięcia OKLUDUJĄ
we wnękach swej sieci przestrzennej takie
cząsteczki obce jak: SO
2
, H
2
S, HCl, Ar, Xe.
( i inne gazy szlachetne z wyjątkiem He).
Wnęki mają średnicę do kilkuset pm
Cząsteczki obce zostają we wnękach uwięzione w
sposób mechaniczny, bez wiązań chemicznych.
prof. dr hab. inż. Danuta Michalska-Fąk ; Chemia Nieorganiczna II – Seminarium – Kurs CHC1041s ; www.ch.pwr.wroc.pl/~d.michalska
24
np. klatraty hydrochinonu – substancji
macierzystej
z ksenonem i argonem:
[C
6
H
4
(OH)
2
]
3
· 0,88 Xe [C
6
H
4
(OH)
2
]
3
· 0,8 Ar
Gazy: Ar i Xe można odzyskać rozpuszczając
klatrat np. w alkoholu metylowym
lub ogrzewając w 390 K
Klatraty: hydraty helowców
Y · 5,75 H
2
O (Y – atom helowca)
Cząsteczki wody krzepną w obecności helowców.
Komórka elementarna zawiera 46 cząsteczek
wody, między którymi jest 8 wnęk (luk) –
wypełnianych przez helowce.
Stosunek liczby cząsteczek H
2
O : cząsteczek Y=
46/8 = 5,75
prof. dr hab. inż. Danuta Michalska-Fąk ; Chemia Nieorganiczna II – Seminarium – Kurs CHC1041s ; www.ch.pwr.wroc.pl/~d.michalska
25
Zastosowanie helowców
a) He: do napełniania balonów (nie jest
palny i nie przenika przez powłokę balonu)
b) mieszanina O
2
i He
- gaz, którym oddychają
nurkowie przy podwyższonym ciśnieniu.
He rozpuszcza się we krwi w znacznie mniejszym
stopniu niż N
2
, który może wydzielić się w postaci
pęcherzyków zamykających naczynie krwionośne
(kiedy gwałtownie zmniejszy się ciśnienie).
c) skroplony He
(4 K) – w laboratoriach
naukowych
d) Kr, Xe
- do napełniania żarówek (są trwalsze,
bo ograniczają powolne parowanie metalu (W)
z rozżarzonego włókna wolframowego).
e) Produkcja barwnych świateł „neonów” :
Rozrzedzone gazy szlachetne podczas
wyładowań elektrycznych emitują barwne
światło: Ne -
c
c
z
z
e
e
r
r
w
w
o
o
n
n
e
e
, He -
ż
ż
ó
ó
ł
ł
t
t
e
e
,
He + Hg
(gaz)
-
n
n
i
i
e
e
b
b
i
i
e
e
s
s
k
k
i
i
e
e
Wyszukiwarka
Podobne podstrony:
Helowce i ich związki
3 Helowce
12-helowceTECH, Materiały PG, Nieorgana
troche teorii, HELOWCE
Helowce – właściwości, otrzymywanie, występowanie(2)
Wodór i helowce
Helowce
Gazy szlachetne , Gazy szlachetne (helowce) - pierwiastki grupy 18 uk?adu okresowego
tekst do helowców, Chemia, Prezentacje
HELOWCE
Helowce, chemia
Helowce, Chemia, Chemia nieorganiczna
ZWIĄZKI HELOWCÓW
Związki Helowców
Helowce i ich związki
3 Helowce
helowce
więcej podobnych podstron