
Helowce
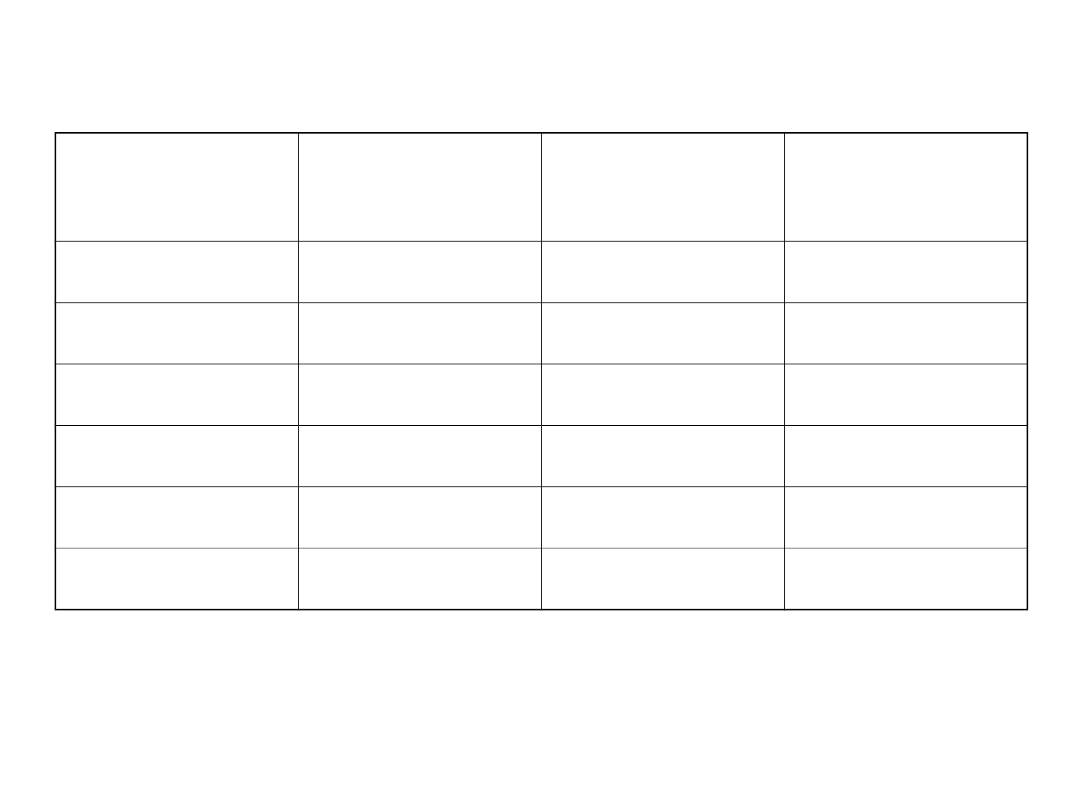
Pierwiastek
Symbol
Konfiguracja
elektronowa
Energia
jonizacji
[kJ/mol]
Hel
He
1 s
2
2372
Neon
Ne
2s
2
p
6
2080
Argon
Ar
3s
2
p
6
1521
Krypton
Kr
3d
10
4s
2
p
6
1351
Ksenon
Xe
4d
10
5s
2
p
6
1170
Radon
Rn
4f
14
5d
10
6s
2
p
6
1037
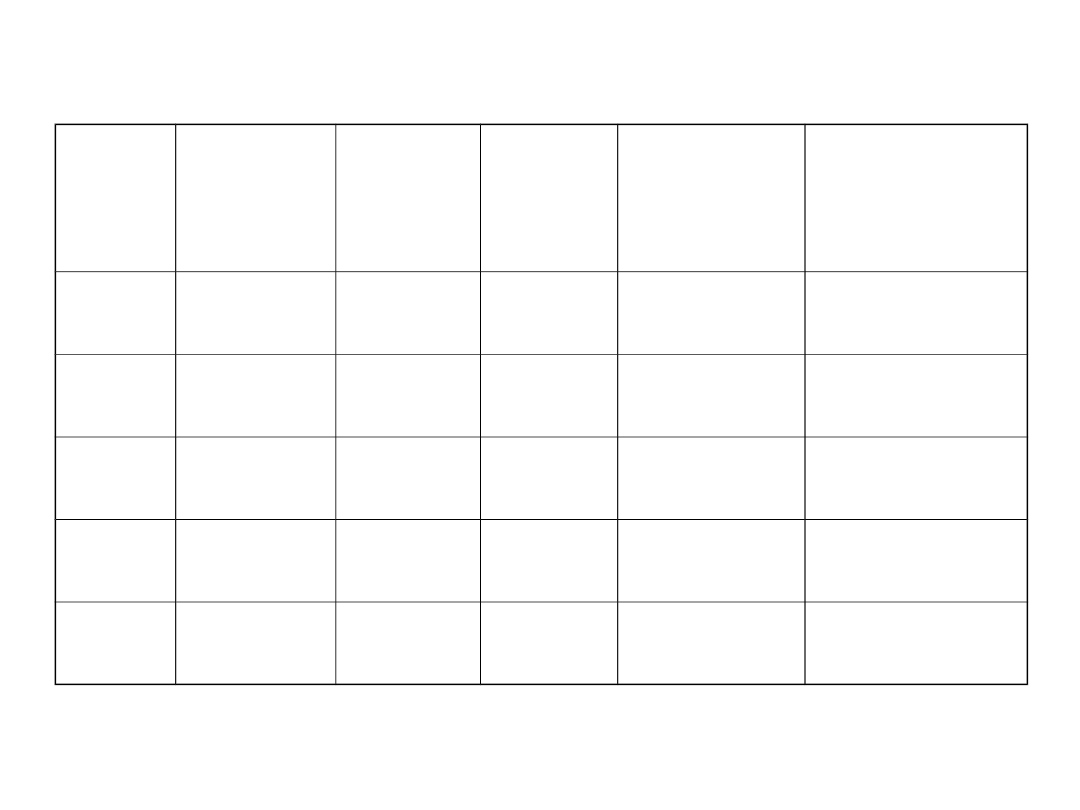
Symb
ol
Ciepło
parowan
ia
[kJ/mol]
Temp.
topnien
ia
Temp.
wrzeni
a
Promień
atomu
[nm]
Zawartość w
atmosferze
[% obj]
He
0.09
-268.9
0.12
5.2*10
-4
Ne
1.8
-248.6
-246.0
0.16
1.8*10
-3
Ar
6.3
-189.4
-185.9
0.191
0.9
Kr
9.7
-157.2
-153.2
0.200
1.1*10
-3
Rn
13.7
-111.9
-108.1
0.220
8.8*10
-6

Występowanie i otrzymywanie
• Wydzielanie mieszaniny helowców z powietrza:
– Usuwanie tlenu:
2 Cu + O
2
→ 2 CuO
– Usuwanie azotu:
3 Mg + N
2
→ Mg
3
N
2
99.8% Ar + 0.2% pozostałe
• Destylacja frakcyjna skroplonego powietrza
• Hel otrzymuje się z gazu ziemnego

Zastosowanie
• Ar i He stosuje się w wielu procesach przemysłowych
wymagających atmosfery obojętnej
(elektronika, metalurgia
czystych metali)
• Ar – do napełniania żarówek, świetlówek, lamp
elektronowych, liczników Geigera itp..
• He
– do napełniania balonów i sterowców
– do utrzymywania niskich temperatur nadprzewodników
– w mieszaninie z tlenem jako gaz do oddychania w aparatach
tlenowych
• Ne – do napełniania lamp neonowych

Połączenia helowców
• Związki w stanach wzbudzonych:
stan podstawowy 1 s
2
1924 kJ/mol → stan wzbudzony
1s
1
2s
1
He
2+
, HeH
+
, HeH
2+
• Połączenia typu dipol indukowany – dipol indukowany
• Klatraty
– klatraty hydrochinonu
– hydraty

„Prawdziwe” związki chemiczne
• Bartlett lata 60-te XX wieku
•
O
2
+ PtF
6
→ O
2+
[PtF
6-
]
• Energia jonizacji O
2
= 1180 kJ/mol
• Energia jonizacji Xe = 1170 kJ/mol
•
Xe + PtF
6
→ Xe
+
[PtF
6-
]
• Jednocześnie Hoppe na podstawie energii
hipotetycznych wiązań doszedł do wniosku
że muszą istnieć XeF
2
i XeF
4
• W 1964 r znano już ok. 40 połączeń Xe i Kr z
fluorem i tlenem
Xe
O
r
r
2
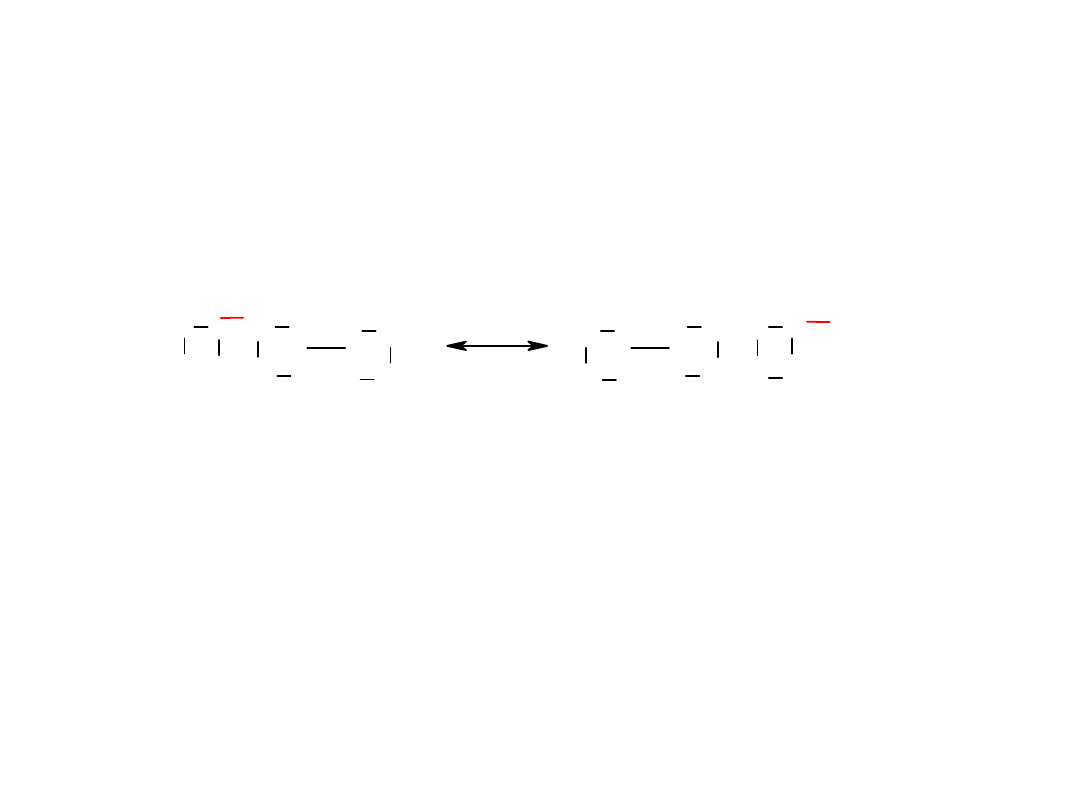
Możliwość tworzenia związków
•
GX
2
gdzie G – atom gazu szlachetnego, X – atom tworzący połączenie
Warunki tworzenia:
1
o
Możliwie niska energia jonizacji gazu szlachetnego < 1500 kJ/mol
2
o
Możliwie duże powinowactwo elektronowe pierwiastka X
Wniosek:
Związki mogą tworzyć Kr, Xe i Rn z pierwiastkami silnie elektroujemnymi o
małych atomach (F, O, Cl)
X
G
+
X
Struktury graniczne:
X
G
+
X
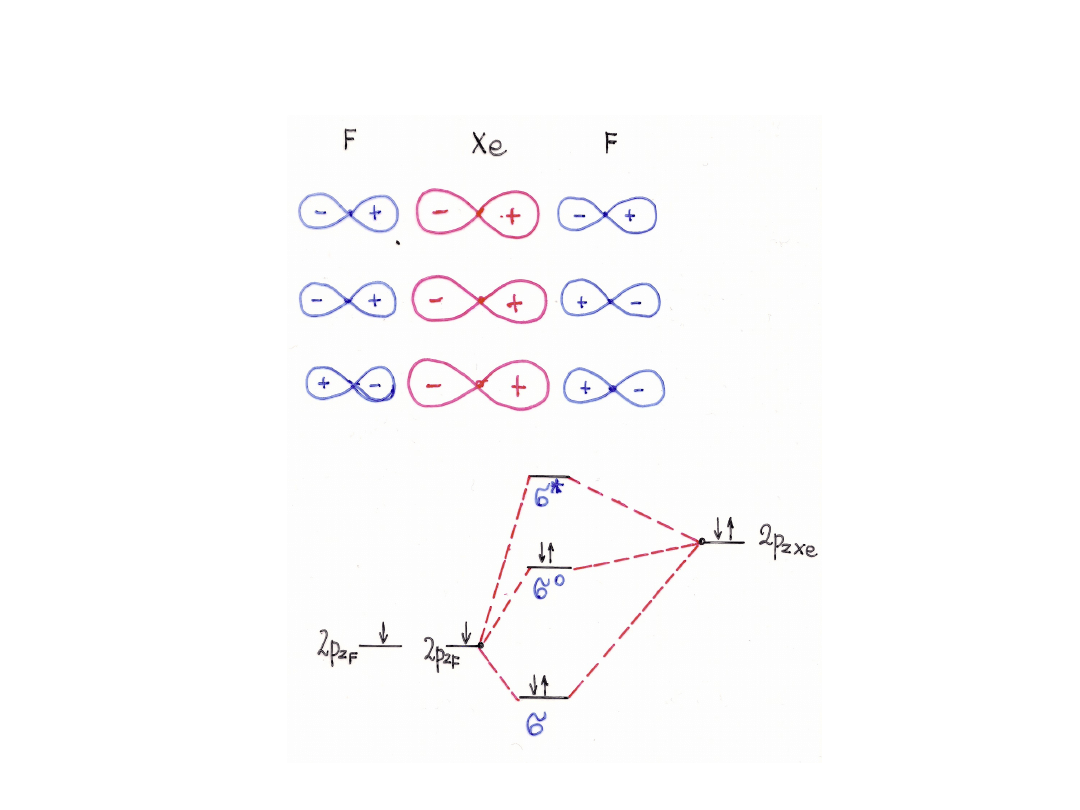
Możliwość tworzenia związków w świetle teorii MO
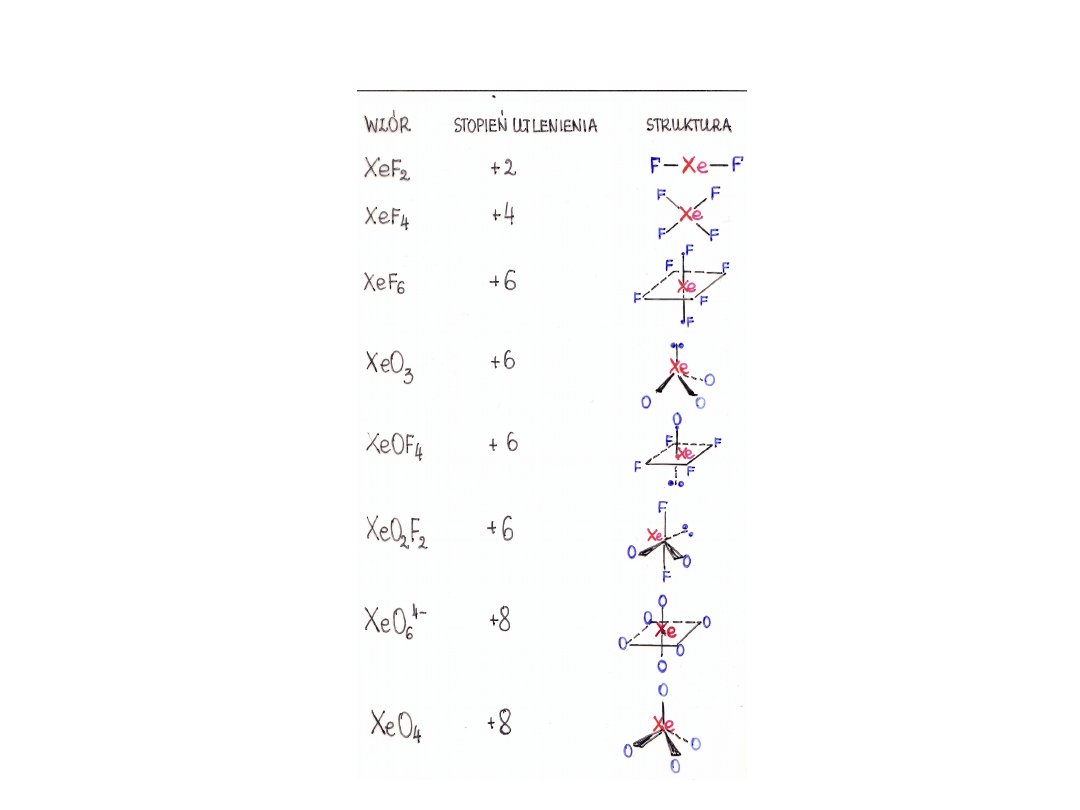
Struktury przestrzenne
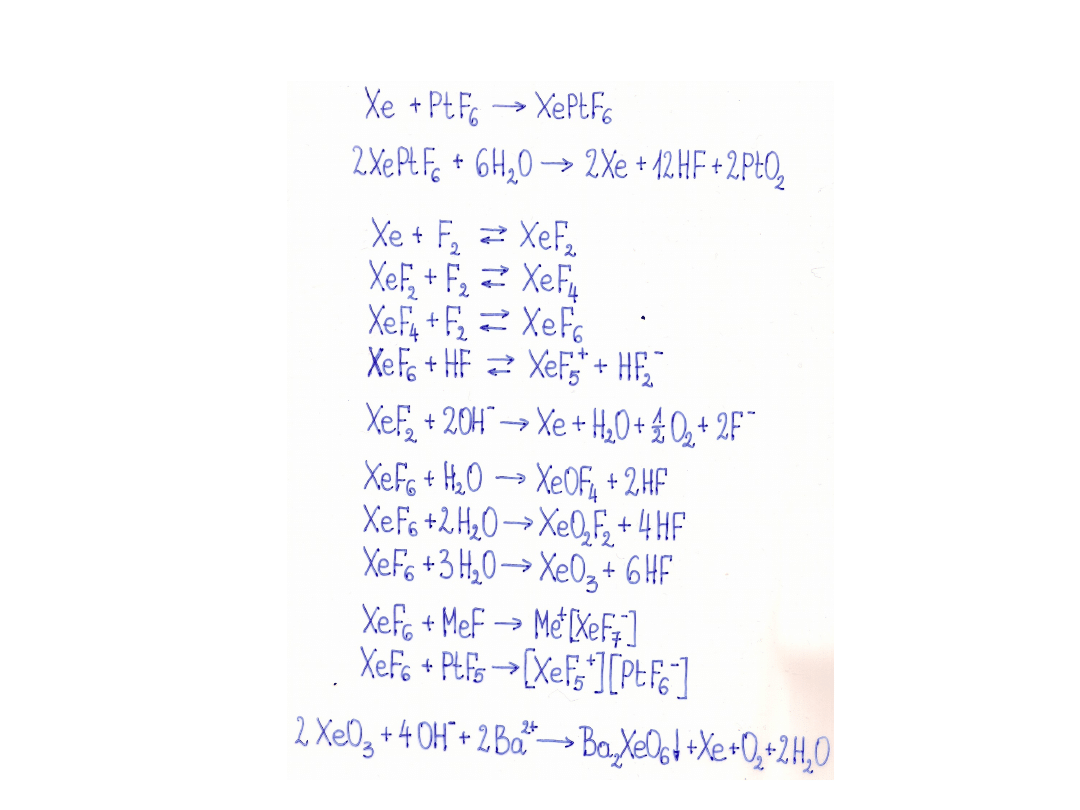
Przykłady związków i ich reakcje
Document Outline
Wyszukiwarka
Podobne podstrony:
Helowce i ich związki
3 Helowce
12-helowceTECH, Materiały PG, Nieorgana
troche teorii, HELOWCE
Helowce – właściwości, otrzymywanie, występowanie(2)
Wodór i helowce
helowce
Gazy szlachetne , Gazy szlachetne (helowce) - pierwiastki grupy 18 uk?adu okresowego
tekst do helowców, Chemia, Prezentacje
HELOWCE
Helowce, chemia
Helowce, Chemia, Chemia nieorganiczna
ZWIĄZKI HELOWCÓW
Związki Helowców
Helowce i ich związki
3 Helowce
helowce
więcej podobnych podstron