
Rotacje bryły sztywnej
H =
1
2
I
2
=
L
2
2I
Energia kinetyczna ruchu
obrotowego bryły sztywnej dla
obrotu wokół osi głównej
H =
L
2
2I
Stąd operator hamiltona
L
2
=−ℏ
2
[
1
sin
∂
∂
sin ∂
∂
1
sin
2
∂
2
∂
2
]
H Y ,=E Y ,
−ℏ
2
2I
[
1
sin
∂
∂
sin ∂
∂
1
sin
2
∂
2
∂
2
]
Y ,=E Y ,
L
2
2I
Y ,=E Y ,
−ℏ
2
2I
[
1
sin
∂
∂
sin ∂
∂
1
sin
2
∂
2
∂
2
]
Y ,=E Y ,
[
1
sin
∂
∂
sin ∂
∂
1
sin
2
∂
2
∂
2
]
Y , =
−
E 2I
ℏ
2
Y ,
[
sin ∂
∂
sin ∂
∂
∂
2
∂
2
]
Y ,=−⋅sin
2
Y ,
//⋅sin
2
=
2IE
ℏ
2
Y , =⋅=
// /
sin
∂
∂
sin
∂
∂
1
∂
2
∂
2
sin
2
=
0
Szukamy rozwiązania w postaci:

sin
∂
∂
sin
∂
∂
sin
2
=−
1
∂
2
∂
2
−
1
∂
2
∂
2
=
m
2
sin
∂
∂
sin
∂
∂
sin
2
=
m
2
∂
2
∂
2
m
2
=
0
=
a expi m
2 =
expi m =1
m=0,±1,±2,±3,⋯
L=P=constans=m
2

x=cos
x
2
=
cos
2
1−x
2
=
sin
2
dx
d
=−
sin
P x
1−x
2
d
2
P
dx
2
−
2x
dP
dx
[−
m
2
1−x
2
]
P=0
po przekształceniach otrzymujemy
Ponieważ
jest stałą wyznaczyć ją można dla m=0
Drugie z równań po podstawieniu
szukamy rozwiązania w postaci
P x=
∑
k
a
k
x
k
k=0,1, 2,3,⋯, K
1−x
2
d
2
P
dx
2
−
2x
dP
dx
P=0
dP x
dx
=
∑
k
a
k
k x
k−1
d
2
P x
dx
2
=
∑
k
a
k
k k−1 x
k−2
żeby istniało rozwiązanie trywialne x=0
współczynniki przy tej samej potędze
muszą dać 0

a
k2
k1k2−a
k
k k−1−2a
k
k a
k
=
0
a
k2
k1k2=a
k
[
k k1−]
a
k2
a
k
=
k
k2
−
k1k2
żeby szereg był zbieżny
a
k2
a
k
1
a
k2
0
=
k k1
=
l l1
Zamienimy oznaczenie
=
2IE
ℏ
2
E=
l l1 ℏ
2
2I

Y , =Y
m
l
, =[
2l1
4
l−∣m∣!
l∣m∣!
]
1
2
P
l
m
cos e
i m
harmoniki sferyczne
P
l
m
cos=1−cos
1
2
∣
m∣
d
∣
m∣
P
l
cos
d cos
2
∣
m∣
P
l
cos =
1
2
l
l !
d
l
cos
2
−
1
l
d cos
l
Stowarzyszona
funkcja
Legendre'a
Wielomian
Legendre'a
Ogólnie rozwiązanie obu równań możemy zapisać w
postaci
(
)
(
)
00
11
10
1 1
2
20
1
( , )
4
3
3 (
)
( , )
sin exp( )
8
8
3
3
( , )
cos
4
4
3
3 (
)
( , )
sin exp(
)
8
8
5
,
3cos
1
16
Y
x iy
Y
i
r
z
Y
r
x iy
Y
i
r
Y
θ φ
π
θ φ
θ
φ
π
π
θ φ
θ
π
π
θ φ
θ
φ
π
π
θ φ
θ
π
−
=
+
= −
= −
=
=
−
=
−
=
=
−
Ze względu na występujące we wzorach tych funkicj liczby kwantowe l I m
możemy te funkcje numerować tymi liczbami kwantowymi.
Przykładowe funkcje falowe dla początkowych liczb kwantowych l i m
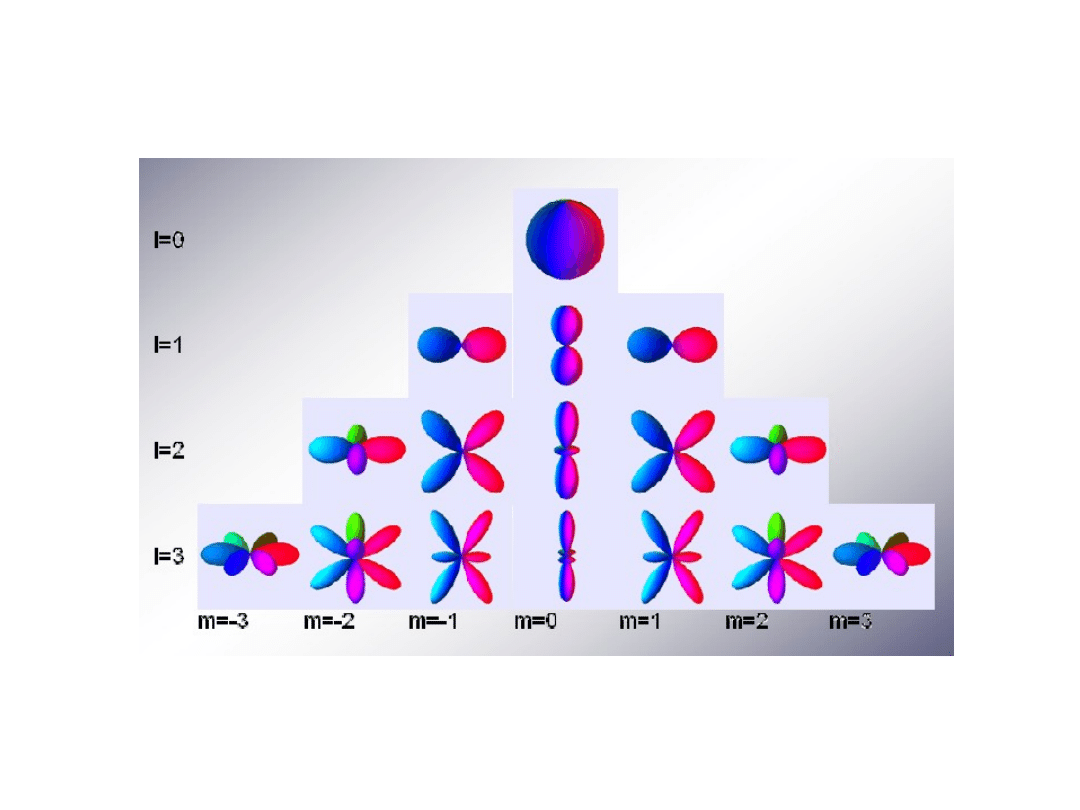
Shapes of the spherical harmonics

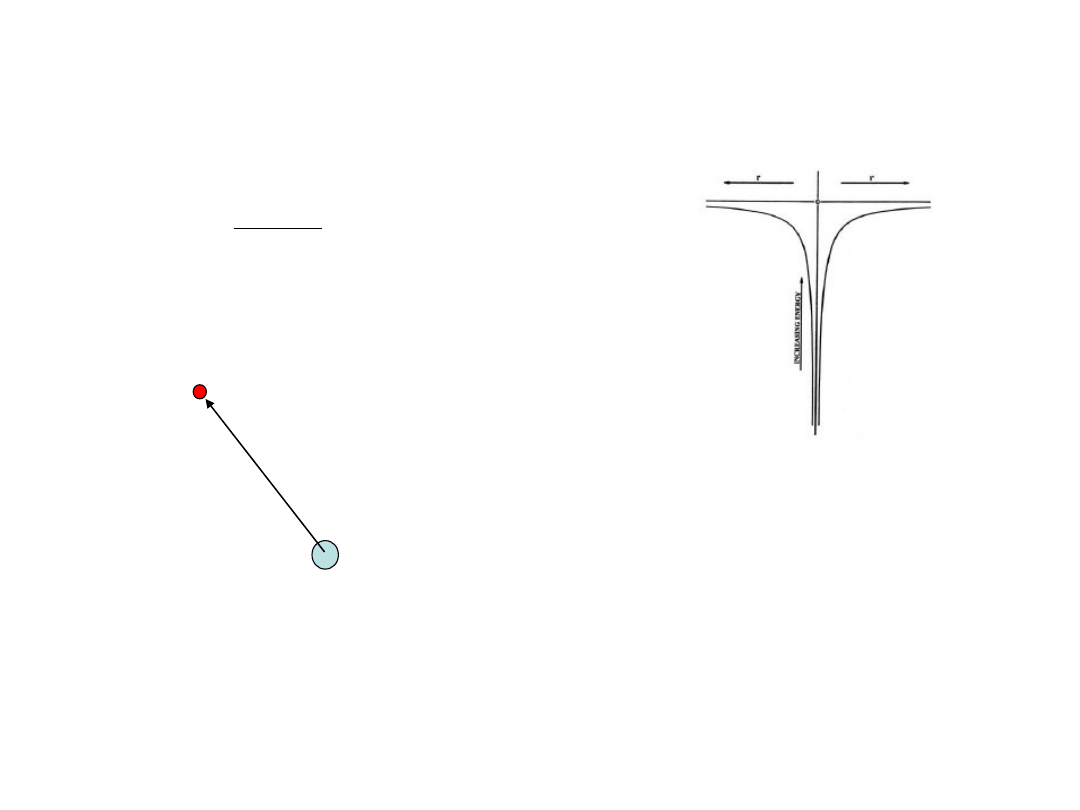
Model “planetarny” Bohra atomu wodoru (1913r)
Elektron krąży po orbitach kołowych wokół jądra atomowego. Rolę siły
dośrodkowej spełnia siła oddziaływania elektrycznego. Stabilne orbity to te, dla
których moment pędu elektronu jest całkowitą wielokrotnością h/2
mvr=n h
2
=
n ℏ
e
2
4
0
r
2
=
m
2
r
Stąd
r
n
=
4
0
ℏ
2
m e
2
n
2
E=E
kin
E
pot
=
m v
2
2
−
e
2
4
0
r
E
n
=
−
e
2
8
0
r
n
Atom promieniuje energię porcjami ( kwantami)
To wyjaśniało istnienie linii widmowych.
h =E
n
−
E
n '
=
Rc 1
n '
2
−
1
n
2
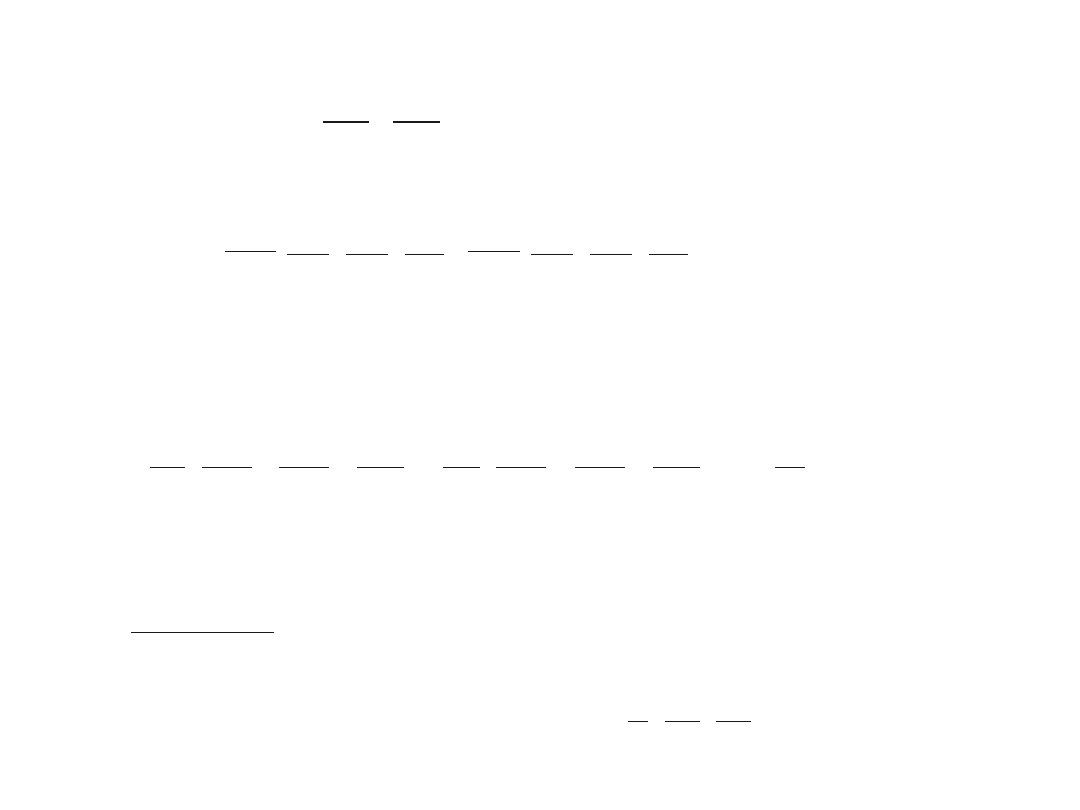
Atom wodoru
2
0
( )
4
Ze
V r
r
πε
= −
r
+Ze
-e
E
total
=
p
1
2
2m
1
p
2
2
2m
2
V r
1
, r
2
Równanie Schrodingera dla atomu wodoru
p
1
2
=
p
1x
2
p
1y
2
p
1z
2
p
2
2
=
p
2x
2
p
2y
2
p
2z
2
H
=
−ℏ
2
2m
1
∂
2
∂
x
1
2
∂
2
∂
y
1
2
∂
2
∂
z
1
2
−
ℏ
2
2m
2
∂
2
∂
x
2
2
∂
2
∂
y
2
2
∂
2
∂
z
2
2
V
r
1,
r
2
H
=
E
[
1
m
1
∂
2
∂
x
1
2
∂
2
∂
y
1
2
∂
2
∂
z
1
2
1
m
2
∂
2
∂
x
2
2
∂
2
∂
y
2
2
∂
2
∂
z
2
2
]
2
ℏ
2
E−V
r
1
,
r
2
=
0
Wprowadzamy współrzędne środka masy: X, Y, Z i współrzędne względne: x, y, z
X
=
m
1
x
1
m
2
x
2
m
1
m
2
Y
=
...
Z
=
...
x
=
x
2−
x
1
y
=
...
z
=
...
r
2
=
x
2
y
2
z
2
1
=
1
m
1
1
m
2
Masa zredukowana

[
1
m
1
m
2
∂
2
∂
X
2
∂
2
∂
Y
2
∂
2
∂
Z
2
1
∂
2
∂
x
2
∂
2
∂
y
2
∂
2
∂
z
2
]
2
ℏ
2
E−V
r
1
,
r
2
=
0
V r
1
,
r
2
=
V
z
X ,Y ,Z V
w
x , y , z
r
1
, r
2
=
1
X ,Y , Z⋅ x , y ,z
1
m
1
m
2
1
1
∂
2
∂
X
2
∂
2
∂
Y
2
∂
2
∂
Z
2
1
−
2
ℏ
2
V
z
X ,Y , Z =
=−
1
1
∂
2
∂
x
2
∂
2
∂
y
2
∂
2
∂
z
2
−
2
ℏ
2
E−V
w
r
L
=
P
=
const.
=
A
A
=
−
2
ℏ
2
E '
E
−
E '
=
Pierwszym równaniem nie będziemy się teraz zajmowac, gdyż opisuje oddziaływanie atomu z polem
zewnetrznym. Drugie opisuje oddziaływanie pomiędzy składnikami atomu – oddziawływania
wewnętrzne.
1
1
∂
2
∂
x
2
∂
2
∂
y
2
∂
2
∂
z
2
2
ℏ
2
−
V
w
=
0
Przechodzimy do współrzędnych sferycznych
∂
2
∂
x
2
∂
2
∂
y
2
∂
2
∂
z
2
1
r
2
∂
∂
r
r
2
∂
∂
r
1
r
2
sin
∂
∂
sin ∂
∂
1
r
2
sin
2
∂
2
∂
2
[
1
r
2
∂
∂
r
r
2
∂
∂
r
1
r
2
sin
∂
∂
sin ∂
∂
1
r
2
sin
2
∂
2
∂
2
]
2
ℏ
2
−
V
w
=
0
Rozdzielamy zmienne
r , ,=Rr Y ,
1
R
∂
∂
r
r
2
∂
∂
r
R
2 r
2
ℏ
2
−
V
w
=−
1
Y
[
1
sin
∂
∂
sin ∂
∂
1
sin
2
∂
2
∂
2
]
Y
L=P=const.=
'
=−
ℏ
i
2

∂
∂
r
r
2
∂
∂
r
R
2 r
2
ℏ
2
−
V
w
R= R
ℏ
i
2
[
1
sin
∂
∂
sin ∂
∂
1
sin
2
∂
2
∂
2
]=
'
Ostatnie równanie jest równaniem własnym dla kwadratu momentu pędu
L
2
Y =L
2
Y
∂
∂
r
r
2
∂
∂
r
R
2 r
2
ℏ
2
−
V
w
R= R
ℏ
i
2
[
1
sin
∂
∂
sin ∂
∂
1
sin
2
∂
2
∂
2
]
Y=' Y
1
R
∂
∂
r
r
2
∂
∂
r
R
2 r
2
ℏ
2
−
V
w
==
l l1
1
R
∂
∂
r
r
2
∂
∂
r
R
2 r
2
ℏ
2
−
V
w
==
l l1
1
r
2
∂
∂
r
r
2
∂
∂
r
R
2 r
2
ℏ
2
−
V
w
R−
l l1
r
2
R=0
Istnieje rozwiązanie tego równania dla
< 0
takiego, że
n
=−
k
Z
2
e
4
2 ℏ
2
n
2
k=
1
4
0
R r
nl
=
A
nl
e
−
r /2
r
l
L
2l1
n1
r
A
nl
=[
2Z
na
0
3
n−l−1!
2n [nl!]
3
]
1/2
n = 1,2,3,4, ...
l= 0, 1, 2, … , n-1
L
p
k
=
d
p
L
k
r
dr
p
Wielomian Laguerre'a stopnia k
L
k
r =e
r
d
k
r
k
e
−
r
dr
k
Stowarzyszony wielomian Laguerre'a
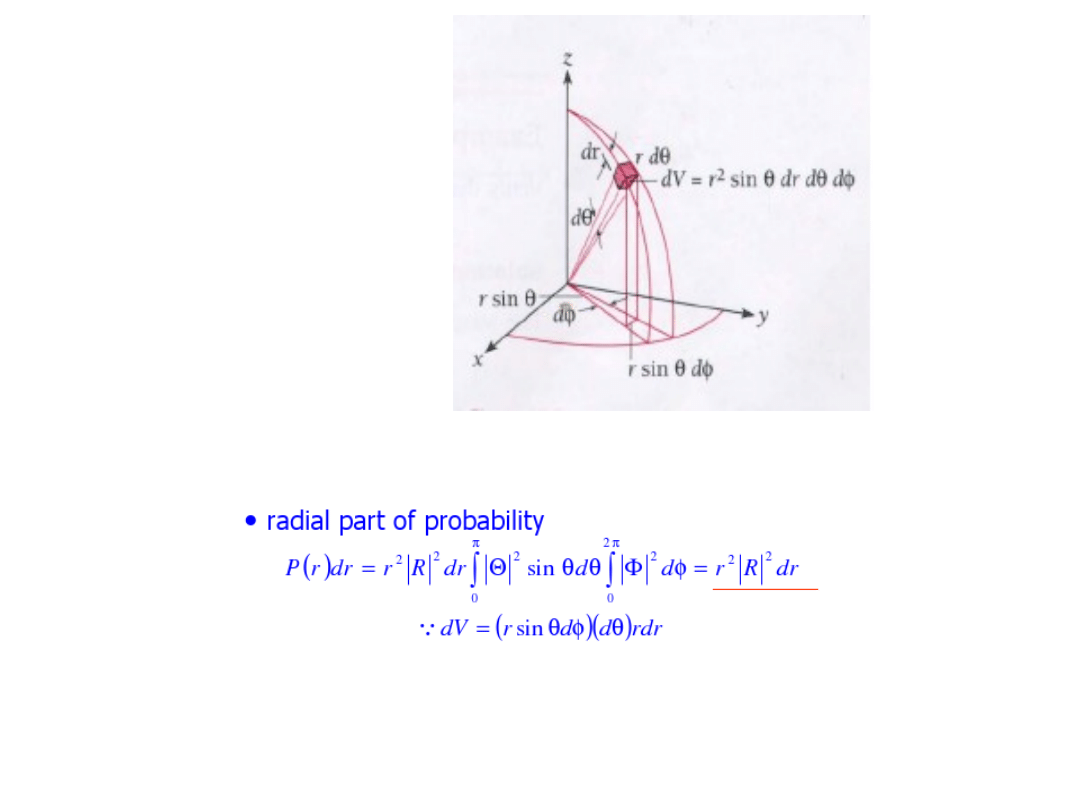
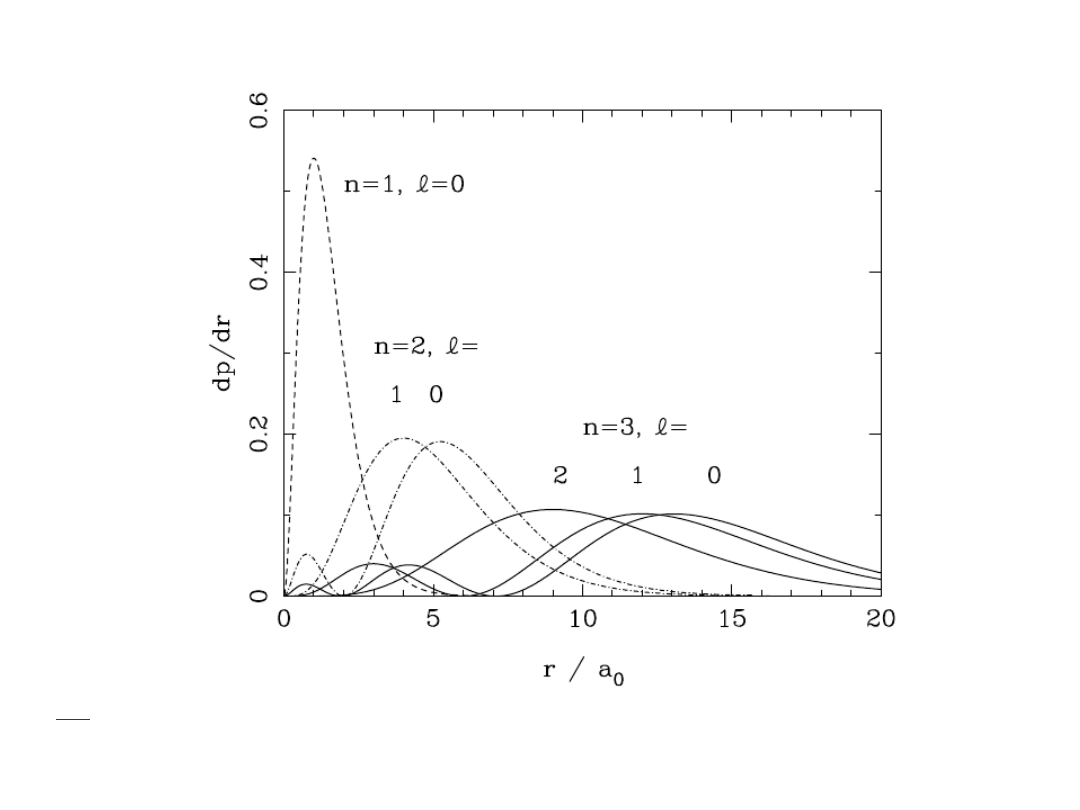
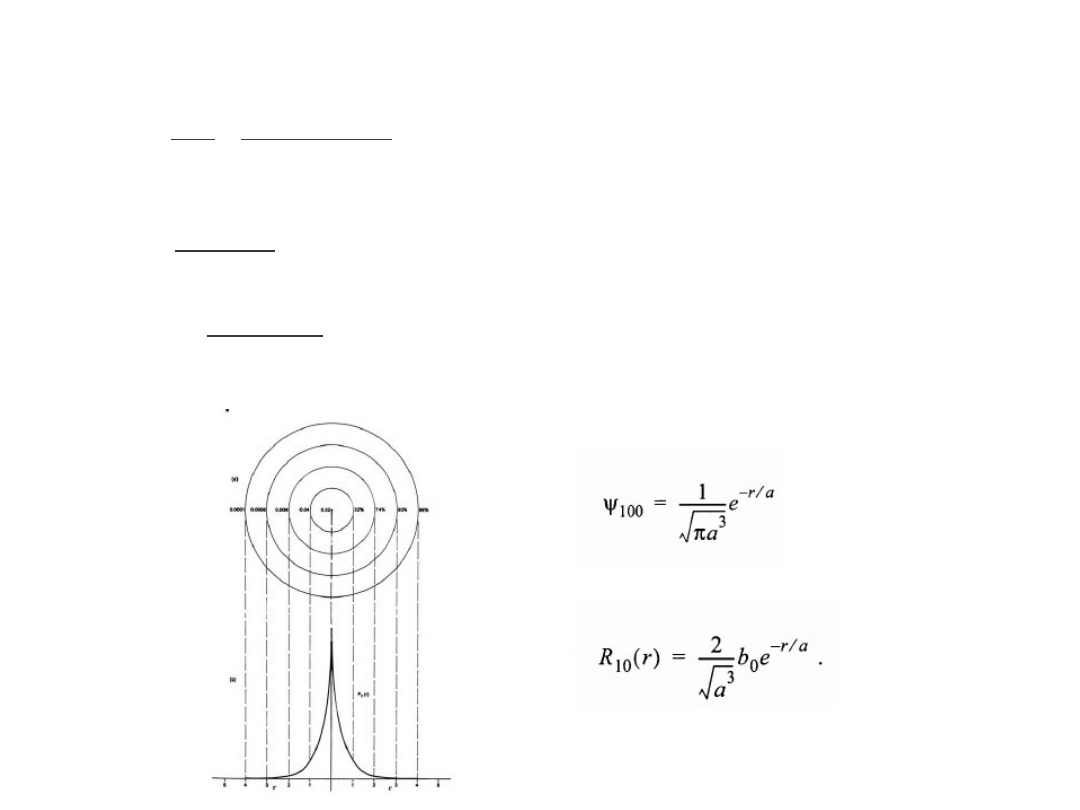
Prawdopodobieństwo znalezienia elektronu w odległości r od jądra atomowego
dp
dr
=
4 r
2
∣
R r∣
2
- rozkład radialny gęstości prawdopodobieństwa
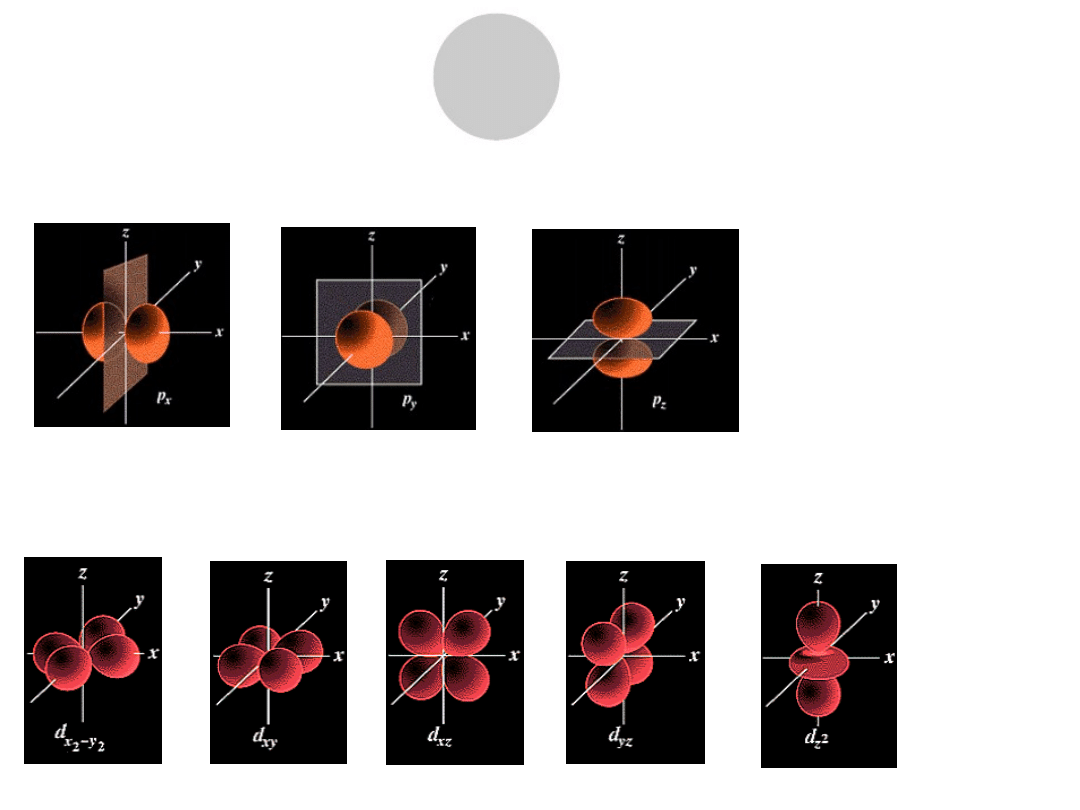
l = 1 orbital typu p ( 3 różne dla m = -1, 0 , 1) ozn. Px, py, pz
l = 0 orbital typu s




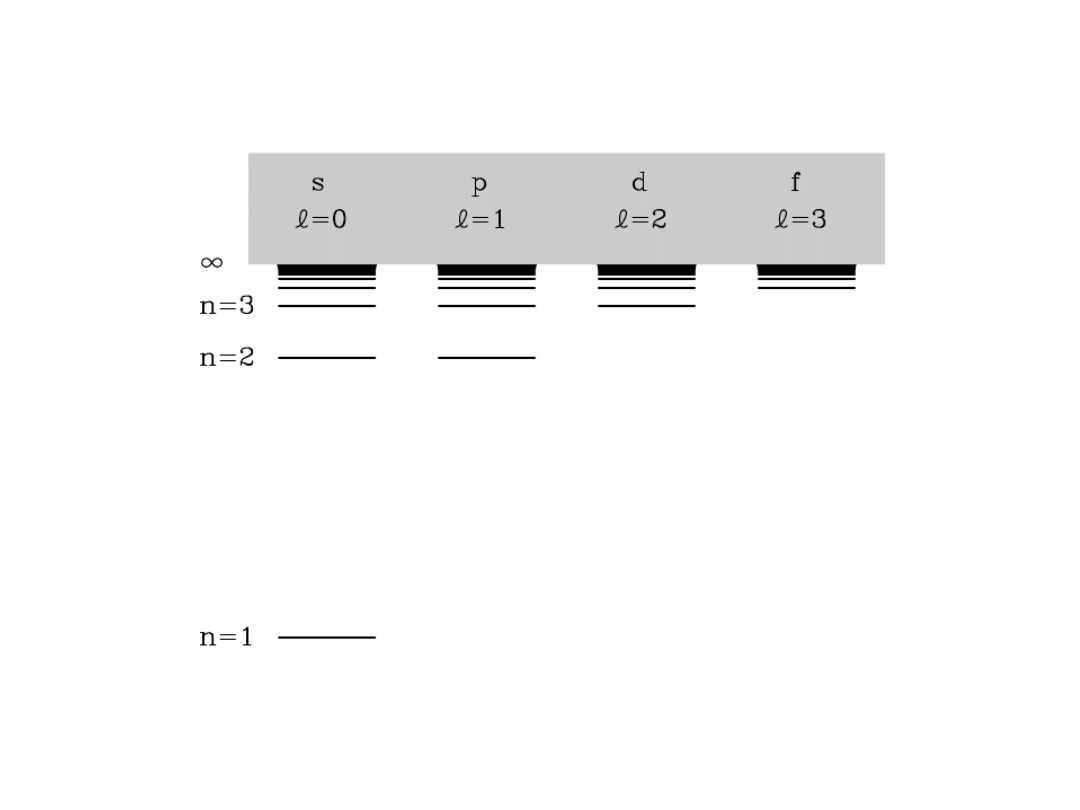
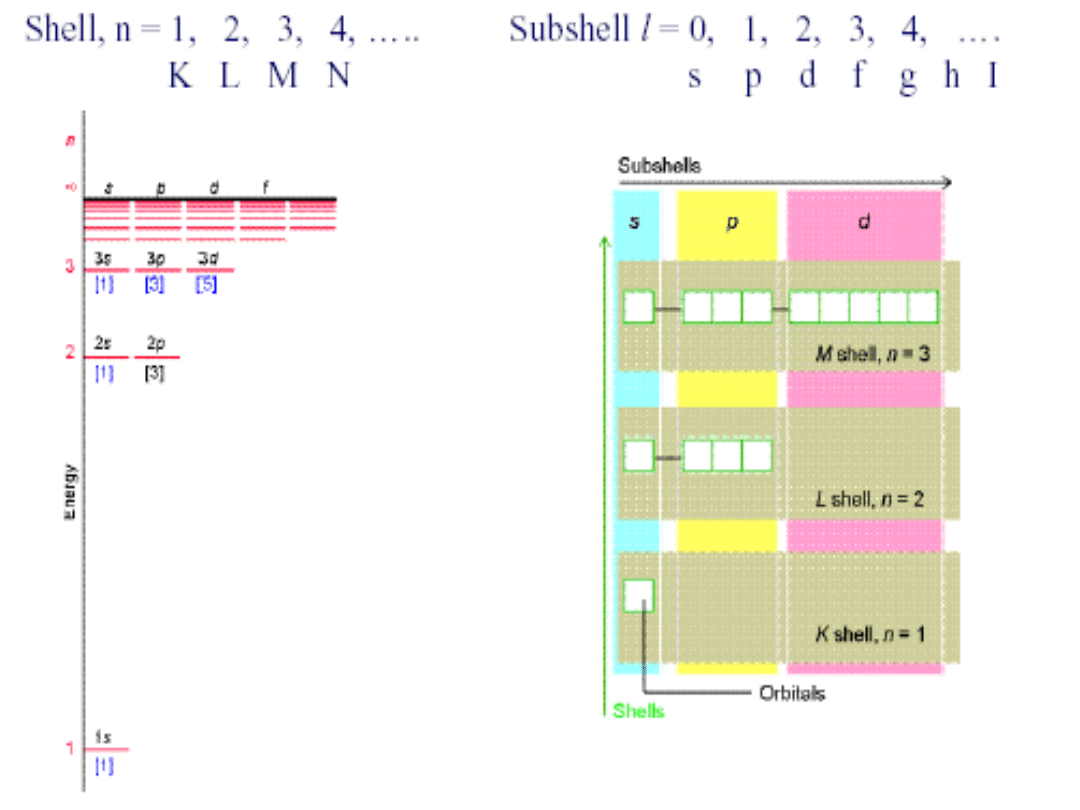
Poziomy energetyczne w atomie wodoru
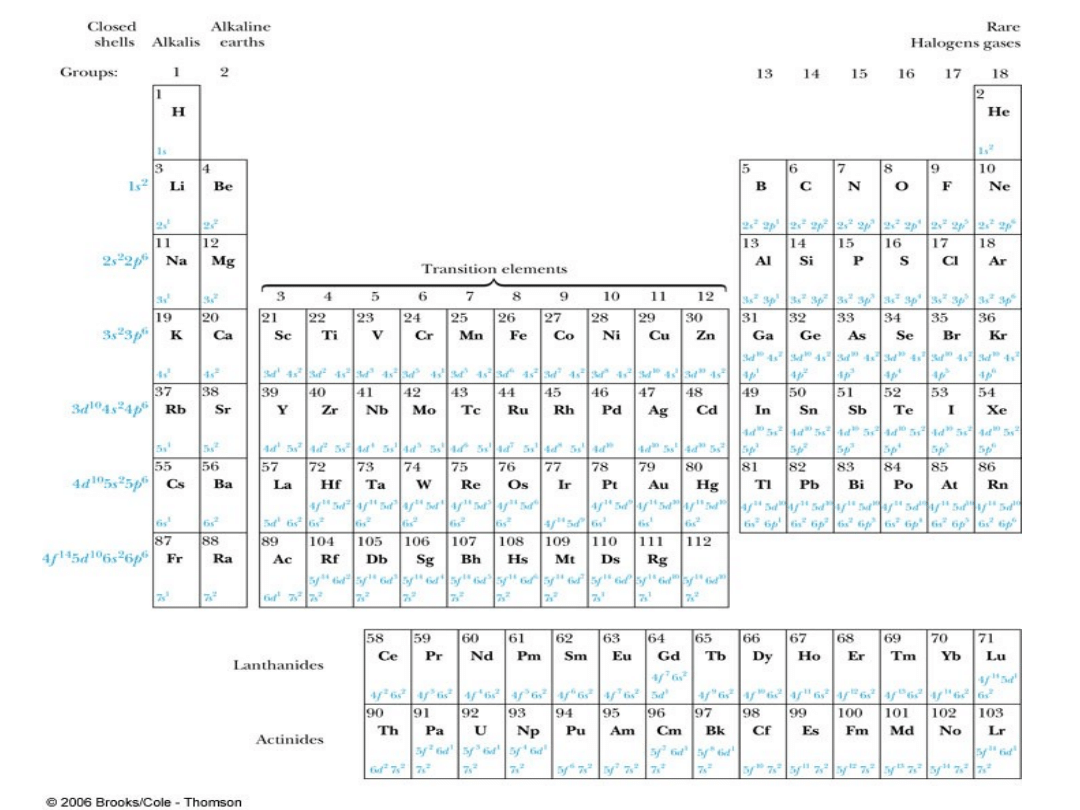
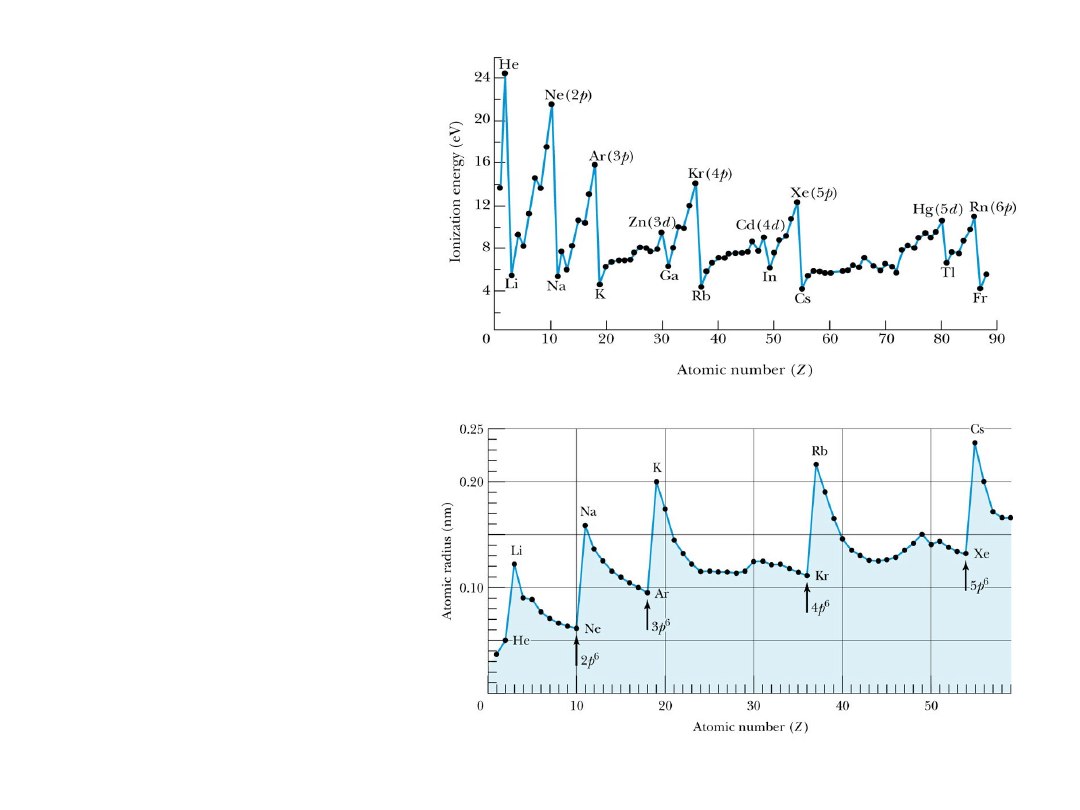
Groups and
Periods
• Groups:
Vertical columns.
Same number of
electrons in an ℓ
orbit.
Can form similar
chemical bonds.
• Periods:
Horizontal rows.
Correspond to filling
of the subshells.

The Periodic
Table
• Inert Gases:
• Last group of the periodic table
• Closed p subshell except helium
• Zero net spin and large ionization energy
• Their atoms interact weakly with each other
• Alkalis:
• Single s electron outside an inner core
• Easily form positive ions with a charge +1e
• Lowest ionization energies
• Electrical conductivity is relatively good
• Alkaline Earths:
• Two s electrons in outer subshell
• Largest atomic radii
• High electrical conductivity

The
Periodic
Table
• Lanthanides (rare earths):
• Have the outside 6s
2
subshell
completed
• As occurs in the 3d subshell, the
electrons in the 4f subshell have
unpaired electrons that align
themselves
• The large orbital angular
momentum contributes to the large
ferromagnetic effects
• Actinides:
• Inner subshells are being filled
while the 7s
2
subshell is complete
• Difficult to obtain chemical data
because they are all radioactive
• Have longer half-lives
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Groups and Periods
- Slide 29
- Slide 30
Wyszukiwarka
Podobne podstrony:
MechKw i04
MechKw i03
MechKw i05
MechKw i11
MechKw i11
MechKw 03
MechKw 10
MechKw pytania
MechKw i07
MechKw i12
MechKw 06
MechKw 07
MechKw i13
MechKw i04
MechKw i01
MechKw i02 2011
MechKw i06
więcej podobnych podstron