
1
Zalecana literatura
1. Johnson, D. S.; Li, J. J. The art of drug synthesis, John Wiley & Sons, Inc.,
Hoboken, New Jersey, 2007.
2. Torrence P. F. Antiviral drug discovery for emerging diseases and bioterrorism
threats, John Wiley & Sons, Inc., Hoboken, New Jersey, 2005.
3. Li, J. J.; Johnson, D. S.; Sliskovic, D. R.; Roth B. D. Contemporary Drug
Synthesis, John Wiley & Sons, Inc., Hoboken, New Jersey, 2004.
4. GAD, S. C. Drug discovery handbook, John Wiley & Sons, Inc., Hoboken, New
Jersey, 2005.
5. Rolski, S. Chemia środków leczniczych, PZWL, Warszawa, 1968.
6. Lednicer, D. Strategies for organic drug synthesis and design, John Wiley &
Sons, Inc., Hoboken, New Jersey, 1998.
7. Vardanyan, R.; Hruby, V. Synthesis of essential drugs, Elsevier B. V. Amsterdam,
2006.
8. Fischer, J.; Ganellin, R. Analogue-based drug discovery, Wiley-VCH Verlag GmbH
& Co. KGaA, Weinheim, 2006.
9. Ogólnodostępne podręczniki do chemii organicznej oraz literatura źródłowa.
WYKŁAD 6

2
Polskie nazwy omawianych
preparatów farmaceutycznych
zaczerpnięto z
rozporządzenia Komisji (WE) Nr 1549/2006 z dnia 17 października 2006 r. oraz
rozporządzenia Rady (WE) nr 129/2007 z dnia 12 lutego 2007 r., załącznik 3:
„Wykaz międzynarodowych niezastrzeżonych nazw preparatów farmaceutycznych
(INN) przewidzianych przez Światową Organizację Zdrowia, które są zwolnione z cła”.
INN
- międzynarodowa niezastrzeżona nazwa preparatu farmaceutycznego
przewidziana przez Światową Organizację Zdrowia.
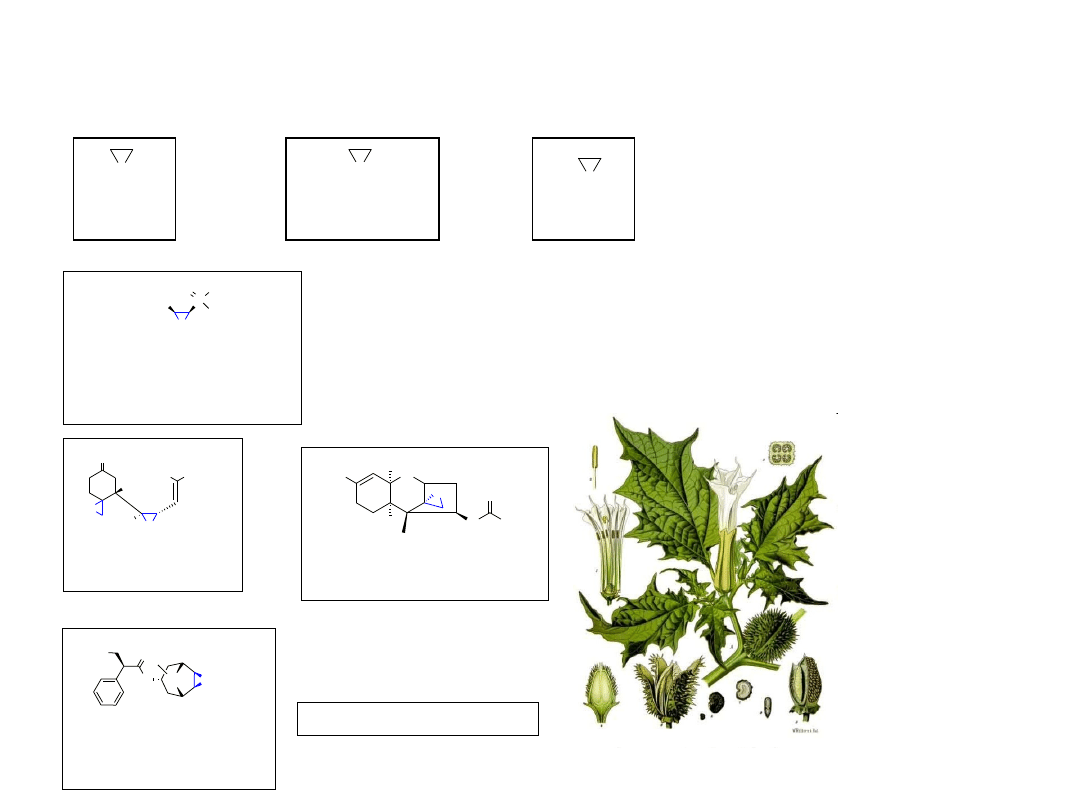
3
OKSIRAN
AZYRYDYNA
TIRAN
Fosfomycyna
(INN, phosphomycin)
INN, ovalicine
1. Układy trójczłonowe – pochodne oksiranu i azyrydyny
O
N
H
S
O
H
3
C
P
O OH
OH
O
CH
3
H
3
C
H
3
C
O
OH
O
INN, trichodermin
Skopolamina
(INN, scopolamine)
O
H
H
3
C
H
3
C
O
CH
3
O
O
H
3
C
N
O
HO
O
O
BIELUŃ DZIĘDZIERZAWA
Wyizolowana w 1969 r. ze Steptomyces fradiae; antybiotyk o
szerokim spektrum działania, aktywna przeciwko bakteriom Gram-
dodatnim i Gram-ujemnym.

4
H
3
C
P(OR)
2
O
H
3
C
MgBr
Cl P(OR)
2
O
+
P(OR)
3
∆
T
C
6
H
6
/THF, t. pok.
Na
2
CO
3,
t. pok., H
2
O/MeOH
CH
2
Cl
Cl
CH
2
P(OR)
2
Cl
O
+
H
H
3
C
H
P(OR)
2
O
(Z)
H
H
3
C
H
P(OH)
2
O
(Z)
H
3
C
P(O)(OH)
2
O
H
2,
MeOH, kat. Lindlara
H
2
O
2,
pH 5.5, Na
2
WO
4,
55 °C
12M HCl
1
2
3
4
5
6
1.1. Fosfomycyna
1.1.A. Metoda 1 – utlenianie alkenu
(+/-)

5
Chem. Ind. (London) 1978, 430.
[O]
H
H
3
C
( Z) H
P(O)(OH)
2
[O]
Fosfomycyna
H
(S)
H
3
C
(R)
H
P(O)(OH)
2
O
H
3
C
(R)
H
(S)
P(O)(OH)
2
H
O
6
6
Fosfomycyna
H
H
3
C
( Z)
H
P(O)(OH)
2
Cl
2
/NaOH
10M NaOH
H
(R)
H
3
C
(S)
H
P(O)(OH)
2
Cl
OH
H
(S)
H
3
C
( R)
H
P(O)(OH)
2
Cl
OH
H
(S)
H
3
C
( R)
H
P(O)(OH)
2
O
+
6
7
8
Tetrahedron Lett. 1969, 4647.
1.1.B. Metoda 2 – cyklizacja kwasu (1R,2S)-1-chloro-2-hydroksypropylofosfonowego (8)
7
1.1.C. Metoda 3 – cyklizacja kwasu
(1S,2S)-2-hydroxy-1-(metylosulfonyloksy)propylofosfonowego (13)
EP 299484, 1989
H
H
3
C
H
P(O)(OH)
2
O
+
OAc
H
H
3
C
O
P(O)(OCH
3
)
2
OAc
H
H
3
C
OH
H P(O)(OH)
2
OAc
H
H
3
C
OH
P(O)(OH)
2
H
n-Bu
4
NBH
4
MsCl/Py
MeOH, reflux
K
2
CO
3
Fosfomycyna
OAc
H
H
3
C
OMs
P(O)(OH)
2
H
OH
H
H
3
C
OMs
P(O)(OH)
2
H
9
10
11
12
13
8
Oseltamiwir
(INN, oseltamivir, TAMIFLU)
Leki przeciwgrypowe
Zanamiwir
(INN, zanamivir, RELENZA)
Amantadyna
(INN, amantadine)
Rymantadyna
(INN, rimantadine)
NH
2
O
AcHN
CO
2
Et
*H
3
PO
2
O
AcHN
H
HO
HO
OH
HN
CO
2
H
NH
NH
2
NH
2
NH
2
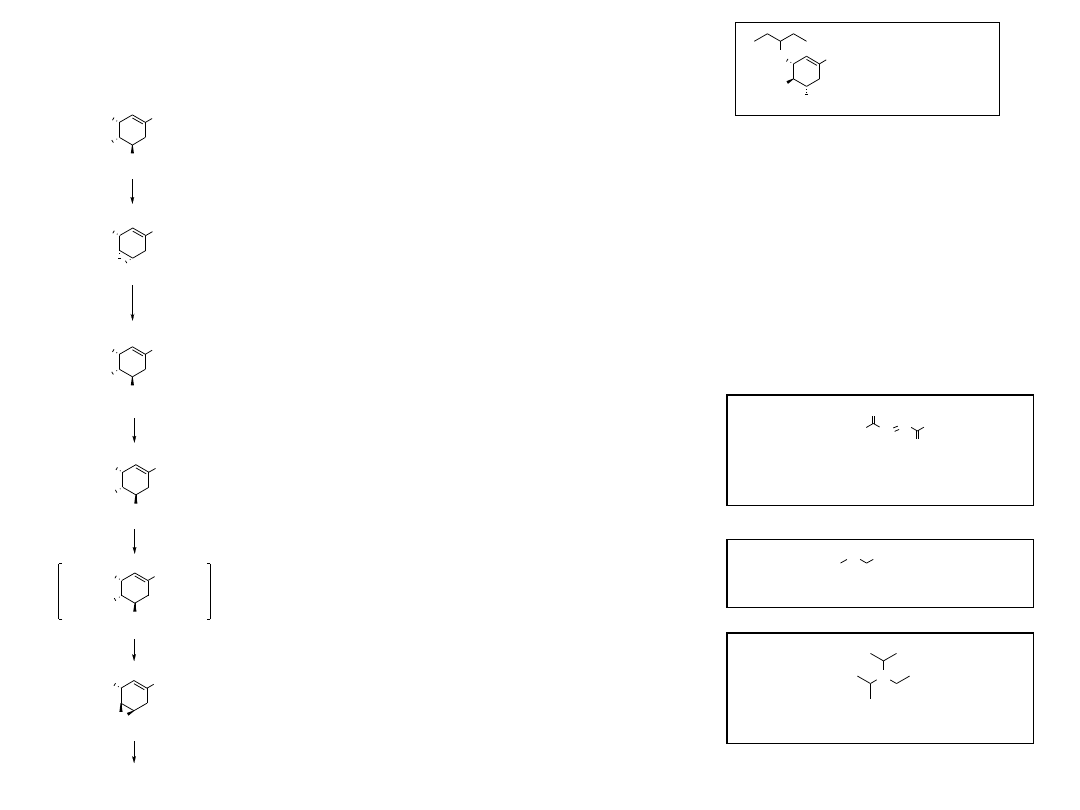
9
GS-4071
1.2. GS-4071, prekursor oseltamiwiru
NH
2
O
AcHN
CO
2
H
N
N
O
OEt
O
EtO
DEAD = azodikarboksylan dietylu
O Cl
MOMCl = chlorek metoksymetylu
N
DIPEA = diizopropyloetyloamina
OH
HO
HO
CO
2
Me
DEAD/Ph
3
P
HO
CO
2
Me
O
(1) MOMCl/DIPEA
(2) NaN
3
/NH
4
Cl, MeOH/H
2
O
N
3
MOMO
HO
CO
2
Me
1
2
3
MsCl/NEt
3
N
3
MOMO
MsO
CO
2
Me
MOMO
CO
2
Me
HN
NH
2
MOMO
MsO
CO
2
Me
4
5
6
NEt
3
/H
2
O
Ph
3
P
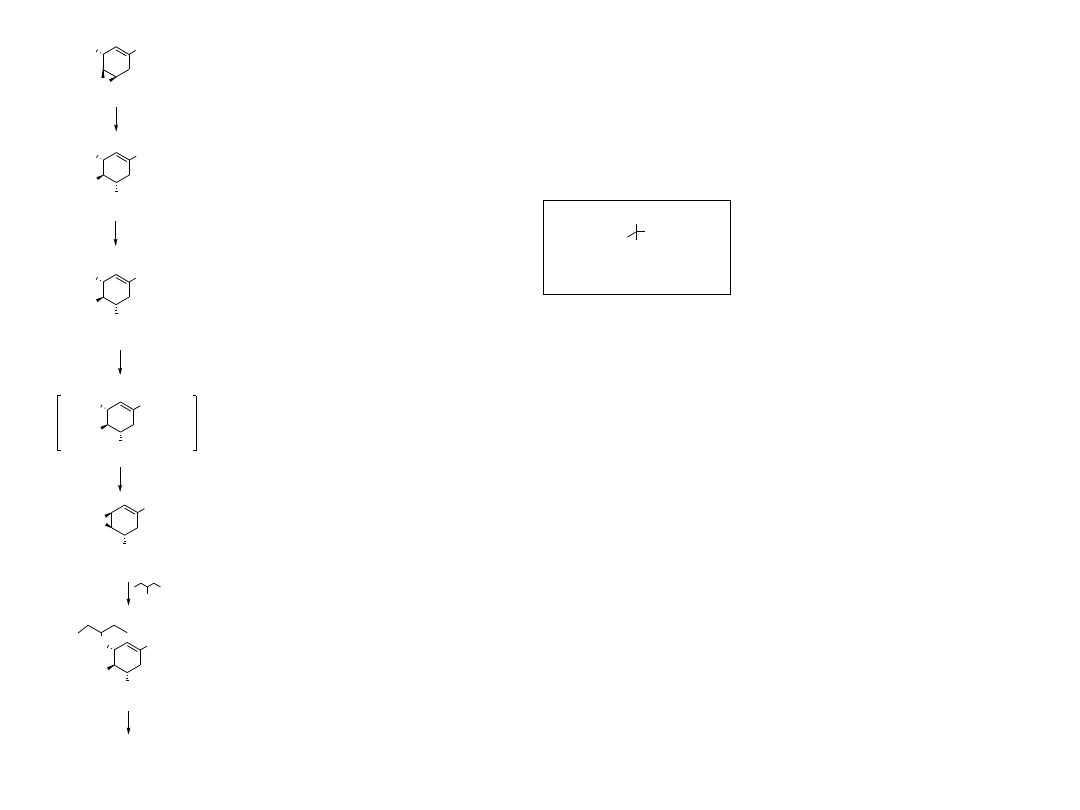
10
MOMO
CO
2
Me
HN
(1) NaN
3
/NH
4
Cl; (2) HCl aq
N
3
HO
H
2
N
CO
2
Me
N
3
HO
TrHN
CO
2
Me
TrCl/NEt
3
6
7
8
N
3
CO
2
Me
TrN
N
3
MsO
TrHN
CO
2
Me
MsCl/NEt
3
OH
, BF
3
*Et
2
O
N
3
O
H
2
N
CO
2
Me
9
10
11
Ph
Ph
Ph
Cl
TrCl = chlorek tritylu
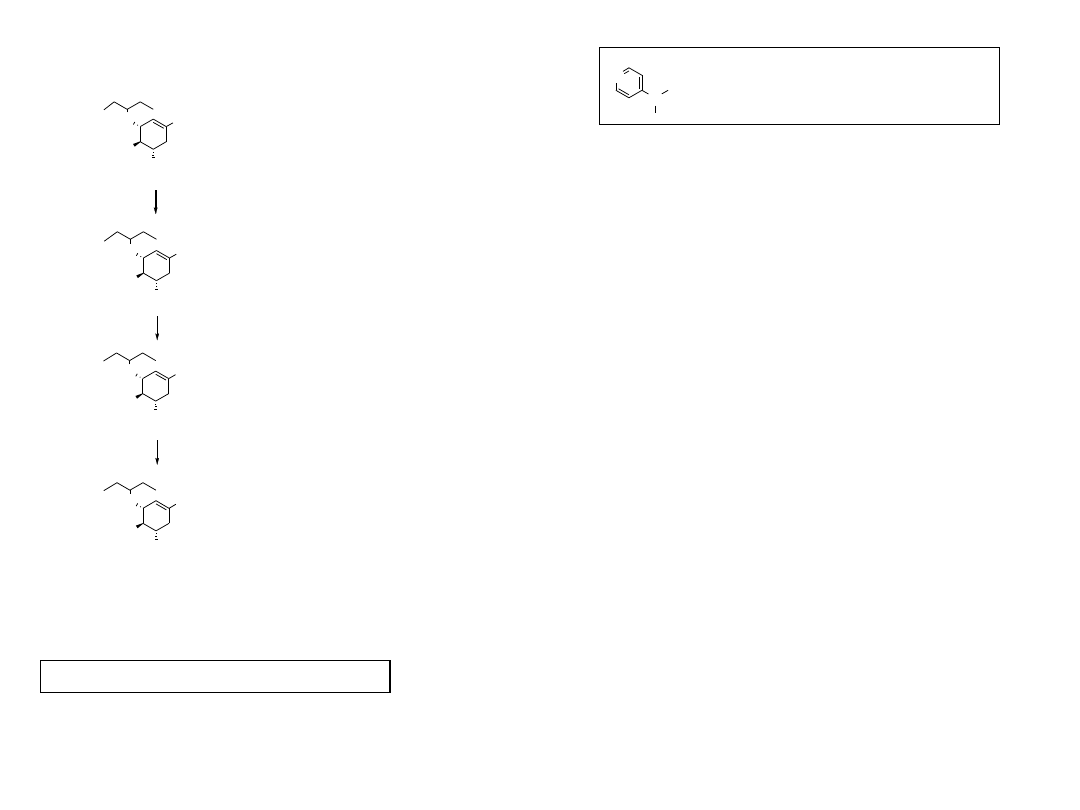
11
J. Med. Chem. 1998, 41, 2451
11
NH
2
O
AcHN
CO
2
H
Ac
2
O, DMAP/Py
N
3
O
AcHN
CO
2
Me
(1) Ph
3
P; (2) NEt
3
/H
2
O
NH
2
O
AcHN
CO
2
Me
KOH aq
GS-4071
12
13
N
3
O
H
2
N
CO
2
Me
N
N
DMAP = 4-dimethylaminopirydyna

12
1.2.A1. Reakcja Mitsunobu
1.2.A. Wyjaśnienie przebiegu wybranych etapów
Nu
R
1
-Nu
N
3
R
1
-N
3
azydki
NR
2
R
1
-NR
2
aminy, azyrydyny
OR lub OAr
R
1
-OR
etery, oksirany
RC(O)O
R
1
-O(O)CR
estry
RNHC(O)R
2
R1RNC(O)R
2
amidy
ArSH
R
1
-S-Ar
tioetery
http://www.organic-chemistry.org/namedreactions
Ph
3
P + RO(O)C-N=N-C(O)OR +
R
1
OH
+
H
-
Nu
R
1
-
Nu
+
O
=PPh
3
+ RO(O)C-N
H
-N
H
-C(O)OR
DEAD (R= Et)
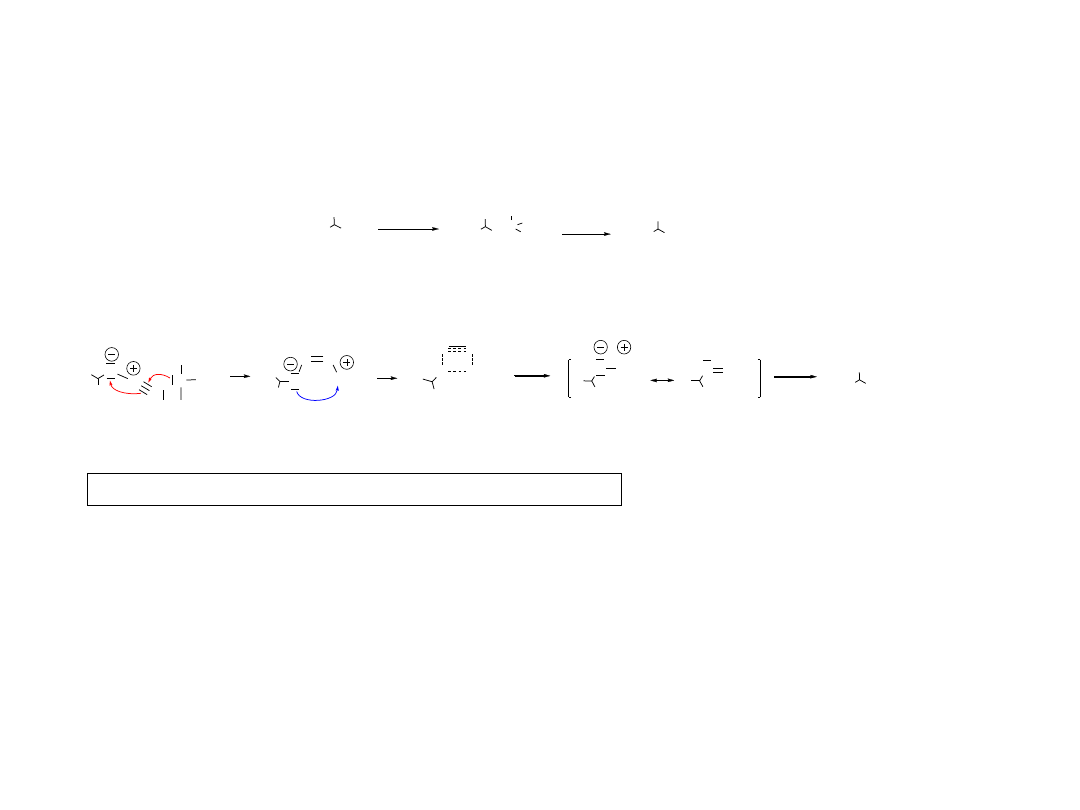
13
N
R
R
1
N
N
P
Ph
Ph
Ph
N
N
PPh
3
N
R
R
1
N
N
PPh
3
N
R
R
1
+
PPh
3
N
R
R
1
PPh
3
N
R
R
1
H
2
O
NH
2
R
R
1
+ O=PPh
3
- N
2
1.2.A2. Reakcja Staudingera
http://www.organic-chemistry.org/namedreactions
N
3
R
R
1
Ph
3
P
- N
2
N
R
R
1
P
Ph
Ph
Ph
H
2
O
NH
2
R
R
1
14
OKSETAN
AZETYDYNA
TIENAN
2. Układy czteroczłonowe - azetydyna
O
NH
S
Leki obniżające ciśnienie krwi
Nifedypina (INN, nifedipine) R
1
= H, R
2
= NO
2
, R
3
= Me
Felodypina (INN, felodipine) R
1
= R
2
= Cl, R
3
= Et
N
H
Me
MeO
2
C
CO
2
R
3
Me
R
2
R
1
Amlodypina
(INN, amlodipine, AMLOZEK)
Azelnidypina
(INN, azelnidipine)
N
H
Me
O
Me
O
NH
2
Me
O
O
N
NO
2
N
H
Me
MeO
2
C
CO
2
Et
Cl
O
NH
3
+
SO
3
-
15
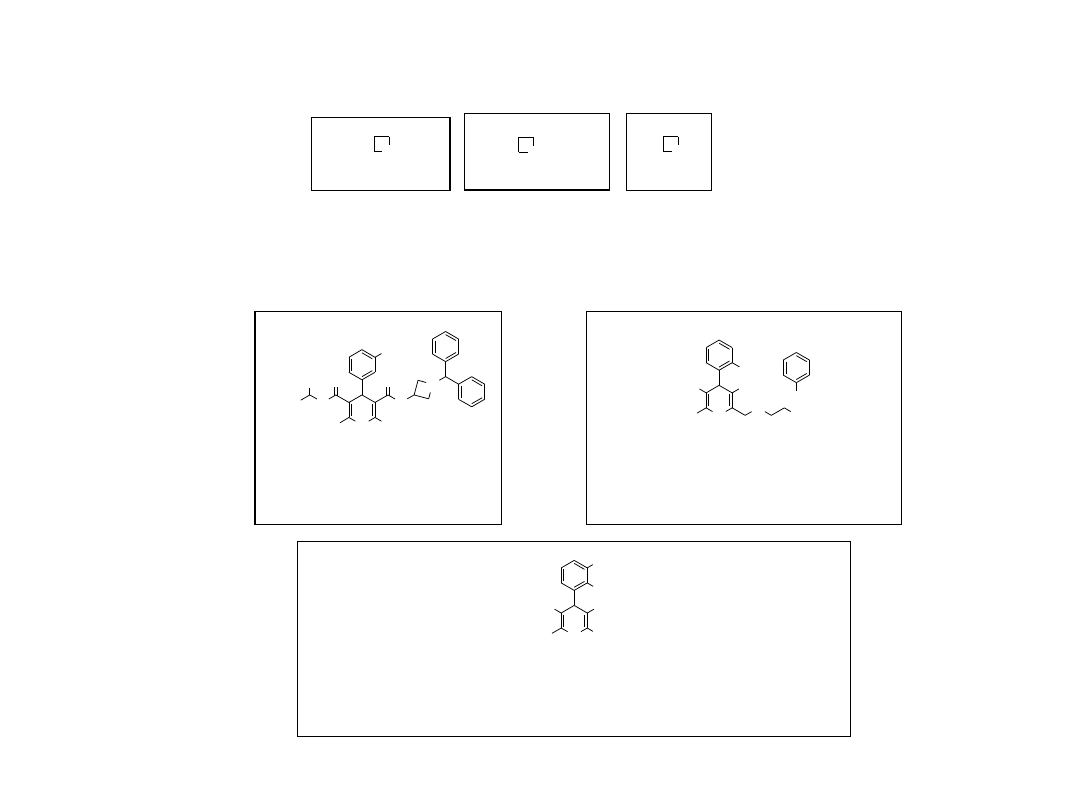
2.1. Azelnidypina
Wyjaśnienie przebiegu w dalszej części wykładu
OH
O
NC
H
2
N
Ph
Ph
O
Cl
∆
T
HO
N
Ph
Ph
O
N
Ph
Ph
NC
O
, DCC,
∆
T
1
2
3
+
O
N
Ph
Ph
O
EtO
NH
EtOH, HCl (g)
4
*HCl
(1) NH
3
(g); (2) NH
4
OAc
*HOAc
5
O
Me
Pr
i
O
2
C
NO
2
O
N
Ph
Ph
O
N
H
Me
Pr
i
O
2
C
NH
2
O
O
N CHPh
2
NO
2
H
2
N NH
6
, NaOMe
N C N
DCC = 1,3-dicykloheksylokarbodiimid
U.S. Patent 4,772,596.
16
2.1.A. Wyjaśnienie przebiegu wybranych etapów
2.1.A1. Synteza 3-hydroksyazetydyny (2)
NH
2
Ph
Ph
O
Cl
OH
N
Ph
Ph
1
2
Ph
N
H
Cl
O
Ph
O
NH
Ph
Ph
- HCl
17
2.1.A2. Synteza Pinnera – otrzymywanie soli iminoestrów
S. Patai, Ed. (John Wiley & Sons, NY, 1975), pp. 385-489
Amidyna
Iminoester, sól
Iminoester
R C N
H Cl
H
O Et
R C N H Cl
R C NH
2
OEt
Cl
Na
2
CO
3
R CH
2
NH
2
NaBH
4
R C NH
OEt
R CO
2
H
H
2
O/H
+
NH
3
R C NH
NH
2
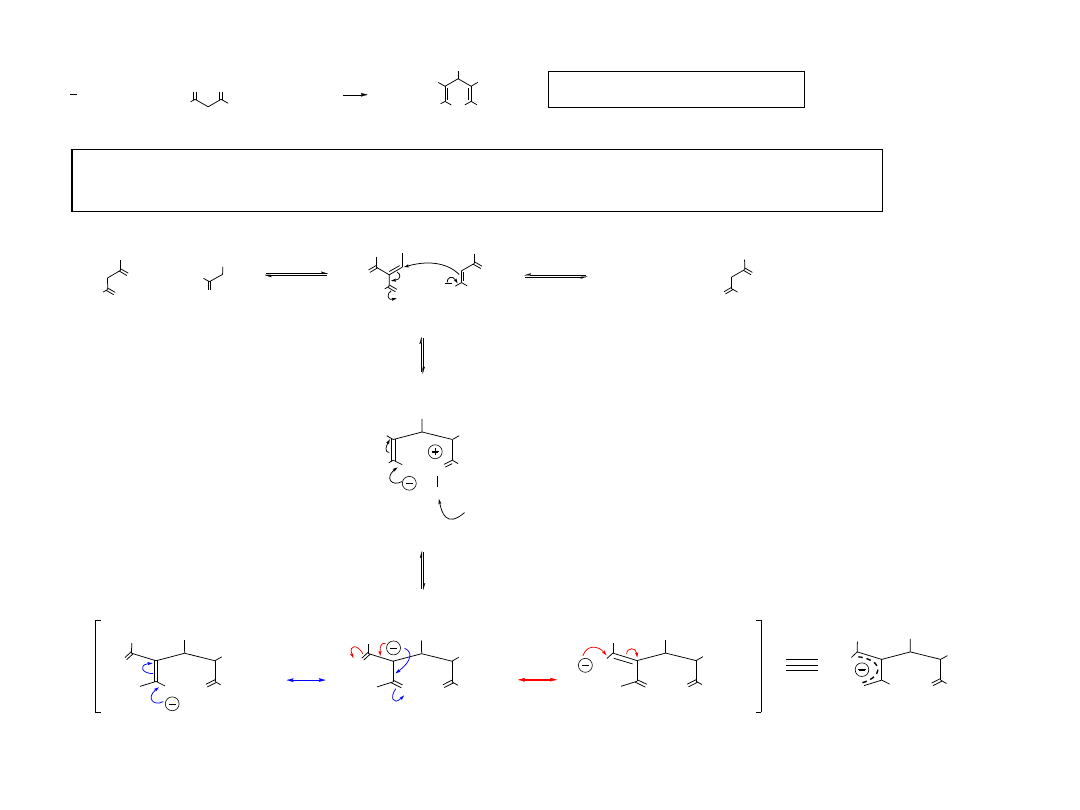
18
+
- H
2
O
+
R
1
R
O
R
2
O
O
H
2
N
OR
2
R
1
O
R
2
O
2
C
R
1
R
1
CO
2
R
2
O HN
H
1
2
3
NH
3
NH
4
+
O
OR
2
R
1
O
NH
3
R
1
R
2
O
O
O
R
- H
2
O
4A
4B
4C
R
1
R
1
CO
2
R
2
O HN
R
2
O
O
R
1
R
1
CO
2
R
2
O HN
R
2
O
O
R
1
R
1
CO
2
R
2
O HN
R
2
O
O
R
R
R
R
O
R
1
CO
2
R
2
R
1
HN
R
2
O
O
R
4
O
H
2.1.A3. Hantzscha metoda syntezy dihydropirydyn
Addycja nukleofilowa do gr. karbonylowej:
(a)
β
-ketooester - aldehyd
(b) amoniak -
β
-ketoester
R CHO +
R
1
OR
2
O O
+ NH
3
N
H
R
CO
2
R
2
R
2
O
2
C
R
1
R
1
2
Schemat ogólny reakcji
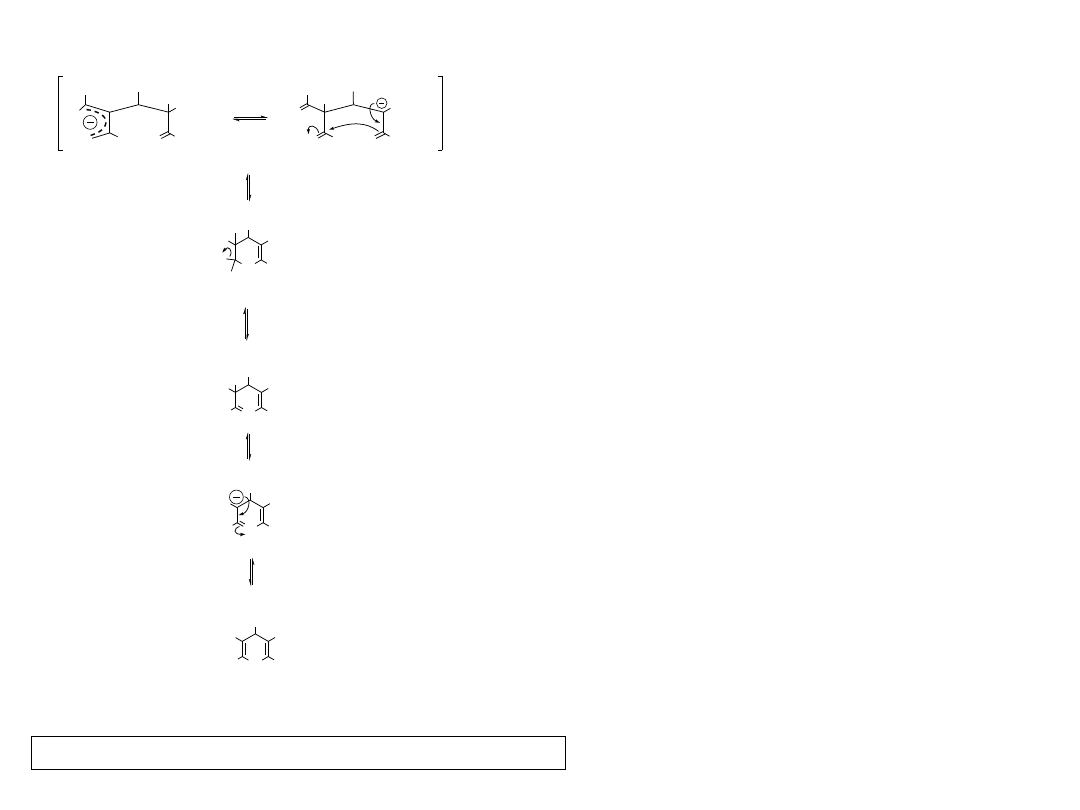
19
NH
4
+
N
H
R
1
CO
2
R
2
R
2
O
2
C
R
1
H
O
R
6
NH
3
- H
2
O
H
O
R
1
CO
2
R
2
R
1
HN
R
2
O
O
R
4
O
R
1
CO
2
R
2
R
1
HN
R
2
O
O
R
H
H
N R
1
CO
2
R
2
R
2
O
2
C
R
1
R
7
H
N R
1
CO
2
R
2
R
2
O
2
C
R
1
R
N
H
R
1
CO
2
R
2
R
2
O
2
C
R
1
R
8
9
NH
4
+
NH
3
NH
4
+
NH
3
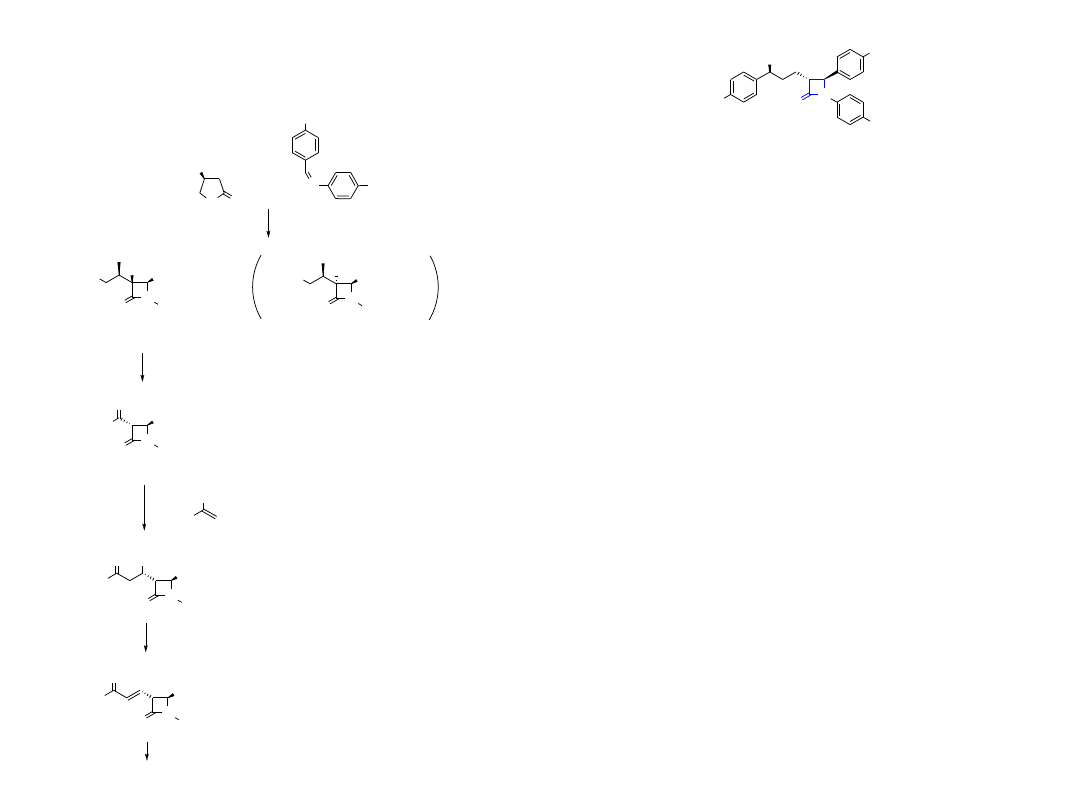
20
2.2. Ezetimib (INN, ezetimibe)
Lek obniżający poziom „złego” cholesterolu (LDL) we krwi.
N
F
O
OH
F
OH
O O
HO
N
OBn
F
N
Ph-F-4
Ph-OBn-4
O
HO
OH
H
LDA, HMPA
+
1
3a
2
N
Ph-F-4
Ph-OBn-4
O
HO
OH
H
+
3b
NaIO
4
N
Ph-F-4
Ph-OBn-4
H
O
O
4-F-Ph
OSiMe
3
5
N
Ph-F-4
Ph-OBn-4
O
OH
O
4-F-Ph
6
N
Ph-F-4
Ph-OBn-4
O
O
4-F-Ph
PTSA
7
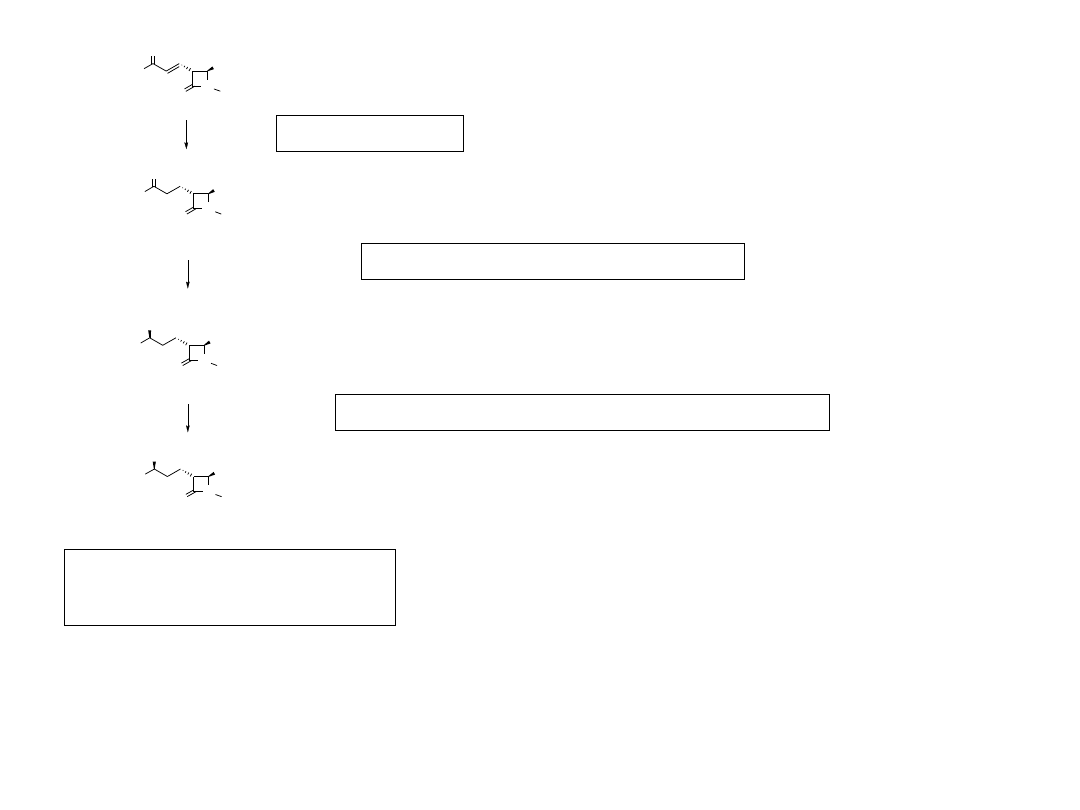
21
Redukcja alkenu
Stereoselektywna redukcja ketonu
Reduktywne rozszczenienie eteru benzylowego
J. Org. Chem. 1999, 64, 3714;
World (PTC) Patent WO9508532-A1;
U.S. Patent 5,631,365.
N Ph-F-4
Ph-OBn-4
O
O
4-F-Ph
7
N Ph-F-4
Ph-OBn-4
O
O
4-F-Ph
8
H
2
; Pd/C
BH
3
*Et
2
O, chiralny kat.
N Ph-F-4
Ph-OBn-4
O
OH
4-F-Ph
HCO
2
NH
4
; Pd/C
N Ph-F-4
Ph-OH-4
O
OH
4-F-Ph
9
22
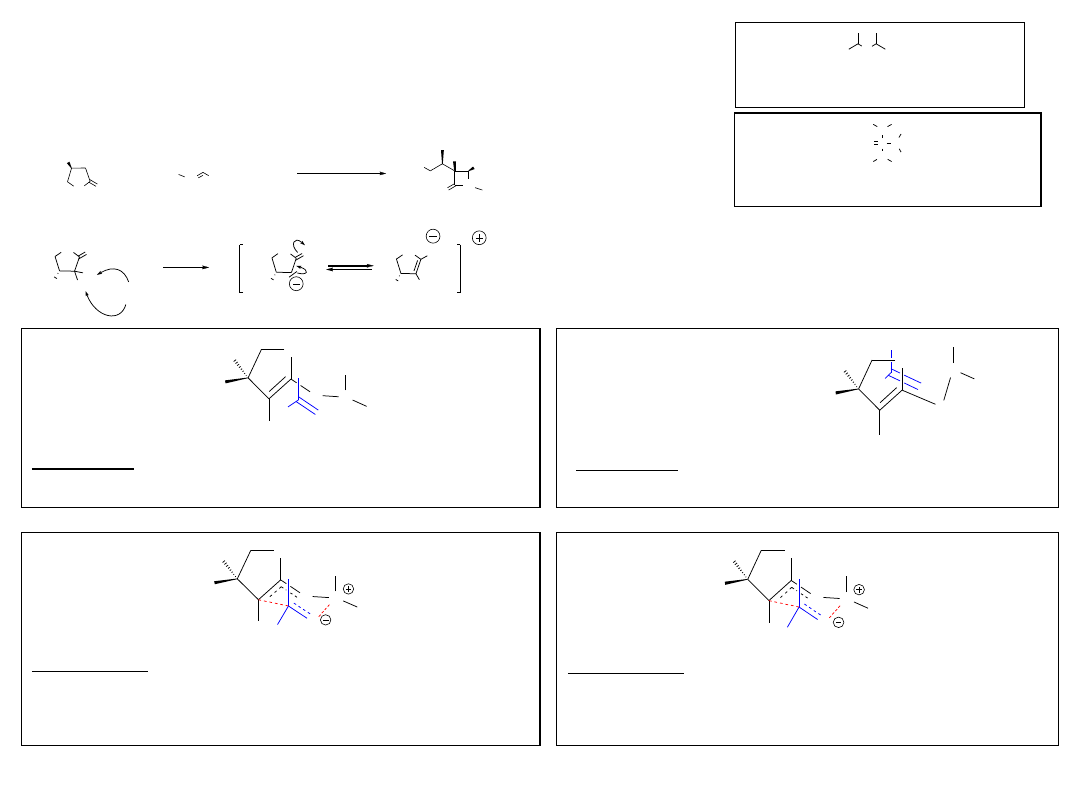
2.2.A. Wyjaśnienie przebiegu wybranych etapów
2.2.A1. Alkilowanie iminy (2)
O O
HO
4-F-Ph N Ph-OBn-4
LDA, HMPA
+
1
2
1
2
3
4
N Ph-F-4
Ph-OBn-4
O
HO
OH
H
3a (tr ans)
1
2
3
4
HMPA = heksametylfosforoamid
Li
N
LDA = diizopropyloamidek litu
P
O
N
N
N
O O
HO
1
LDA
O O
HO
H
H
O O
HO
H
Li
Wariant 1:
Wariant 2:
NR
M
O
O
L
R
H
H
HO
R
L
Zawada steryczna
Wariant 1B:
Wariant 1A:
NR
M
O
O
L
R
H
H
HO
R
L
N
R
M
O
O
L
R
H
H
HO
H
L
N
R
M
O
O
L
H
H
H
HO
R
L
23
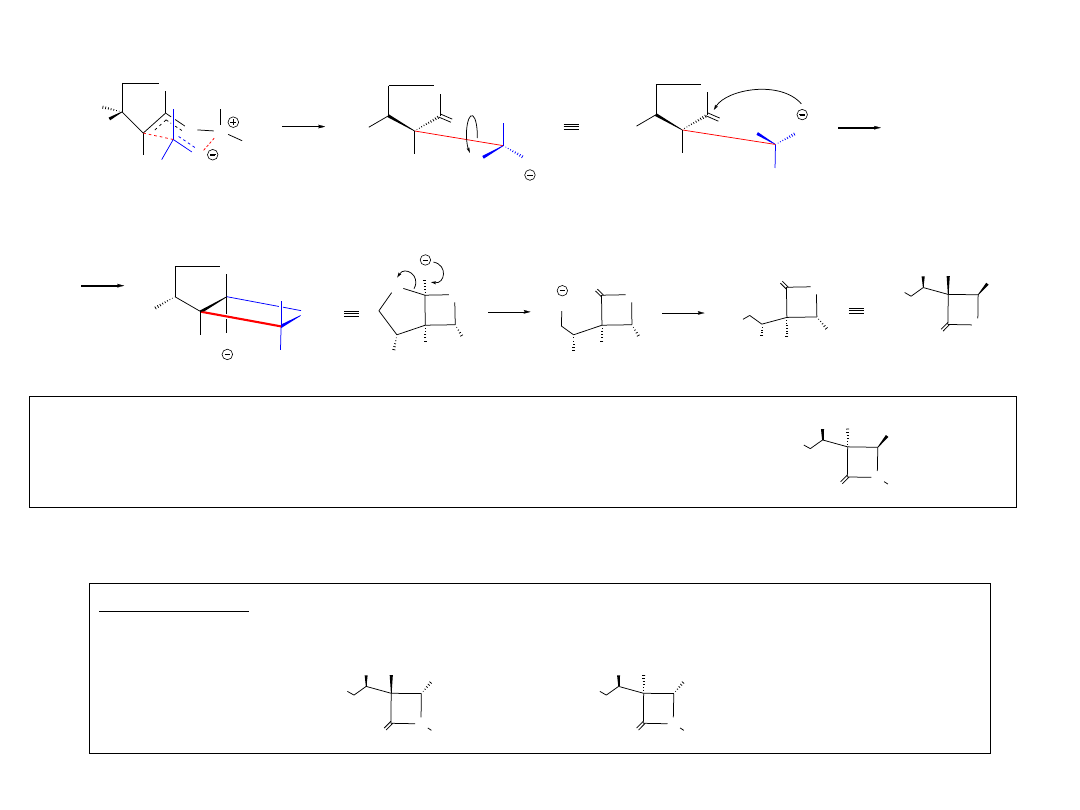
Wariant 1B
R
H
NR
H
O
O
HO
R
H
NR
H
O
O
HO
R
NR
H
O
HO
O
H
O
NR
R
H
O
HO
O
NR
R
H
OH
O
O
NR
R
H
OH
HO
O
NR
R
H
OH
HO
N
R
M
O
O
L
H
H
H
HO
R
L
3a (trans)
3a (trans)
Podobne rozumowanie w odniesieniu do „Wariantu 2” doprowadzi do
izomeru 3b (cis)
O
N
Ph-OBn-4
H
OH
HO
Ph-F-4
Praca domowa
Wykazać, jakie orientacje początkowe substratów 1 i 2 doprowadziły by do związków
i
O
N
Ph-OBn-4
H
OH
HO
3b (cis)
Ph-F-4
O
N
Ph-OBn-4
H
OH
HO
Ph-F-4
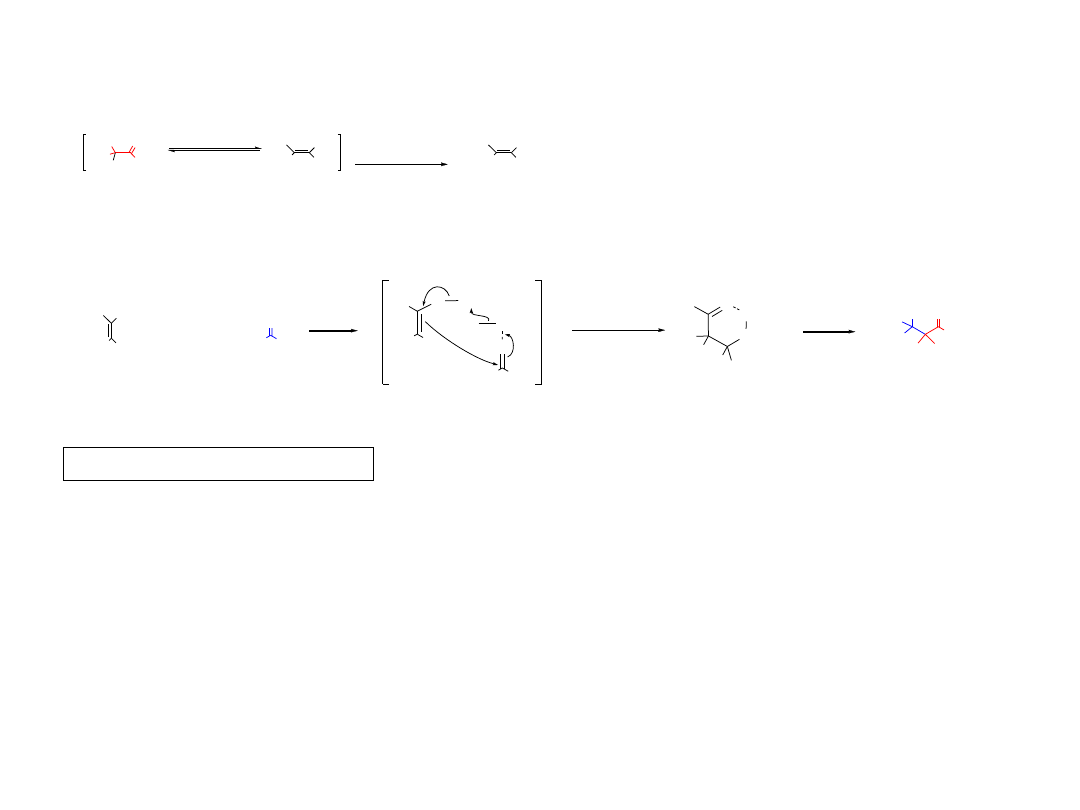
24
2.2.B2. Reakcja aldolowa Mukaiyamy
J. Am. Chem. Soc. 1974, 96, 7503.
OSi(CH
3
)
3
R
1
R
2
R
3
R
4
R
5
O
TiCl
4
O
R
1
R
2
R
3
Si(CH
3
)
3
R
4
R
5
O
Cl
TiCl
3
+
- (CH
3
)
3
SiCl
O
O
TiCl
4
R
5
R
4
R
1
R
2
R
3
H
2
O
aldol
R
4
R
3
O
R
2
R
1
OH
R
5
O
R
1
R
2
R
3
H
OH
R
1
R
2
R
3
(CH
3
)
3
SiCl
OSi(CH
3
)
3
R
1
R
2
R
3
keton
enol
eter sililowy enolu
tautomeria
Document Outline
- Slajd 1
- Slajd 2
- Slajd 3
- Slajd 4
- Slajd 5
- Slajd 6
- Slajd 7
- Slajd 8
- Slajd 9
- Slajd 10
- Slajd 11
- Slajd 12
- Slajd 13
- Slajd 14
- Slajd 15
- Slajd 16
- Slajd 17
- Slajd 18
- Slajd 19
- Slajd 20
- Slajd 21
- Slajd 22
- Slajd 23
- Slajd 24
Wyszukiwarka
Podobne podstrony:
dyd tech507
dyd tech508
dyd tech507
DYD 9 PRAWO KARNE Folie
DYD 7 PRAWO FINANSOWE
dyd bio306
dyd tech14
dyd inz n15
dyd inz e05 id 144824 Nieznany
dyd k2c r id 144871 Nieznany
Klasyfikacje- mat dyd 2008-9, dysleksja
MATERIAL DYD Z PSYCHOLOGII do bl[1]. ogolnozaw, Prace dyplomowe, pedagogika i psychologia
B. Myrdzik - Hermeneutyczna interpretacja tekstu poetyckiego w szkole. Próba aplikacji, Filologia po
Syt dyd wych, Filologia polska, Teoria kształcenia i wychowania
dyd tech405a, chemia, 0, httpzcho.ch.pw.edu.pldydaktyk.html, Technologia Chemiczna, Chemia Organiczn
dyd tech412, chemia, 0, httpzcho.ch.pw.edu.pldydaktyk.html, Technologia Chemiczna, Chemia Organiczna
plan pr dyd wych swietlicy szkolnej 6
Int nizsza niz przec- mat.dyd-2008-9, dysleksja
zsumowanie pytan dyd bio
więcej podobnych podstron