
1
O
O
H
5
C
2
CO
2
H
SOCl
2
O
O
H
5
C
2
C(O)Cl
O
O
H
5
C
2
(1) CH
2
N
2
(2) C
2
H
5
OH
1
2
3
O
OC
2
H
5
4
(1) H
+
; (2) SOCl
2
(1) CH
2
N
2
; (2) HCl
O
O
H
5
C
2
O
Cl
N-K
O
O
(1)
; (2) H
+
5
O
O
H
5
C
2
O
Cl
6
O
O
H
5
C
2
O
NH
2
N
N
H
O
C
2
H
5
O
SH
[O]
CH
3
I
N
N
R
O
C
2
H
5
O
7
KNCS/H
+
8, R = H
Pilokarpina
, R = CH
3
1.1. Pochodne imidazolu - pilokarpina (INN, pilocarpine)
Alkaloid stosowany w
okulistyce do leczenia jaskry
(obniża ciśnienie śródgałkowe)
oraz jako odtrutka przy
zatruciach atropiną.
WYKŁAD 8
1. Układy pięcioczłonowe z dwoma heteroatomami
Ber. 1933, 66, 1187.
Ber. 1933, 66, 1536.
Ber. 1935, 68, 850.
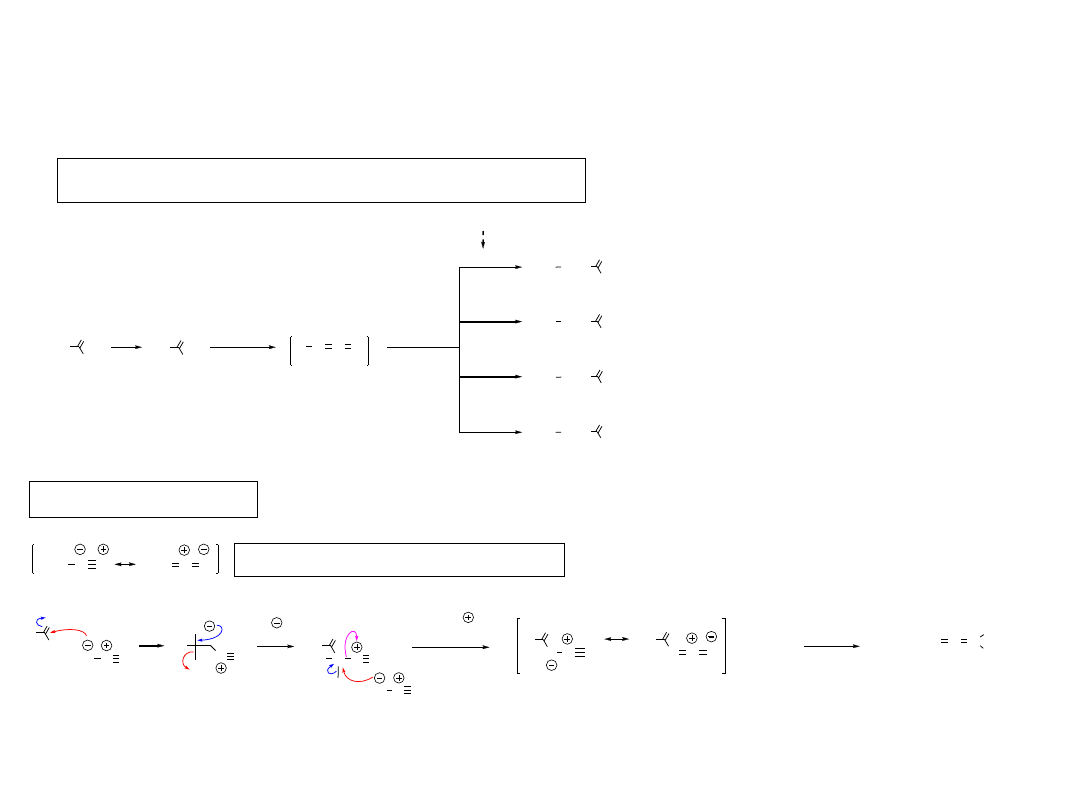
2
1.1.1. Wyjaśnienie przebiegu wybranych etapów
1.1.1.A. Synteza Arndta-Eisterta (1935, Wrocław)
Wydłużanie kwasów karboksylowych o CH
2
.
H
2
O
R
OH
O
R
Cl
O (1)
CH
2
N
2
NH
3
R
C
H
C O
CH
2
OH
O
R
CH
2
OR'
O
R
CH
2
NH
2
O
R
CH
2
NHR'
O
R
R'OH
R'NH
2
keten
(2) Ag
2
O
nukleofil
Diazometan, struktury rezonansowe
H
3
C N N
H
2
C N N
Powstawanie ketenu
R
Cl
O
H
2
C N N
R
Cl
O
N N
- Cl
R
C
O
N N
H
H H
2
C N N
- CH
3
-N
2
- N
2
Ag
2
O
O C C
H
R
keten
diazoketon
R
HC
O
N N
R
C
O
N N
- N
2
3
O
O
C
2
H
5
C
6
7
K-
NCS
/H
+
N
N
H
O
C
2
H
5
O
SH
O
NH
2
1.1.1.B. Reakcja Marckwalda
R
3
C
C
H
O
N
R
2
R
1
N
C
S
+
R
4
H
R
3
C
C
O
N
R
2
R
1
C
N
S
R
4
H
N
N
R
4
R
3
S
R
1
R
2
OH
H
H
N
N
R
4
R
3
S
R
1
R
2
- H
2
O
Reakcja ze slajdu 1
Tetrahedron Lett. 2005, 46, 7315.
N
N
R
3
SH
R
2
R
1
N
N
R
4
R
3
S
R
1
R
2
N
N
R
3
R
2
R
1
N
N
R
4
R
3
R
2
N
N
R
4
R
3
SH
R
2
tautomeria
[O] np. H
2
O
2
/HOAc
lub
[H] np. Ni-Ra
tautomeria
R
1
= H
R
4
= H
[O] np. H
2
O
2
/HOAc
lub
[H] np. Ni-Ra
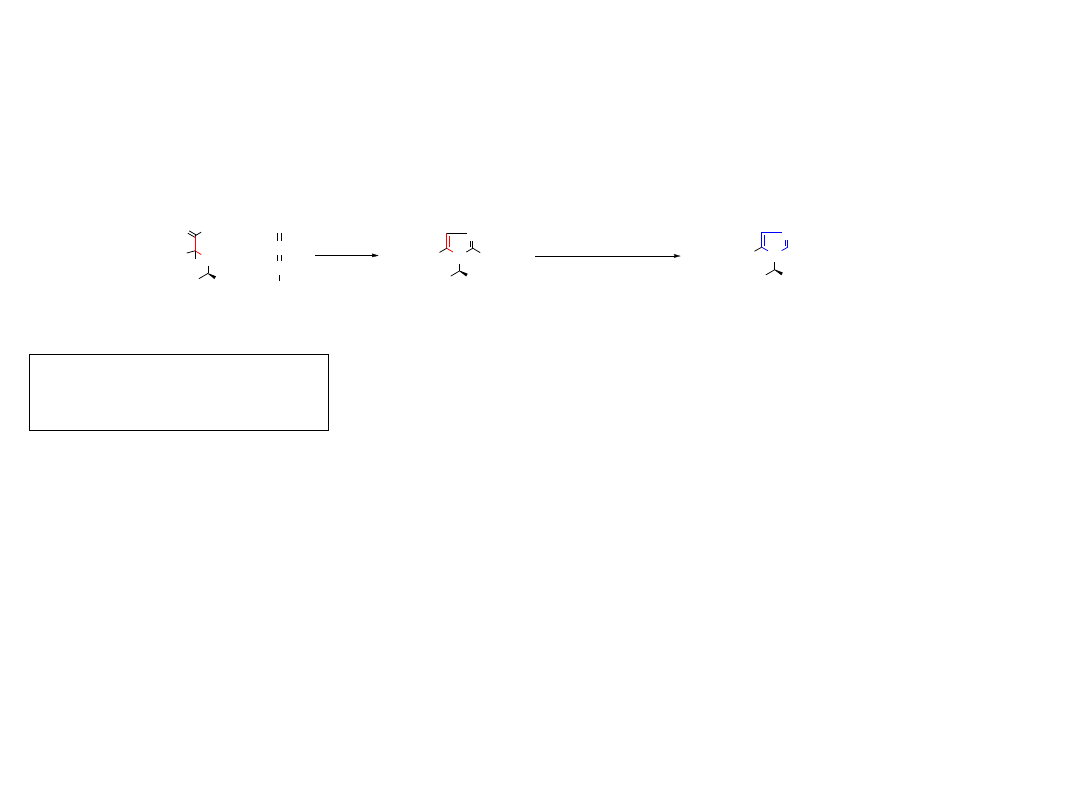
4
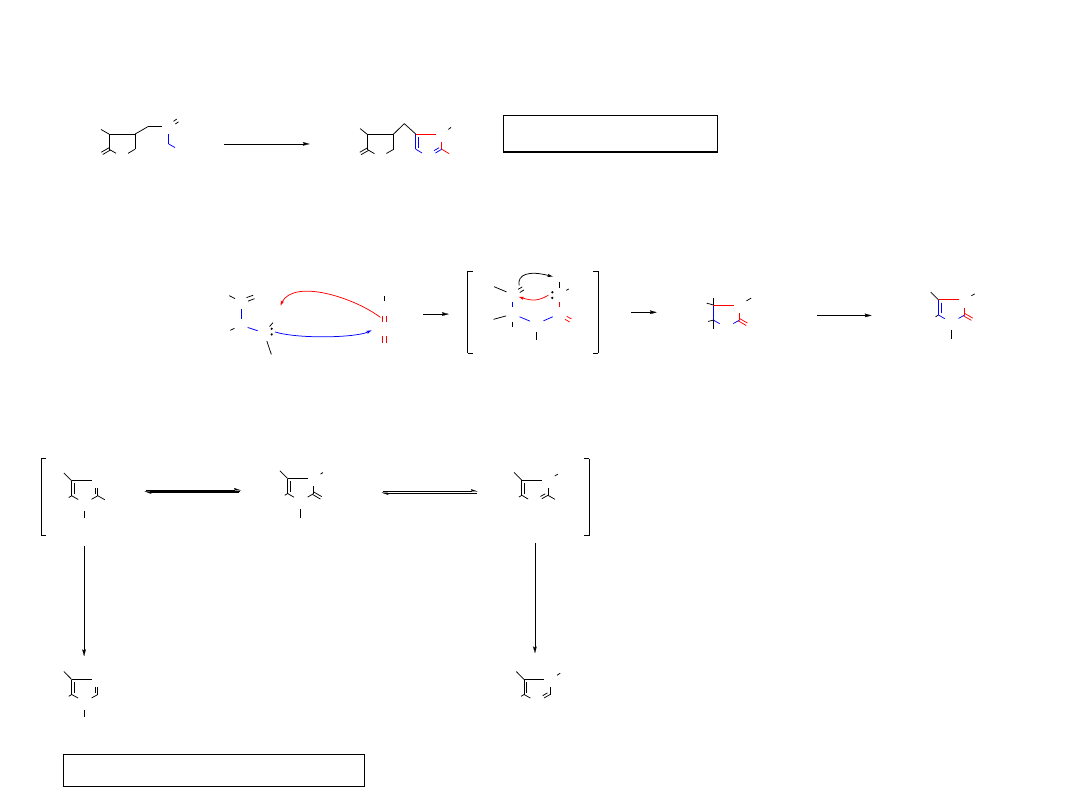
Wykorzystanie reakcji Marckwalda do syntezy etomidatu (INN, etomidate)
Lek do narkozy niewziewnej, czas działania 2.5-20 min., zależny od podanej dawki.
US Pat. 3.354.173 (1967)
Arzmein. Forsch. 1971, 21, 1234.
Pharm. Chem. J. 1978, 12, 195.
N
N
SH
EtO
2
C
Ph
CH
3
N
N
EtO
2
C
Ph
CH
3
N
H
EtO
2
C
Ph
CH
3
O
H
H
K
S
C
N
+
HCl
- H
2
O
(1) NaNO
2
/HNO
3
(2) HCl
1
2
Etomidat
5
1.2. Pochodne imidazoliny
Nafazolina
(INN, naphazoline)
(RINAZIR)
Oksymetazolina
(INN, oxymetazoline)
(AFRIN)
Tetrahydrozolina
(INN, tetrahydrozoline)
(VISINE)
Ksylometazolina
(INN, xylometazoline)
(OTRIVIN)
HN
N
HN
N
(CH
3
)
2
CH
HO
CH
3
CH
3
HN
N
HN
N
(CH
3
)
2
CH
CH
3
CH
3
6
C
2
H
5
OH
R
NH
OEt
NH
2
H
2
N
C
R
HN
N
R
HN
NH
R
NH
2
- EtOH
- NH
3
N
σ + σ −
NH
2
H
2
N
imonoester
7
H
3
C CH
3
O
EtO
O
OEt
O
H
3
C
CO
2
Et
O O
+
zasada
1
2
3
NH
2
OH
H
3
C
CO
2
Et
O NOH
O
N
CO
2
Et
H
3
C
4
5
H
3
C
O
CH
3
O
[HNO
2
]
H
3
C
O
CH
3
O
NOH
O
N
CO
2
H
H
3
C
8
7
6
EtOH/H
+
O
N
H
3
C
NH
2
NH
2
Ph-NH
2
-NH
2
Ph-CHO
LiAlH
4
O
N
H
3
C
N
H
O
H
N
Ph
O
N
H
3
C
N
O
N
Ph
9
10
Izokarboksazyd
N
H
O
NH
2
1.3. Pochodne izoksazolu- izokarboksazyd (INN, isocarboxazid)
Lek przeciwdepresyjny, stosowany w depresji opornej na leczenie.
J. Med. Chem. 1960, 2, 133.
U.S. Pat. 2.997.422 (1961).
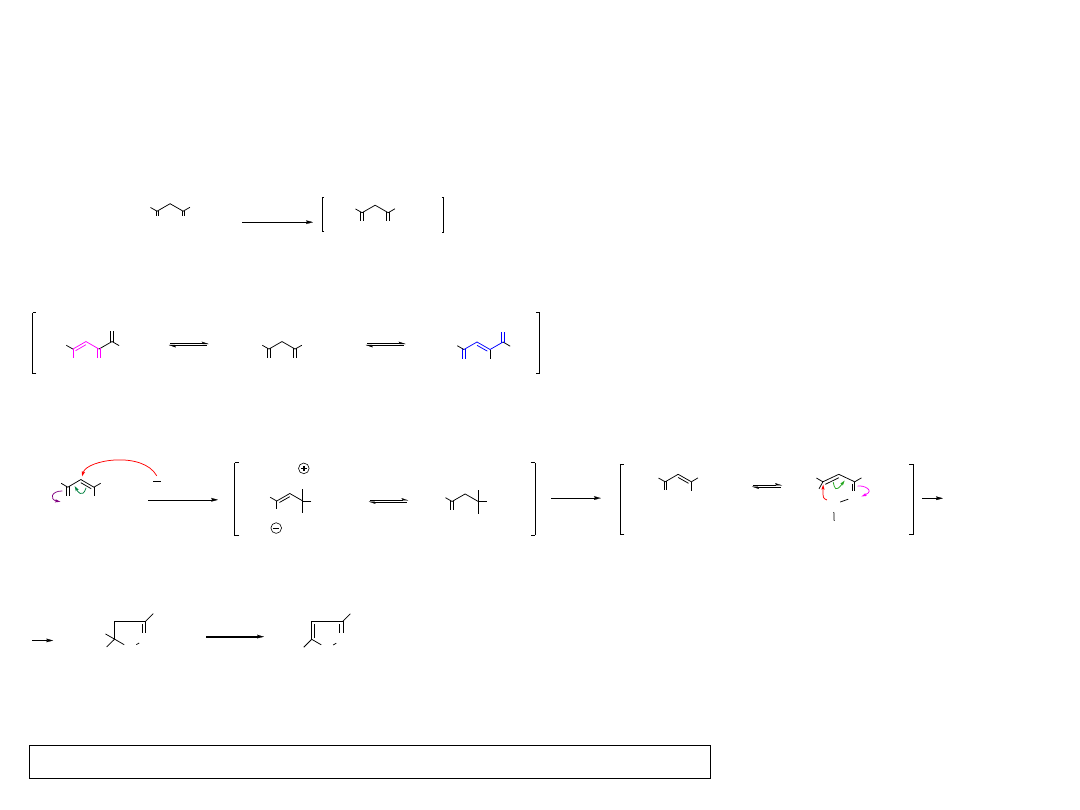
8
1.3.1. Wyjaśnienie przebiegu wybranych etapów
1.3.1.A. Synteza Claisena
H
3
C
CO
2
Et
O O
NH
2
OH
H
3
C
CO
2
Et
O NOH
4
3
O
N
H
3
C
HO
CO
2
Et
O
N
H
3
C
CO
2
Et
5
- H
2
O
Eicher, T.; Hauptmann, S. „The chemistry of heterocycles”, Viley-VCH, 2003.
H
3
C
CO
2
Et
O OH
NH
2
OH
2
H
3
C
CO
2
Et
O OH
NH
2
OH
H
3
C
CO
2
Et
O OH
NHOH
3 (3a)
H
3
C
CO
2
Et
O NHOH
HO
CO
2
Et
H
3
C
N
4
O
H
- H
2
O
H
3
C
OH O
H
3
C
CO
2
Et
O O
H
3
C
O OH
OEt
O
3
tautomeria
3a
3b
O
OEt
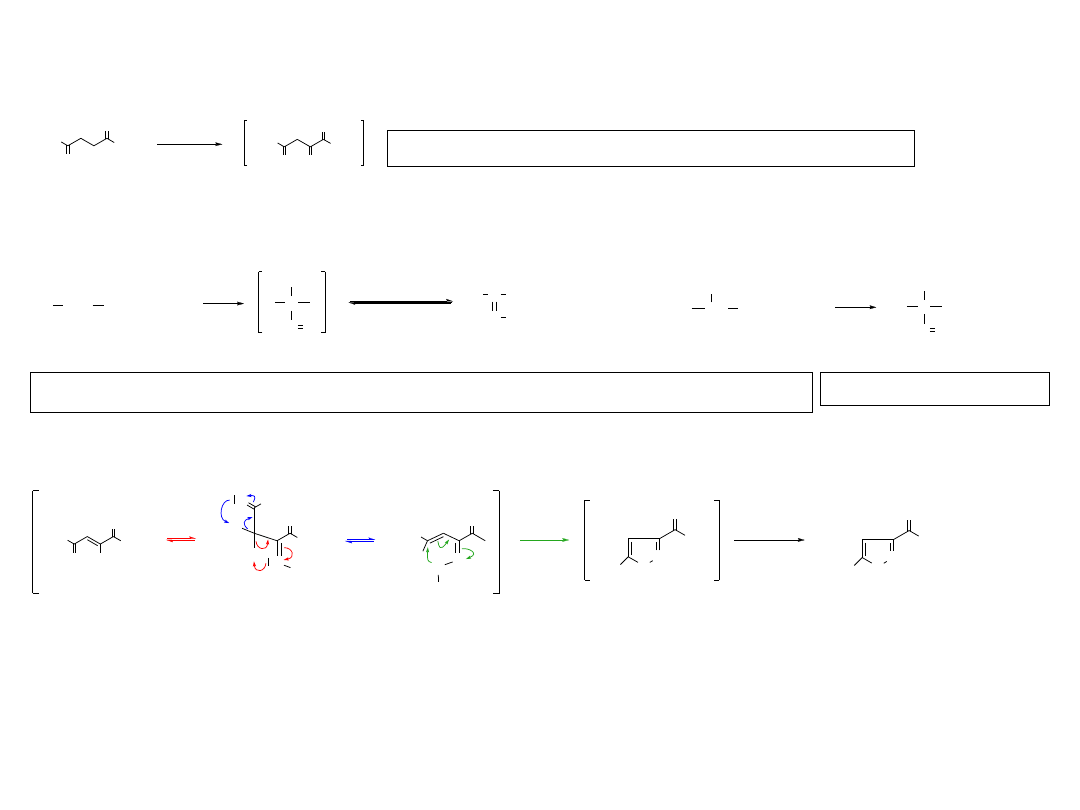
9
1.3.1.B. Powstawanie i cyklizacja oksymu (7)
Z = COOR, CHO, COR, CONR
2
, COO
−
, CN, NO
2
, SOR, SO
2
R, SO
2
OR, SO
2
NR
2
Org. React. 1953, 7, 327.
Nitrozowanie aktywnych związków metylenowych
H
3
C
O
CH
3
O
[HNO
2
]
H
3
C
O
CH
3
O
NOH
6
7
R CH
2
Z + HONO
R C Z
N
H
O
R C Z
N OH
tautomeria
związek nitrozowy
oksym
R CH Z + HONO
R C Z
N
R
1
O
związek nitrozowy
R
1
tautomeria
7
O
N
H
3
C
CH
3
O
H
N
HO
H
3
C
N
O
H
- H
2
O
CH
3
O
O
[HNO
2
]
O
N
H
3
C
OH
O
[O]
8
H
3
C
O
CH
3
O
NHOH
CH
3
O
H
OH
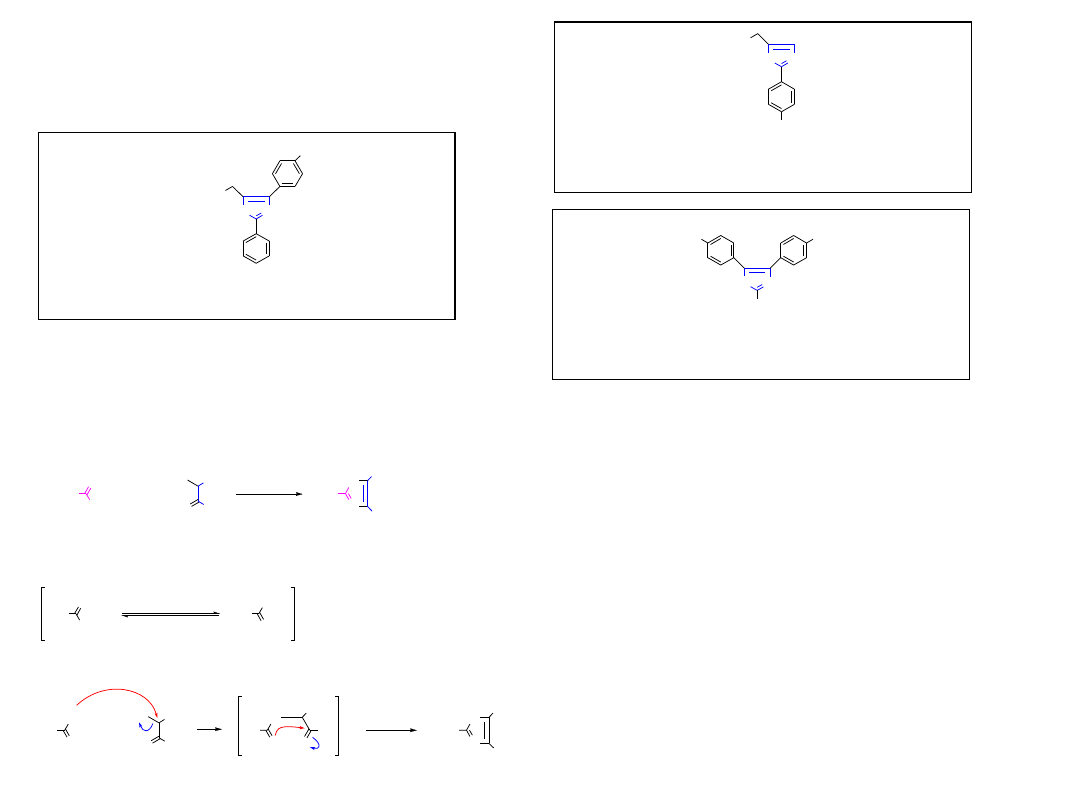
10
1.4. Pochodne tiazolu
Niesteroidowe leki przeciwzapalne.
Fentiazak (INN, fentiazac)
Kwas fenklozowy (INN, fenclozic acid)
Itazygrel (INN, itazigrel)
S N
HO
2
C
Cl
S N
HO
2
C
Cl
S N
CF
3
OCH
3
H
3
CO
Synteza Hantzscha pochodnych tiazolu
S
N
R
2
R
3
R
1
R
1
NH
2
S
Br
O
R
3
R
2
+
zasada
tiomocznik
α
-haloketon
R
1
NH
2
S
R
1
NH
SH
tautomeria
R
1
NH
SH
Br
O R
3
R
2
+
S
NH
R
2
R
1
O
R
3
S
N
R
2
R
3
R
1
- H
2
O

11
NAZWA PENICYLINY
R
Penicylina I (F)
Penicylina
dwuhydro-F
Penicylina II (G)
Penicylina III (X)
Penicylina IV (K)
Penicylina V
Penicylina O
1.5. Układ Penanu (ang. penane) i Penicyliny (INN, penicilline)
Antybiotyki pochodzenia naturalnego o szerokim spektrum działania.
Tzw. penicylina krystaliczna (Penicylinum crystallisatum) – mieszanina soli sodowych lub
potasowych różnych penicylin o zawartości Penicyliny G powyżej 85%
Rolski, S. „Chemia środków leczniczych”, PZWL, W-wa 1968.
S
N
O
N
H
O
R
H
3
C
H
3
C
O
HO
H
CH
2
CH CH CH
2
CH
3
CH
2
CH
2
CH
2
CH
2
CH
3
CH
2
CH
2
OH
CH
2
CH
2
CH
2
CH
2
CH
2
CH
2
CH
3
O
CH
2
CH
2
S CH
2
CH CH
2
12
2. Układy pięcioczłonowe z trzema lub czterema heteroatomami
2.1. Pochodne 1,2,4-oksadiazolu - oksolamina (INN, oxolamine)
Wziewny lek przeciwzapalny i przeciwkaszlowy.
Chem. Abstr. 1962, 56, 11598.
Cl
O
, NaOEt
Cl
NEt
3
N OH
NH
2
Ph
N
O
NH
2
Ph
O
Cl
N
N O
Cl
Ph
1
2
3
- H
2
O
1
2
3
4
5
HNEt
2
N
N O
NEt
2
Ph
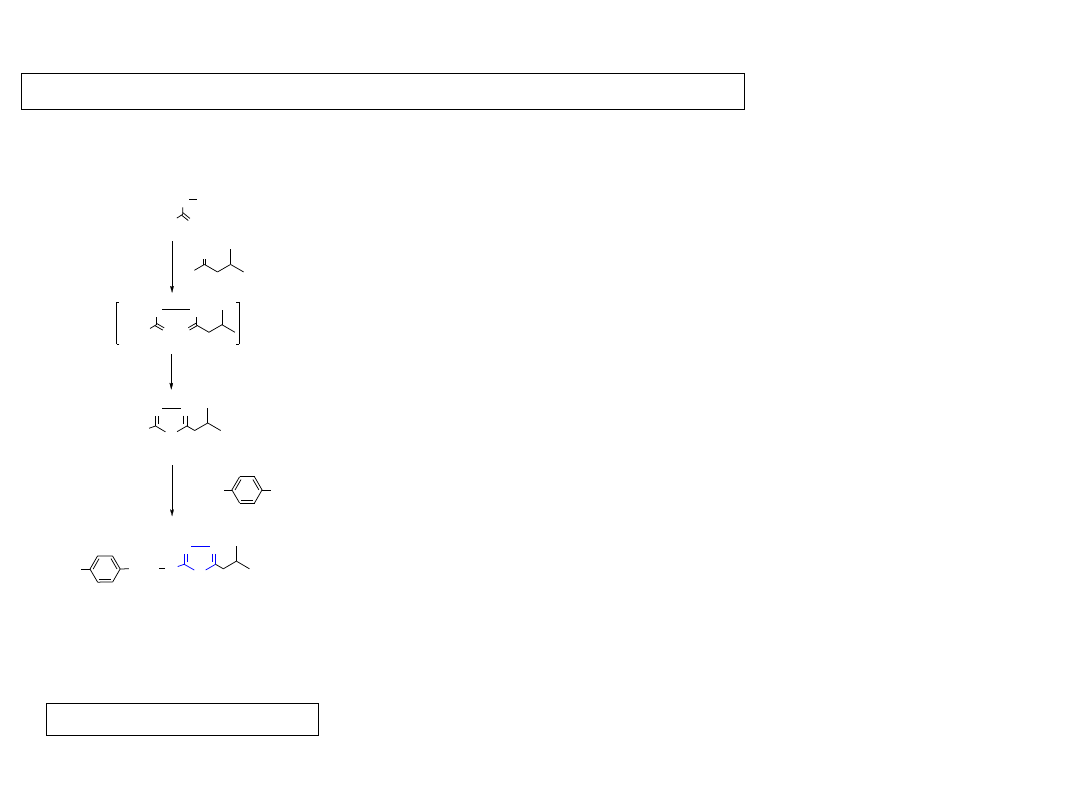
13
2.2. Pochodne 2-amino-1,3,4-tiadiazolu - izobuzol (INN, isobuzole)
Środek powodujący obniżenie poziomu cukru we krwi.
Can. J. Chem. 1959, 37, 1121.
H
2
N
HN NH
2
S
Cl
O
NH
HN
H
2
N S O
1
2
N
S
N
H
2
N
H
3
CO
SO
2
Cl
3
- H
2
O
N
S
N
N
H
1
2
3
4
5
SO
2
H
3
CO
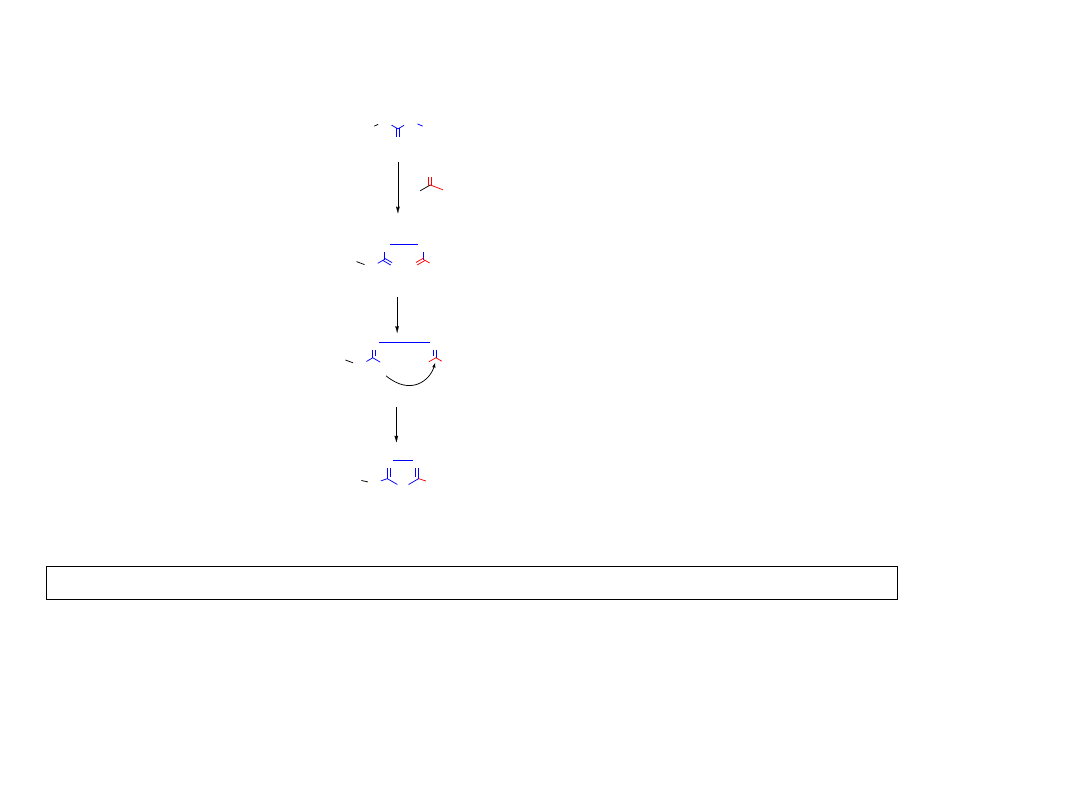
14
Ogólna metoda syntezy pochodnych 2-amino-1,3,4-tiadiazolu
Gupta, R. R.; Kumar, M.; Gupta, V. „Hetrocyclic Chemistry II” Springer-Verlag, Heidelberg 1999.
H
N
H
N NH
2
S
R
1
Cl
O
NH
HN
N
H
R
1
S
O
N
S
N
N
H
R
1
- H
2
O
R
R
R
N
N
N
H
R
1
SH
HO
R
H
+
15
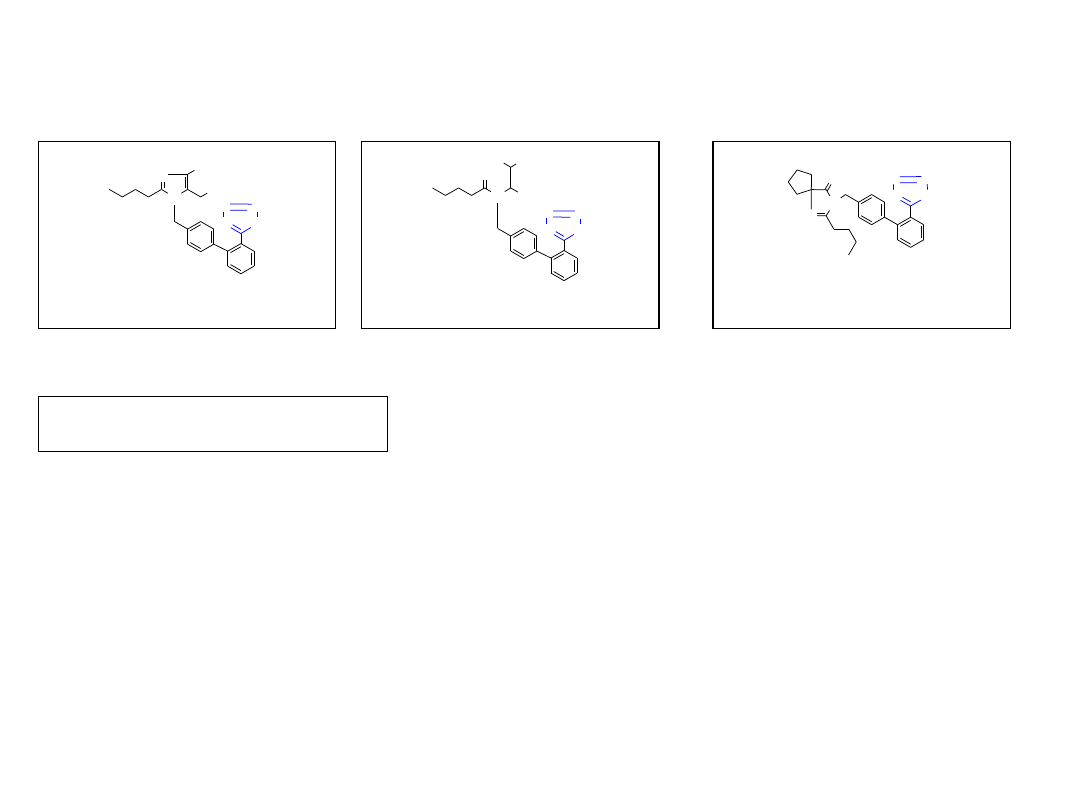
2.3. Pochodne tetrazolu
Walsartan
Losartan (INN, losartan)
Irbesartan (INN, ibersartan)
Leki przeciw nadciśnieniu
Bioorg. Med. Chem. Lett. 1994, 4, 29.
US Patent 5399578.
N
NH
N
N
N
O
CO
2
H
Me
Me
N
NH
N
N
N
HN
OH
Cl
N
NH
N
N
N
HN
O
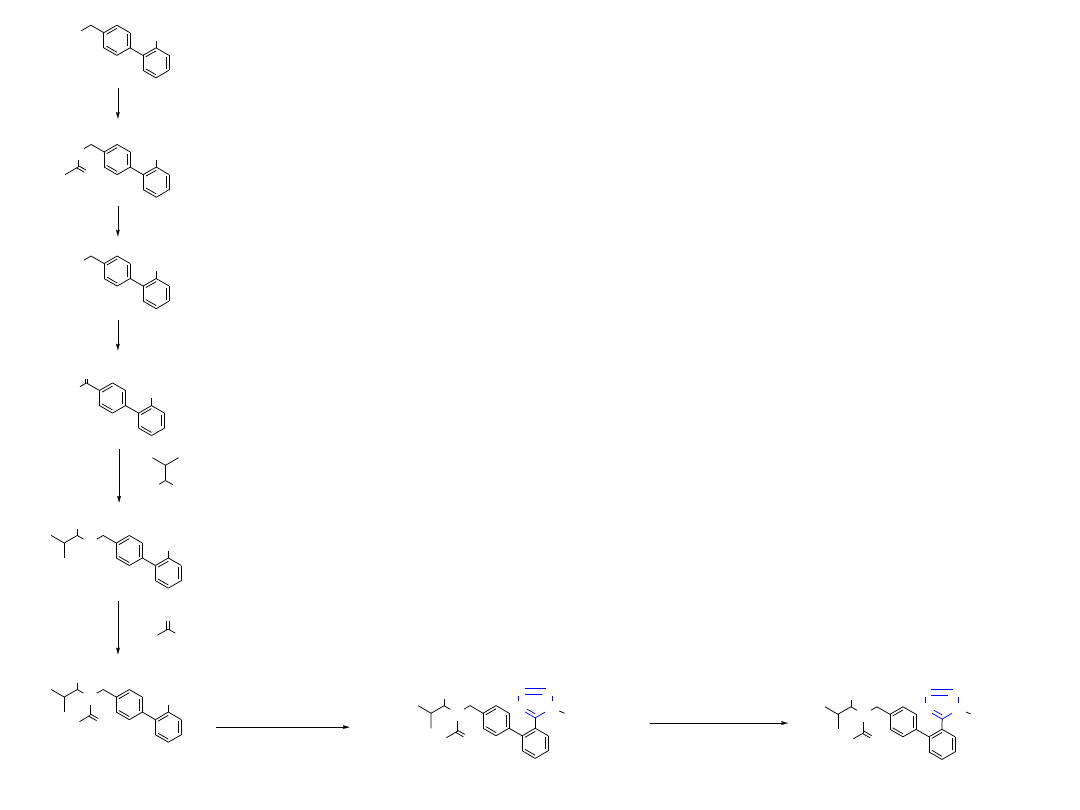
16
CN
Br
NaOAc, HOAc
CN
NaOH
1
2
3
O
O
CN
HO
CN
O
4 H
DMSO, (COCl)
2
H
2
N CO
2
Me
, NaCNBH
4
CN
5
N
H
CO
2
Me
C
4
H
9
Cl
O
Bu
3
SnN
3
6
7
(1) NaOH, (2) HCl
CN
N
CO
2
Me
O
C
4
H
9
N
N
N
N
N
CO
2
Me
O
C
4
H
9
SnBu
3
N
N
N
N
N
CO
2
Me
O
C
4
H
9
H
17
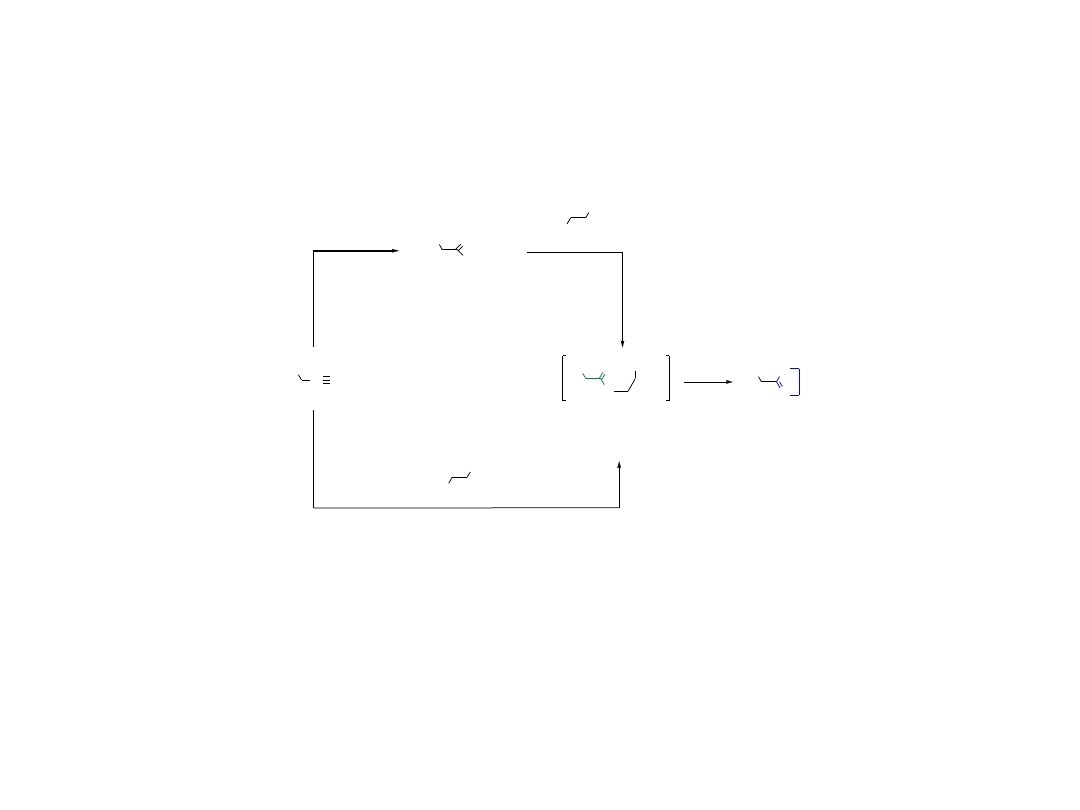
2.3.1. Wyjaśnienie przebiegu wybranych etapów
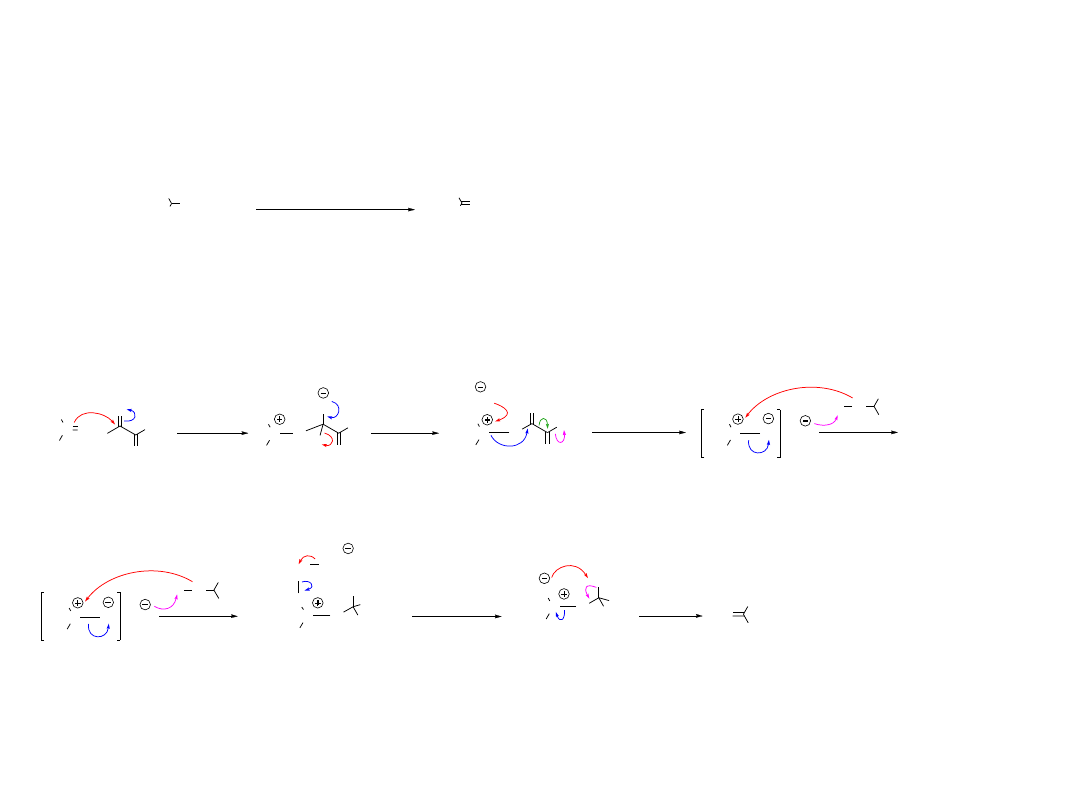
2.3.1.A. Utlenianie Swerna
Me
S
Me
O Cl
Cl
O
O
O
Cl
O
O
S
Me
Me
Cl
-78 °C
O
Cl
O
O
S
Me
Me
Cl
- CO
2,
- CO
Cl
S
Me
Me
Cl
R
R
1
O
H
- HCl
H
O R
1
R
S
H
2
C
Me
Cl
NEt
3
H
- NEt
3
*HCl
H
O R
1
R
S
H
2
C
Me
Cl
S
Me
Me
Cl
R
R
1
O
H
- HCl
- Me
2
S
R
R
1
O
alkohol 1° lub 2°
aldehyd lub keton
R
R
1
OH
(1) (COCl)
2
/DMSO
(2) NEt
3
R
R
1
O
18
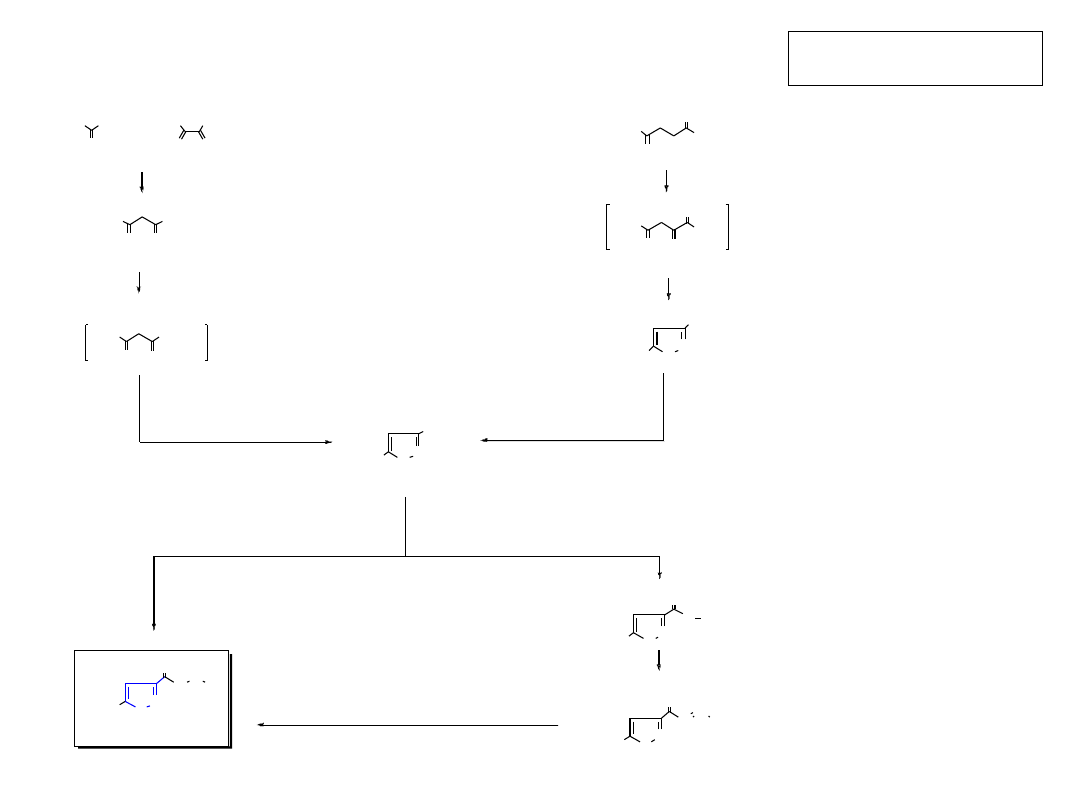
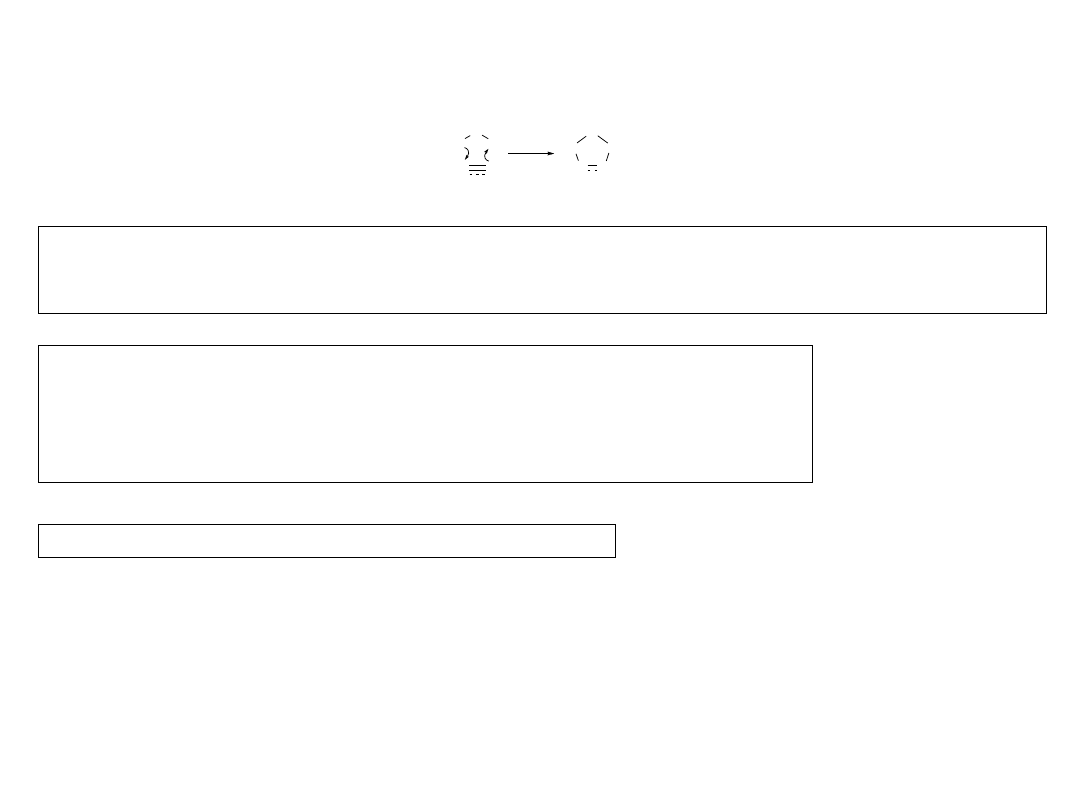
2.3.1.B. 1,3-Dipolarna cykloaddycja
Padwa, A. „1,3-Dipolar cycloaddition chemistry” Wiley, NY, 1984.
Dipole posiadają sekwencję trzech atomów a—b—c, z których atom (a) ma sekstet elektronowy,
a atom (c) ma oktet elektronowy i co najmniej jedną wolną parę elektronową.
Nie zawsze są to związki trwałe, wielokrotnie są generowane in situ.
Dipolarofile: alkeny, alkiny lub nienasycone układy heteroatomowe jak np.:
R–C
≡
N (nitryle),
R–N
=
C
=
S (izotiocyjaniany),
dwusiarczek węgla (S
=
C
=
S),
dwutlenek węgla (O
=
C
=
O).
a
b
c
X
Y
X Y
c
b
a
dipol
dipolarofil
19
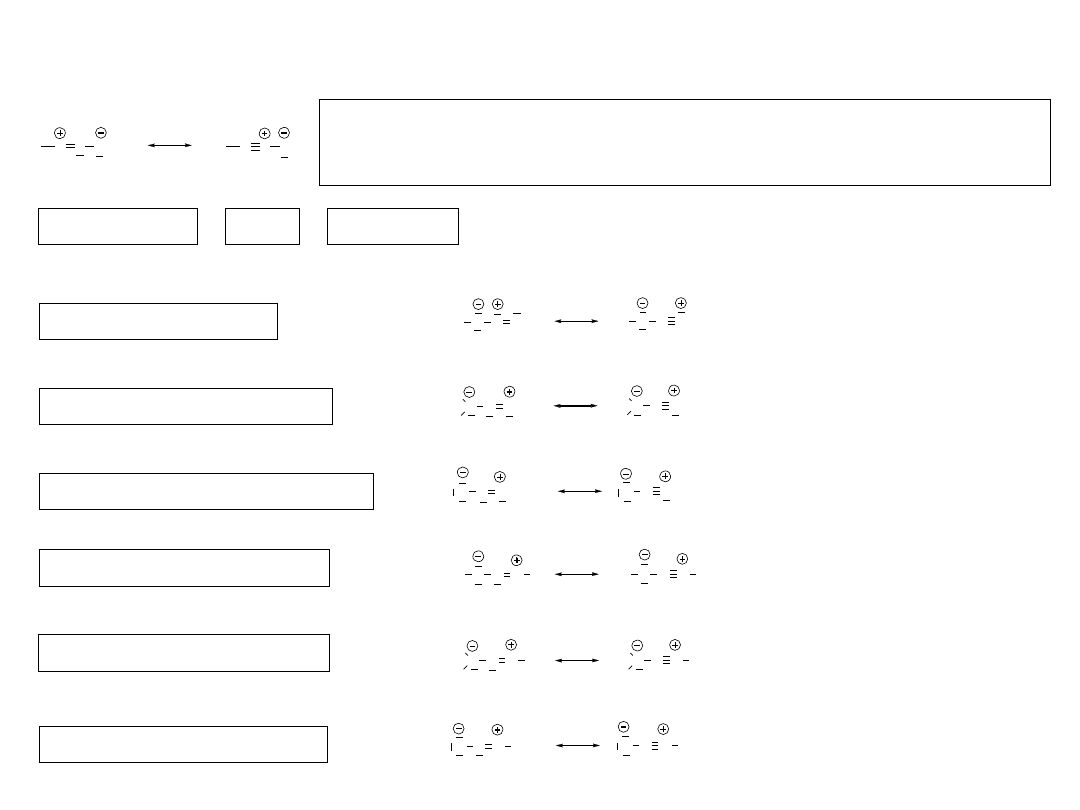
Dipole 1. rodzaju
W jednej strukturze mezomerycznej atom posiadający sekstet
elektronowy jest składową wiązania podwójneg, a w drugiej strukturze
ten sam atom jest składową wiązania potrójnego.
b = N
c = N lub C
a = N, O lub C
a
b c
a
b c
N N
N
N N
N
R
R
C N
N
C N
N
R
R
R
R
O N
N
O N
N
N N
C
N N
C
R
R
R
R
C N
C
R
R
R
C N
C
R
R
R
O N
C
O N
C
R
R
Azydki (azides)
Diazoalkany (diazoalkanes)
Podtlenek azotu (nitrous oxide)
Iminonitryle (nitrile imines)
Ylid azotowy (nitrile ylides)
Tlenki nitryli nitrile oxides)

20
Dipole 2. rodzaju
W jednej strukturze mezomerycznej atom posiadający sekstet
elektronowy jest składową wiązania pojedynczego, a w drugiej
strukturze ten sam atom jest składową wiązania podwójnego.
b = N lub O
a = N, O lub C
c = N, O lub C
a
b c
a
b c
N
N O
R
C
N
N
R
R
R
R
R
N
N O
R
R
C
N
N
R
R
R
R
C
N
C
R
R
R
R
R
C
N
C
R
R
R
R
R
C
N O
R
R
R
C
N O
R
R
R
C
O O
R
R
C
O O
R
R
O
O O
O
O O
Ozon (ozone)
Tlenki karbonylu (carbonyl oxides)
Nitrony (nitrones)
Ylidy azometinowe (azomethine ylids)
Azoksyzwiązki (azoxy compounds)
Iminy azometinowe (azomethine imines)
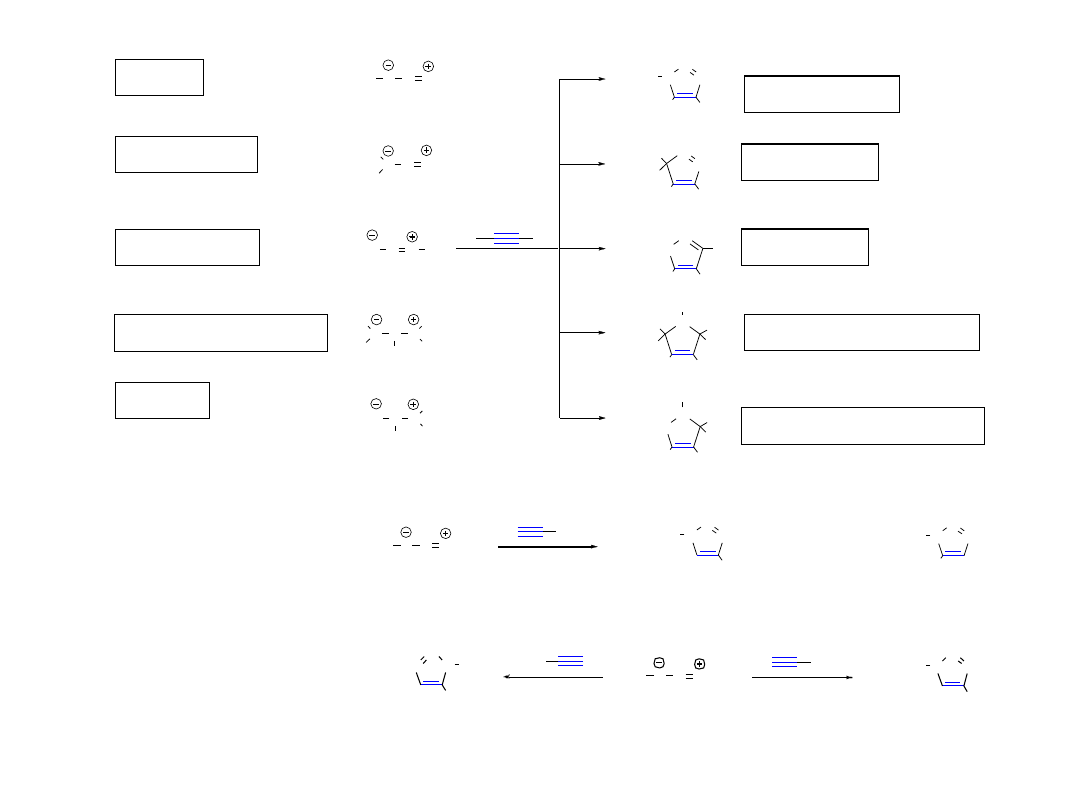
21
Azydki
Diazoalkany
Tlenki nitryli
Ylidy azometinowe
Nitrony
N N NH
2
R
N
N
N
R
N
N
R
C N NH
2
R
R
R
O N C R
O
N
R
C N C
R
R
R
R
R
N
R
R
R
R
C
N
O
R
R
R
N
O
R
R
R
R
R
1
R
1
R
1
R
1
R
1
R
1
R
1
R
1
R
1
R
1
R
1
R
1
1,2,3-Triazole
3H-Pirazole
Izoksazole
2,5-Dihydro-1H-pirole
2,3-Dihydroisoksazole
1,3-Dipolarna cykloaddycja wybranych dipoli do alkinów
N N NH
2
R
N
N
N
R
R
1
R
1
∆
T
N
N
N
R
R
1
+
1,4-dipodstawiony-1,2,3-triazol
(zwykle produkt główny)
1,5-dipodstawiony-1,2,3-triazol
alkin terminalny
N N NH
2
R
N
N
N
R
R
1
R
1
1,4-dipodstawion y-1,2,3-triazol
(jedyny produkt)
Cu(I)
N
N
N R
R
1
1,5-dipodstawiony-1,2,3-triazol
(jedyny p rodukt)
Ru(I)
R
1
Document Outline
- Slajd 1
- Slajd 2
- Slajd 3
- Slajd 4
- Slajd 5
- Slajd 6
- Slajd 7
- Slajd 8
- Slajd 9
- Slajd 10
- Slajd 11
- Slajd 12
- Slajd 13
- Slajd 14
- Slajd 15
- Slajd 16
- Slajd 17
- Slajd 18
- Slajd 19
- Slajd 20
- Slajd 21
Wyszukiwarka
Podobne podstrony:
dyd tech507
dyd tech506
dyd tech507
DYD 9 PRAWO KARNE Folie
DYD 7 PRAWO FINANSOWE
dyd bio306
dyd tech14
dyd inz n15
dyd inz e05 id 144824 Nieznany
dyd k2c r id 144871 Nieznany
Klasyfikacje- mat dyd 2008-9, dysleksja
MATERIAL DYD Z PSYCHOLOGII do bl[1]. ogolnozaw, Prace dyplomowe, pedagogika i psychologia
B. Myrdzik - Hermeneutyczna interpretacja tekstu poetyckiego w szkole. Próba aplikacji, Filologia po
Syt dyd wych, Filologia polska, Teoria kształcenia i wychowania
dyd tech405a, chemia, 0, httpzcho.ch.pw.edu.pldydaktyk.html, Technologia Chemiczna, Chemia Organiczn
dyd tech412, chemia, 0, httpzcho.ch.pw.edu.pldydaktyk.html, Technologia Chemiczna, Chemia Organiczna
plan pr dyd wych swietlicy szkolnej 6
Int nizsza niz przec- mat.dyd-2008-9, dysleksja
zsumowanie pytan dyd bio
więcej podobnych podstron