2012-10-20
1
BADANIE PŁYNU
MÓZGOWO-RDZENIOWEGO
Analityka ogólna i techniki pobierania materiału
ZAGADNIENIA
Ocena właściwości chemicznych PMR.
Oznaczanie glukozy w PMR.
Ocena barwionych preparatów cytologicznych
PMR.
22-23.11.11
2012-10-20
2
B
IAŁKA W
PMR
Prawidłowe stężenie białka całkowitego w PMR:
-
0,15-0,4 g/l (15-40 mg/dl), przy czym wartości <45 mg/dl traktuje się
jako dopuszczalne (płyn z nakłucia lędźwiowego)
-
prawidłowy stosunek albumin/globulin: 2:1
Wzrost stężenia białka całkowitego:
-
krwawienie podpajęczynówkowe
-
ropne zapalenia mózgu
-
wirusowe zapalenie OMR (prawidłowe lub nieznacznie podwyższone)
-
guzy mózgu
ŹRÓDŁO BIAŁEK PMR:
Białka pochodzące z krwi (wyższe stężenie we krwi niż w PMR)
-
większość białek PMR
-
albumina, protrombina, IgG, IgA, IgM
Białka pochodzące z OUN (wyższe stężenie w PMR niż we krwi)
-
białko tau
-
białko S-100
-
NSE (enolaza neurospecyficzna)
-
cystatyna C
Białka pochodzące częściowo z krwi i częściowo z OUN
-
sICAM-1 (cząsteczka adhezyjna)
-
transtyretyna (prealbumina)
2012-10-20
3
I
MMUNOGLOBULINY
W warunkach fizjologicznych immunoglobuliny w PMR pochodzą tylko i
wyłącznie z krwi i dyfundują na drodze dyfuzji prostej.
W warunkach patologicznych (np. infekcje, SM, wrodzone zakażenia OUN):
- immunoglobuliny mogą być również syntetyzowane wewnątrzoponowo przez
limfocyty B i komórki plazmatyczne w OUN.
- dysfunkcja bariery krew-płyn również zwiększa dyfuzję Ig do płynu.
•
Dlatego informacja o współczynnikach immunoglobulinowych musi być
poparta informacją o Q
Alb
B
IAŁKO W
PMR-
ANALIZA JAKOŚCIOWA
We wstępnej ocenie białek w PMR pomocne są odczyny białkowe,
dające informację na temat zawartości białka i stosunku albumin/globulin:
Odczyn Pandy`ego
Do 1 ml odczynnika Pandy`ego (fenol) dodać 1 kroplę PMR.
- Powstanie zmętnienia świadczy o podwyższonej zawartości białka w płynie i jest
proporcjonalne do jego stężenia.
Odczyn Nonne-Apelta
Do 0,5 ml PMR dodać 0,5 ml odczynnika Nonne-Apelta (nasycony r-ór
(NH
4
)
2
SO
4
. Inkubować przez 3 min. Ocenić zmętnienie.
-
Zmętnienie świadczy o zwiększonej zawartości globulin do albumin.
Odczyn Weichbrodta
Do 0,3 ml PMR dodać 0,7 ml odczynnika Weichbrodta (0,1% r-ór sublimatu).
Inkubować 3 min. Ocenić zmętnienie.
-
Zmętnienie świadczy o podwyższonym stężeniu globulin.
2012-10-20
4
I
NTERPRETACJA I FORMUŁOWANIE WYNIKU
(
ODCZYNY BIAŁKOWE
)
Brak zmętnienia: odczyn ujemny (-)
Opalescencja: odczyn wątpliwy (+/-)
Lekkie zmętnienie: odczyn dodatni (+)
Średnie zmętnienie: odczyn dodatni (++)
Silne zmętnienie lub kłaczki: odczyn dodatni (+++)
BIAŁKO W PMR
-
ANALIZA ILOŚCIOWA
Metoda Extona
Zasada metody: Białko wytrąca się roztworem kwasu sulfosalicylowego
z siarczanem sodowym. Stopień zmętnienia próbki, proporcjonalny do
stężenia białka, określa się spektrofotometrycznie poprzez pomiar
absorbancji przy λ=445 nm.
2012-10-20
5
B
IAŁKO W
PMR
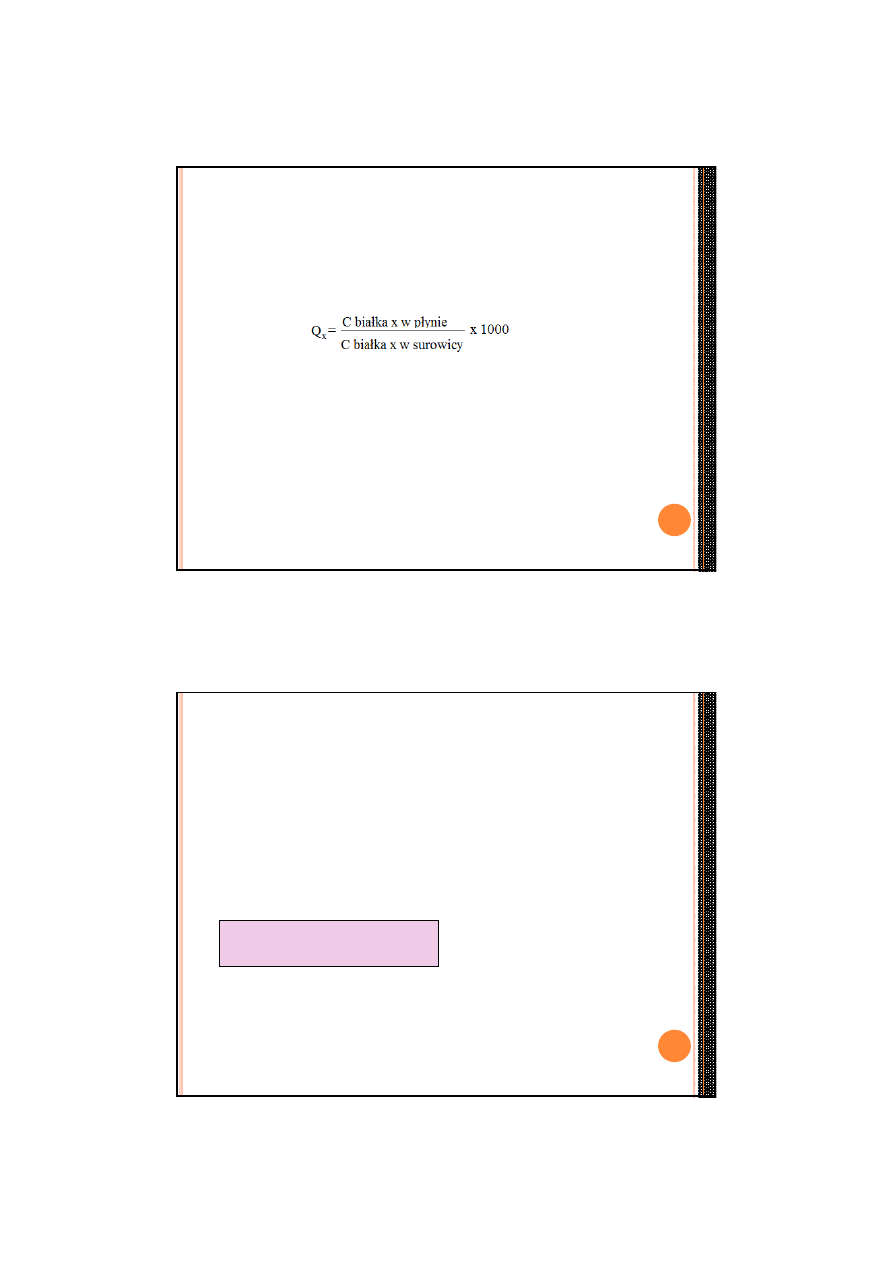
Współczynniki stężeń płyn/surowica
-
Białko w PMR i w surowicy (mg/dl)
-
eliminacja wpływu wahań dobowych stężeń białek we krwi na ich stężenia w PMR
-
eliminacja błędów analitycznych
-
Wartość prawidłowa: dla Qalb <9
-
9<Q
x
<14- lekkie upośledzenie bariery krew-mózg
-
14<Q
x
<30- umiarkowane upośledzenie bariery
-
30<Q
x
<100- poważne upośledzenie bariery
-
Q
x
>100- całkowite złamanie bariery
W
SKAŹNIKI PŁYN
/
SUROWICA C
.
D
.
Współczynnik albuminowy (Q
Alb
)- ocena sprawności bariery
krew-płyn
Im wyższy stopień dysfunkcji bariery krew-płyn, tym bardziej
nasilona dyfuzja albuminy z krwi do płynu, czego efektem jest
wzrost stężenia albuminy w płynie i wyższa wartość Q
alb
Górna granica wartości prawidłowej Q
Alb
w zależności od wieku dla
osób dorosłych:
*Prawidłowy Qalb w płynie pobranym z komór bocznych jest 3-krotnie niższy w
stosunku do płynu z worka lędźwiowego
Q
alb= [(wiek w latach)/15] +4

2012-10-20
6
W
SPÓŁCZYNNIKI PŁYN
/
SUROWICA
Współczynniki Q
IgG
, Q
IgA
, Q
IgM
(ocena wewnątrzoponowej syntezy immunoglobulin)
Zależność w warunkach prawidłowych:
Q
Alb
> Q
IgG
> Q
IgA
> Q
IgM (
uwarunkowane masą cząsteczkową białek)
-
oznaczenie stężenia Ig w surowicy i PMR
-
obliczenie górnej granicy wartości prawidłowej w zależności od Q
alb
wg.
wzorów:
- interpretacja wyników w oparciu o położenie na Reibergramach
W
SKAŹNIK
L
INKA I
T
IBLINGA
Wartości referencyjne: 0,3-0,7
Wzrost > 0,7: wewnątrzoponowa synteza IgG (np. SM)
Wartość < 0,3: uszkodzenie bariery krew-mózg
2012-10-20
7
I
NNE METODY STOSOWANE DO OZNACZANIA
BIAŁEK SPECYFICZNYCH
Metody immunochemiczne:
-
Immunoturbidymetryczne
-
Immunonefelometryczne
-
Immunoenzymatyczne
-
Radioimmunologiczne
-
Immunodyfuzja radialna
-
Immunochemiluminescencyjne
I
NNE METODY STOSOWANE DO OZNACZANIA
BIAŁEK SPECYFICZNYCH
Elektroforeza białek PMR
-
Płyn 100-200x zagęszczony (kondensatory kolodionowe)
-
pasmo prealbuminy (nieobecna w surowicy)
-
Białko tau - desjalizowana transferyna (pomiędzy frakcją beta i
gamma)
Większa zawartość β- globulin i mniejsza γ- globulin w stosunku do
surowicy
Brak fibrynogenu
•
Elektroforeza PMR wykonywana jest łącznie z elektroforezą
surowicy!

2012-10-20
8
F
RAKCJE ELEKTROFORETYCZNE
Frakcja białkowa
% białka całkowitego
Prealbuminy (transtyretyna)
2-3
albuminy
55-65
alfa 1- globuliny
5-7
alfa 2- globuliny
8-10
beta-globuliny
9-11
białko tau
3-4
gamma-globuliny
5-7
R
EIBERGRAMY
Interpretacja:

2012-10-20
9
JAKOŚCIOWA OCENA WEWNĄTRZOPONOWEJ SYNTEZY
IMMUNOGLOBULIN
Równolegle do badania ilościowego, należy przeprowadzić ocenę
jakościową w oparciu o ogniskowanie izoelektryzne
(rozdział białek w polu elektrycznym w zależności od ich
punktów izoelektrycznych. pH buforu zmienia się w sposób
ciągły od najwyższego przy katodzie do najniższego przy
anodzie)
np. w warunkach fizjologicznych frakcja IgG stanowi mieszaninę
białek pochodzących od różnych klonów. W stanach choroby (np.
infekcje wirusowe) zwiększa się produkcja IgG od jednego klonu,
skierowanych przeciwko jednemu lub kilku Ag tego patogenu
lub przeciw własnym Ag (choroby z autoagresji).
należy porównać obraz elektroforetyczny z rozcieńczonej
surowicy oraz PMR i zinterpretować badanie.
I
NTERPRETACJA WYNIKÓW OGNISKOWANIA
IZOELEKTRYCZNEGO
I
G
G
Ty
p
Prążki w
surowicy
Prążki w płynie
Interpretacja
1
brak
brak
obraz prawidłowy
2
brak
obecne
wewnątrzoponowa synteza IgG
(Choroby zapalne OUN)
Stwardnienie rozsiane
3
obecne
prążki identyczne
jak w surowicy +
prążki dodatkowe
zapalenie ogólnoustrojowe z
zajęciem OUN
(Neurosarkoidoza)
4
obecne
prążki wyłącznie
identyczne jak w
surowicy
zapalenie ogólnoustrojowe,
bierna dyfuzja IgG z krwi do
płynu
(Zespół Guillaina-Barre)
5
jeden lub kilka
silnie wysyconych
prążków
(monoklonalne)
obraz identyczny
jak w surowicy
gammapatie, np. szpiczak
bierna dyfuzja z krwi do płynu
2012-10-20
10
O
CENA WEWNĄTRZOPONOWEJ SYNTEZY PRZECIWCIAŁ
-
INDEKSY PRZECIWCIAŁ SPECYFICZNYCH
(
WSKAŹNIK HAGEDRONA
)
Ocena stężenia przeciwciał przeciwko poszczególnym
czynnikom patogennym (antygenom)
Oznaczenie stężenia danego przeciwciała w surowicy i
płynie metodami immunochemicznymi (wysoka czułość)
Obliczenie współczynników dla danego przeciwciała
Obliczenie indeksu przeciwciała (AI):
np.
AI
IgGpatogen
= Q
IgGpatogen
/Q
IgG
* w zależności która wartość jest niższa Q
IgG
czy Q
lim
(IgG), tę wartość należy
wstawić do wzoru.
WARTOŚĆ PRAWIDŁOWA: AI=0,7-1,3
Wartości ≥ 1,4 (wewnątrzoponowa synteza immunoglobulin danej klasy
Wartość < 0,7 (błąd analityczny)
B
ADANIA PODSTAWOWE
Glukoza w PMR
-
podstawowy substrat energetyczny neuronów
-
stężenie prawidłowe w PMR: 50-60% stężenia w surowicy ok. 40-75
mg/dl
Podwyższone stężenie:
-
brak znaczenia diagnostycznego w przypadku prawidłowego
stężenia we krwi
-
Cukrzyca
-
Urazy i udary mózgu
Obniżone stężenie:
-
Bakteryjne, grzybicze i gruźlicze zapalenia OMR
-
procesy nowotworowe w OUN
-
- hipoglikemia
*
krew i surowica powinny być pobrane do badania co najmniej po 4 godzinach od posiłku!
2012-10-20
11
GLUKOZA
W
PMR
Metoda heksokinazowa- Glukoza pod wpływem heksokinazy zostaje
ufosforylowana do glukozo-6-fosforanu, który pod wpływem dehydrogenazy jest
specyficznie utleniany do 6-fosfoglukonianiu, redukując NADP
+
do NADPH
2
.
Pomiaru absorbancji dokonuje się przy 340 nm. Obserwuje się wzrost absorbancji
proporcjonalny do stężenia glukozy.
heksokinaza
glukoza + ATP glukozo-6-P + ADP
dehydrogenza glukozo-6-P
glukozo-6-P + NADP
+
6-fosfoglukonian + NADPH + H
+
Interferencja: hemoliza próbki
BADANIA PODSTAWOWE
Chlorki w PMR
-
stężenie prawidłowe: 112-130 mmol/l
Metoda Zall’a, Fisher’a i Garner’a.
Jon chlorkowy (Cl-) zmieszany z roztworem niezdysocjowanego rodanku rtęciowego
preferencyjnie wiąże się z rtęcią tworząc chlorek rtęciowy. Uwalniany jon rodankowy SCN-
łączy się z jonami żelazowymi dając silnie zabarwiony rodanek żelazowy absorbujący
światło o długości fali 500 nm. Intensywność zabarwienia jest wprost proporcjonalna do
stężenia jonów chlorkowych w badanej próbce.
Stężenie podwyższone:
-
stany zapalne mózgu i rdzenia kręgowego
-
guzy mózgu
Stężenie obniżone:
-
gruźlicze zapalenie OMR
-
kiła układu nerwowego
-
Pląsawica
-
grzybicze zapalenie
2012-10-20
12
B
ADANIA UZUPEŁNIAJĄCE
Mleczany
-
reszty kwasu mlekowego powstające z komórkach na skutek
niedoboru tlenu;
-
stężenie mleczanów w PMR jest niemal niezależne od
stężenia w surowicy (produkcja w OUN)
-
parametr oceny procesów zapalnych w OUN
Stężenie prawidłowe: < 2,1 mmol/l
Wzrost stężenia:
-
choroby z dysfunkcją bariery krew-płyn
-
hipoksemiczne uszkodzenia mózgowo-rdzeniowe
-
krwawienie podpajęczynówkowe
-
obrzęk mózgu
-
zwiększona granulocytoza płynu
-
procesy nowotworowe w OUN
-
zakażenia bakteryjne > 3,5 mmol/l
-
zakażenia wirusowe < 3,5 mmol/l
-
Zakażenie grzybicze, gruźlica OUN,
B
ADANIA UZUPEŁNIAJĄCE
Białko tau
99% białka w PMR pochodzi z komórek OUN
stężenie prawidłowe: < 300 pg/ml
Podwyższone stężenie:
-
choroba Alzheimera
Obniżone stężenie:
-
neuroborelioza i inne choroby zapalne
Białko S-100b
-
izoforma ważna diagnostycznie w monitorowaniu
uszkodzeń w OUN, np. po urazach
-
Stężenie prawidłowe: < 1,4 ng/ml
2012-10-20
13
B
ADANIA UZUPEŁNIAJĄCE
Białko 14.3.3
-
białko produkowane w komórkach nerwowych.
-
nie występuje w prawidłowym PMR
Występowanie:
-
Choroba Creutzfeldta-Jakoba
NSE (enolaza neurospecyficzna)
produkowana przez kom. nerwowe i neuroendokrynne.
Stężenie prawidłowe: < 12,5 ng/l
Wzrost stężenia:
-
uszkodzenie neuronów, np. przy udarach
Inne: β-amyloid > 500 pg/ml
LITERATURA
1.
Mantur M, Lewczuk P. Płyn mózgowo-rdzeniowy. Badanie i
interpretacja wyników. Wydawnictwo Ekonomia i Środowisko,
Białystok, 2002.
2.
Dembinska-Kieć A, Naskalski JW. Diagnostyka laboratoryjna z
elementami biochemii klinicznej. Urban & Partner, Wrocław, 2010.
3.
Uszyński M (red.). Płyny z jam ciała. Powstawanie i badania
laboratoryjne. PZWL, Warszawa, 1998.
4.
Guder WG i wsp. Próbki: od pacjenta do laboratorium. MedPharm
Polska, Wrocław, 2009.
5.
Angielski S (red.). Biochemia kliniczna i analityka. PZWL, Warszawa,
1980.
6.
Brunzel NA. Diagnostyka laboratoryjna. Płyn mózgowo-rdzeniowy i
inne płyny ustrojowe. Kemona H, Mantur M (red.). Elsevier U&P,
Wroclaw, 2010.
Wyszukiwarka
Podobne podstrony:
BADANIE PŁYNU MOZGOWO RDZENIOWEGO ćw 1 2 slajdy [tryb zgodności]
BADANIE PŁYNU MÓZGOWO RDZENIOWEGO
Badanie plynu mozgowo rdzeniowego, INTERNA, badanie i Diagnostyka
Badanie płynu mózgowo rdzeniowego w sm
Badanie plynu mozgowo rdzeniowego
Merrit (FLAGGERMUS), ZABURZENIA PŁYNU MÓZGOWO, ZABURZENIA PŁYNU MÓZGOWO-RDZENIOWEGO
Prawidłowe wartości płynu mózgowo rdzeniowego, PEDIATRIA ( zxc )
Wyciek płynu mózgowo - rdzeniowego, Laryngologia
krązenie płynu mozgowo-rdzeniowego, fizjoterapia, Anatomia
Ćw 3 MIĘŚNIE [tryb zgodności]
I Wybrane zagadnienia Internetu SLAJDY [tryb zgodności]
C3b C3c Badanie płynu mózgowo
Ocena parametrów płynu mózgowo rdzeniowego 2013
W2 Wyciek płynu mózgowo rdzeniowego,
NIEDOKRWIENNA CHOROBA SERCA Cw MM [tryb zgodności]
więcej podobnych podstron