
1.2. Izolacja i analiza lipidów 21
szkło podstawowe;
kolba do wyparki;
wyparka próżniowa.
Postępowanie:
• 20 g liści lub 25 ml upakowanych chloroplastów umieścić w rozdzielaczu na
500 ml.
• Dodać 100 ml metanolu i wytrząsać przez kilka minut.
• Dodać 200 ml chloroformu i całość wytrząsać przez obracanie przez kilka
minut.
• Dodać 100 ml metanolu i dodatkowo mieszać przez chwilę.
• Dodać 150 ml roztworu chlorku sodowego i mieszać całość przez dodatkowe
kilka minut.
• Pozostawić na co najmniej 30 min dla rozdzielenia faz.
• Zebrać fazę dolną (około 200 ml).
• Do fazy górnej dodać 200 ml chloroformu i całość mieszać przez kilka minut;
pozostawić do rozdzielenia faz.
• Zebrać fazę dolną i połączyć ją z zebraną poprzednio fazą dolną.
• Do połączonych faz dodać 200 ml roztworu NaCl i wytrząsać przez kilka
minut; pozostawić na 60 min dla rozdzielenia faz.
• Zebrać fazę dolną i odparować z niej rozpuszczalnik. Dla ułatwienia odparo-
wania wody dodać do fazy dolnej izopropanolu (około 50 ml). Uzyskane
lipidy przechowywać w -70°C rozpuszczone w małej ilości chloroformu.
1.2. Izolacja i analiza lipidów
Po wyekstrahowaniu lipidów zwykle rozdziela się je na grupy na podstawie
różnic w rodzaju i ilości grup jonowych (fosforanowych, aminowych) i niejono-
wych (hydroksylowych, karbonylowych) obecnych w ich cząsteczkach. Do tego
celu stosuje się najczęściej techniki chromatograficzne. Do całkowitego rozdzie-
lenia mieszaniny lipidów stosuje się różne techniki chromatograficzne.
a) Chromatografia adsorbcyjna
Może być prowadzona na kolumnach w chromatografii cieczowej (LC, HPLC)
2
lub cienkich warstwach (TLC)
3
, najczęściej żelu krzemionkowego, w celu roz-
dzielenia złożonej mieszaniny na poszczególne klasy lipidów. Obserwowana
czasami tendencja do rozdzielania się lipidów w obrębie danych klas nie wpływa
na rozdział samych klas. W odpowiednich warunkach można rozdzielić węglo-
wodory, alkohole, aldehydy i kwasy tłuszczowe, a także frakcjonować poszcze-
gólne typy fosfoglicerydów czy też glikolipidów.
2
LC - Liquid Chromatography, HPLC - High Performance (Pressure) Liquid Chromatography.
3
TLC - Thin Layer Chromatography.

1. Lipidy 22
b) Chromatografia argentacyjna
Chromatografia jest prowadzona na kolumnach lub warstwach żelu krzemionko-
wego impregnowanego solami srebra, najczęściej azotanem srebrowym. Pozwala
ona na rozdzielenie każdej klasy lipidów na grupy związków posiadających tę
samą liczbę i konfigurację wiązań podwójnych. Np. alkohole alifatyczne mogą
być równocześnie rozdzielane na nasycone, jedno-, dwu- i trójnienasycone, a tak-
że na izomery cis i trans nienasycone. Zasada rozdziału polega na niskoenerge-
tycznym kompleksowaniu elektronów π wiązań podwójnych z jonami Ag
+
, które
występuje i jest zrywane podczas normalnego procesu chromatograficznego. Je-
żeli w czasie chromatografii część soli srebra ulega wymywaniu eluentem, nie
powoduje to zaburzeń w samym rozdziale. Sól srebrową obecną we frakcji lipido-
wej po rozdziale można usunąć przez rechromatografię na samym żelu krzemion-
kowym lub przez jej przemycie wodą.
c) Chromatografia faz odwróconych (Reversed Phase, RP)
Jest techniką rozdzielania mieszanin realizowaną przy użyciu różnych nośników,
modyfikowanym parafiną a obecnie najczęściej chemicznie żelu krzemionko-
wym. Modyfikowane chemicznie żele mają przyłączone do reszt silanolowych
(SiOH) alifatyczne łańcuchy węglowodorowe o różnej długości. Wraz z ich zwię-
kszeniem zwiększa się hydrofobowość nośnika. Takie chemicznie modyfikowane
żele mają w nazwie dodatkowe oznaczenie RP od „Reversed Phase". Obecnie
najczęściej stosuje się nośniki typu RP-2, RP-8 oraz RP-18, zwane też ODS (od
„octadecylsilica"). Elucję w tej technice prowadzi się z reguły układami dwu-
składnikowymi, z których jednym jest zawsze woda, np. metanol-woda, acetoni-
tryl-woda, aceton-woda. Technika faz odwróconych umożliwia rozdzielanie
mieszanin związków różniących się długością łańcucha lub też liczbą wiązań
podwójnych. Ponieważ stwierdzono, że w porównaniu do związku nasyconego
jedno wiązanie podwójne wywołuje efekt identyczny, jak skrócenie łańcucha
o dwa atomy węgla, dlatego rozdzielenie mieszanin zawierających homologi róż-
niące się zarówno długością, jak i liczbą wiązań podwójnych jest zwykle niemo-
żliwe. Stosując jednak chromatografię na fazach odwróconych w obecności soli
srebrowych, opisaną powyżej mieszaninę można rozdzielić.
d) Chromatografia jonowymienna
Wykazano, że lipidy niejonowe, obojnacze (zwitterjonowe) i kwaśne mogą być
efektywnie rozdzielane na kolumnach wypełnionych wymieniaczami jonowymi.
Najczęściej stosuje się pochodne celulozy - DEAE-celulozę i CM-celulozę.
e) Chromatografia gazowo-cieczowa
Technika ta umożliwia rozdział składników mieszaniny lipidów po ich przepro-
wadzeniu w lotne pochodne zarówno w zależności od długości łańcucha, jak i od
liczby wiązań podwójnych. Osiąga się również oddzielenie i rozdział związków
o łańcuchach prostych od związków mających łańcuchy rozgałęzione. Często
udaje się nawet rozdział izomerów konformacyjnych.

l 2. Izolacja i analiza lipidów 23
Zasady chromatografii oraz techniki są bardziej szczegółowo opisane np. w książ-
ce Chromatografia i jej zastosowania, A. Berthillier, PWN, Warszawa 1975.
1.2.1. Frakcjonowanie lipidów
metodą chromatografii na CM-celulozie
(wg Comfurius P., Zwaal R. F. A., Biochim. Biophys. Acta 488 (1977) 36-42)
Materiały i odczynniki:
karboksymetyloceluloza drobnoziarnista, forma sodowa (CM-52);
metanol;
chloroform.
Sprzęt:
kolumna szklana np. 2.5 x 30 cm z zaworem teflonowym;
rozdzielacz ze szlifem pasującym do wlotu kolumny;
zlewki do zbierania frakcji;
(azot w butli).
Przygotowanie kolumny:
Zregenerowaną i napęczniałą celulozę zawiesić w metanolu i dekantować kilka-
krotnie dla usunięcia bardzo drobnych włókien. Na dnie kolumny umieścić korek
z waty szklanej i wypełnić kolumnę w 1/3 metanolem. Wymieszać dokładnie
celulozę tak, by uzyskać jednorodną zawiesinę. Część zawiesiny (ok. 1/4) wlać do
kolumny uważając, by nie wprowadzić pęcherzyków powietrza. Podłączyć do
kolumny azot o zwiększonym ciśnieniu, tak by nadmiar metanolu został dosyć
szybko przepchnięty przez formujące się złoże. Dodać następną porcję zawiesiny
CM-celulozy i powtórzyć operację. Postępując w ten sposób wypełnić kolumnę
do 2/3-3/4 wysokości złożem. Powierzchnię złoża zabezpieczyć korkiem z waty
szklanej oraz warstwą kulek szklanych (ok. 1-2 cm grubości) dla ochrony przed
uszkodzeniem celulozy w czasie nanoszenia próbek oraz zmiany rozpuszczalni-
ków. Kolumnę przechowywać dbając o zachowanie warstwy rozpuszczalnika nad
powierzchnią złoża.
Rozdział mieszaniny lipidów:
Przed naniesieniem próbki metanol z kolumny należy wymyć przez jej przemycie
10 obj. (tu: l obj. kolumny jest równa objętości zajętej przez przygotowane złoże)
chloroformu. Próbkę lipidów w roztworze chloroformowym o stężeniu do 50
mg/ml nanieść na kolumnę pamiętając, by nie przeładować kolumny (maksymal-
na pojemność złoża - 5 mg lipidu na l ml objętości złoża). Po naniesieniu próbki
i przemyciu ścianek kolumny lipidy eluuje się z szybkością do 250 ml/godz,
(można pomagać sobie ciśnieniem azotu) podanymi w Tabeli l roztworami meta-
nolu w chloroformie.

% metanolu w chloroformie
0-2
3
4
5
9
12.5
14-15
19-20
23
30-35
50
100, a następnie 0 (po 10 obj.)
eluowany lipid
wolne kwasy tłuszczowe, cholesterol,
pigmenty, glicerydy
dwufosfatydyloglicerol
fosfatydylocholina
sfingomielina, monogalaktodwuglicerol
fosfatydyloetanolamina
kwas fosfatydowy
dwugalaktodwuglicerol
fosfatydyloglicerol
lizofosfatydylocholina
fosfatydyloseryna
fosfatydyloinozytol
regeneracja
1. Lipidy 24
Tabela 1. Schemat elucji klas lipidowych z CM-celulozy
Po elucji 5 obj. każdej mieszaniny skontrolować eluent na obecność danego
lipidu. Jeżeli będzie jeszcze obecny, to należy kontynuować elucję jeszcze 2 obj.
tego samego układu. Eluent zbierać we frakcjach o wielkości równej l obj. kolumny.
Zatrzymanie elucji na noc nie wpływa na jakość rozdziału. Frakcje analizować na
zawartość lipidów w chromatografii cienkowarstwowej na żelu krzemionkowym
w dowolnym układzie, np. chloroform/metanol/kwas octowy/woda (60:50:1:4). Fra-
kcje zawierające czyste lipidy połączyć i odparować w wyparce próżniowej. Lipidy
rozpuścić w określonej ilości chloroformu i przechowywać w -70°C.
Procedurę można przystosować do rozdziału 1g próbek mieszaniny lipidów.
1.2.2. Rozdział fosfolipidów w wysokociśnieniowej
chromatografii cieczowej (HPLC)
(wg Shefiq-ur-Rehman, J. Chromatogr. 567 (1991) 29-37)
Materiały i odczynniki:
ekstrakt lipidów z materiału biologicznego;
acetonitryl (HPLC-grade);
metanol (HPLC-grade);
kwas o-fosforowy 85%;
n-heksan;
izopropanol;
(standardy fosfolipidów - PC, PE, PS, SM).
Sprzęt:
chromatograf cieczowy wraz z detektorem UV;
kolumna 250 x 4.6 mm wypełniona żelem krzemionkowym;
podstawowe szkło laboratoryjne.

l 2. Izolacja i analiza lipidów 25
Postępowanie:
• Przygotować układ elucyjny - acetonitryl/metanol/kwas fosforowy (100:10:1.8)
i odgazować go przy użyciu pompy próżniowej.
• Zrównoważyć kolumnę przez przepompowanie przez nią przez 30 min układu
przy przepływie 1.5 ml/min. Detektor ustawić na 203 nm.
• Znaną ilość ekstraktu przenieść do probówki i odparować rozpuszczalnik
w strumieniu azotu. Suchą pozostałość rozpuścić w mieszaninie heksanu
z izopropanolem (3:1), tak by stężenie lipidów było równe ich stężeniu w ory-
ginalnym ekstrakcie.
• Za pomocą mikrostrzykawki wprowadzić 50 μl próbki do systemu nastrzyko-
wego a następnie na kolumnę, zaznaczyć punkt wstrzyknięcia na papierze
rejestratora.
• Rozdział prowadzić do chwili wymycia wszystkich frakcji (około 15 min).
Orientacyjne czasy retencji wynoszą:
PS - 3 min; PE - 4 min; PC - 6 min; SM - 8 min.
Alternatywnie można użyć innych układów:
a) acetonitryl/metanol/kwas fosforowy (100:40:0.8) - rozdział trwa około 30
min,
b) acetonitryl/metanol/kwas siarkowy (100:3:0.05) - rozdział przy przepły-
wie l ml/min trwa około 50 min.
Stosując metodę triangulacyjną obliczyć powierzchnie szczytów, a następnie
procentową zawartość poszczególnych lipidów w analizowanym ekstrakcie.
1.2.3. Analiza fosfolipidów
w chromatografii cienkowarstwowej
(wg Higgins J. A., w: Biological membranes - a practical approach (red. Findlay J. B. C.,
Evans W. H.), IRL Press, Oxford 1987, s. 103-137)
Materiały i odczynniki:
ekstrakt lipidów;
płytki do TLC powleczone żelem krzemionkowym;
chloroform;
metanol;
kwas octowy;
kryształki jodu (w pojemniku).
Sprzęt:
komora chromatograficzna;
mikrokapilary do nanoszenia próbek;
suszarka.

1. Lipidy 26
Postępowanie:
• W odległości 20 mm od jednego z brzegów płytki delikatnie zaznaczyć ołów-
kiem linię startową, na której będą nanoszone próbki.
• Badaną mieszaninę lipidów (150-300 μg) nanieść na linii startowej w postaci
kreski o długości l0 mm (uzyskuje się ją nanosząc małe plamki jedna obok
drugiej); podobnie nanieść standardy lipidów. Plamki wysuszyć strumieniem
powietrza.
• Komorę chromatograficzną wyłożyć po bokach arkuszami bibuły i umieścić
w niej około 150 ml układu rozwijającego - chloroform/metanol/kwas octo-
wy/woda (60:50:1:4). Przykryć komorę i pozostawić na 30 min w celu wysy-
cenia parami rozpuszczalników.
• Włożyć płytkę z naniesionymi próbkami i rozwijać do czasu dojścia frontu
rozpuszczalnika na odległość 10-15 mm od górnej jej krawędzi.
• Wyjąć i wysuszyć płytkę strumieniem powietrza pod digestorium(!).
• Wywołać chromatogram przez jego umieszczenie w pojemniku z jodem lub
przy użyciu wybranych z podanych w dalszej części układów detekcyjnych
(zob. s. 44 i następne).
• Jeśli do wywoływania chromatogramu używano jodu, plamy lipidów obryso-
wać miękkim ołówkiem bezpośrednio po wyjęciu płytki z pojemnika.
1.2.4. Oznaczanie fosforu w rozdzielonych
w TLC frakcjach fosfolipidowych
(wg Rouser G., Siakotos A. N., Fleischer S., Lipids l (1966) 85-86)
Roztwory:
70% kwas nadchlorowy;
2.5% roztwór molibdenianu amonowego;
10% roztwór kwasu askorbinowego (na świeżo!).
Sprzęt:
probówki pyreksowe;
kulki szklane;
pipety;
łaźnia do spalań;
wirówka stołowa;
spektrokolorymetr z kuwetami szklanymi;
mikrowytrząsarka.
Postępowanie:
• Odbarwić chromatogram przez umieszczenie płytki w strumieniu ciepłego
powietrza (pracować pod wyciągiem!).
• Z każdej z obrysowanych na chromatogramie plam fosfolipidowych wydra-

1.2. Izolacja i analiza lipidów 27
pać żel i przenieść do oddzielnych, opisanych probówek.
Wykonanie - warstewkę żelu otaczającą plamę zdrapać za pomocą żyletki
i odrzucić. Następnie żel plamy zdrapać dokładnie i ostrożnie na kawałek
papieru do ważenia i przenieść ilościowo do odpowiedniej probówki. Dla
uzyskania „ślepych" w odpowiednich probówkach umieścić podobne co
w plamie ilości żelu, lecz zdrapane z miejsc nie barwiących się jodem.
• Do każdej probówki dodać (zachować ostrożność! ) po 0.3 ml kwasu nad-
chlorowego, przykryć je kulkami szklanymi, umieścić w bloku grzejnym
i spalić materiał organiczny przez ogrzewanie w 180°C przez 45 min. Po tym
czasie wyjąć probówki i pozostawić do ostygnięcia do temperatury pokojowej.
• Do każdej probówki dodać po l .4 ml wody destylowanej, wymieszać zawartość.
• Dodać po 0.2 ml roztworu molibdenianu, wymieszać.
• Dodać po 0.2 ml roztworu kwasu askorbinowego i ponownie całość wymie-
szać na mikrowytrząsarce.
• Przykryć probówki kulkami szklanymi i umieścić we wrzącej łaźni wodnej na
5
min.
• Wyjąć probówki i ochłodzić w strumieniu zimnej wody.
• Oddzielić żel krzemionkowy przez sączenie bądź przez wirowanie (5 min przy
2000 obr. /min).
• Absorbancję supernatantów zmierzyć w mikrokuwetach szklanych przy 797
nm wobec odpowiednich prób ślepych.
Każda z klas fosfolipidów obecnych w ekstraktach zawiera tylko jedną grupę
fosforanową. Zależność pomiędzy ilością fosforanu i absorbancją jest liniowa do
ok. 1.0 A.
1.2.5. Analiza lipidów roślinnych
w chromatografii cienkowarstwowej
(wg Fisher W., w: Handbook of chromatography (red. Mangold H. K.) CRC Press, Boca
Raton, 1984, Vol. I s. 555-587)
Materiały i odczynniki:
ekstrakt lipidów roślinnych;
płytki do TLC powleczone żelem krzemionkowym, HPTLC firmy Merck;
chloroform;
metanol;
aceton;
kwas octowy;
kryształki jodu (w pojemniku).
Sprzęt:
komora chromatograficzna;
mikrokapilary do nanoszenia próbek;
suszarka.
1. Lipidy _28
Postępowanie:
• W odległości 15 mm od jednego z brzegów płytki delikatnie zaznaczyć ołów-
kiem linię startową, na której będą nanoszone próbki.
• Badaną mieszaninę lipidów (150-300 μg) nanieść na linii startowej w postaci
kreski o długości l0 mm (uzyskuje się ją nanosząc małe plamki jedna obok
drugiej); podobnie nanieść standardy lipidów. Plamki wysuszyć strumieniem
powietrza.
• Komorę chromatograficzną wyłożyć po bokach arkuszami bibuły i umieścić
w niej około 50 ml układu rozwijającego - chloroform/aceton/metanol/kwas
octowy/woda (50:20:10:10:5). Przykryć komorę i pozostawić na 30 min w ce-
lu wysycenia parami rozpuszczalników.
• Włożyć płytkę z naniesionymi próbkami i rozwijać do czasu dojścia frontu
rozpuszczalnika na odległość 2-5 mm od górnej jej krawędzi.
• Wyjąć i wysuszyć płytkę strumieniem powietrza pod digestorium(!).
• Wywołać chromatogram przez jego umieszczenie w pojemniku z jodem lub
przy użyciu wybranych z podanych w dalszej części układów detekcyjnych.
• Jeśli do wywoływania plam użyto jodu, plamki zaraz po wyjęciu płytki z poje-
mnika obrysować miękkim ołówkiem.
• Usunąć jod z płytki przez nadmuch ciepłym powietrzem (wyciąg!) i spryskać
odczynnikiem wywołującym na glikolipidy.
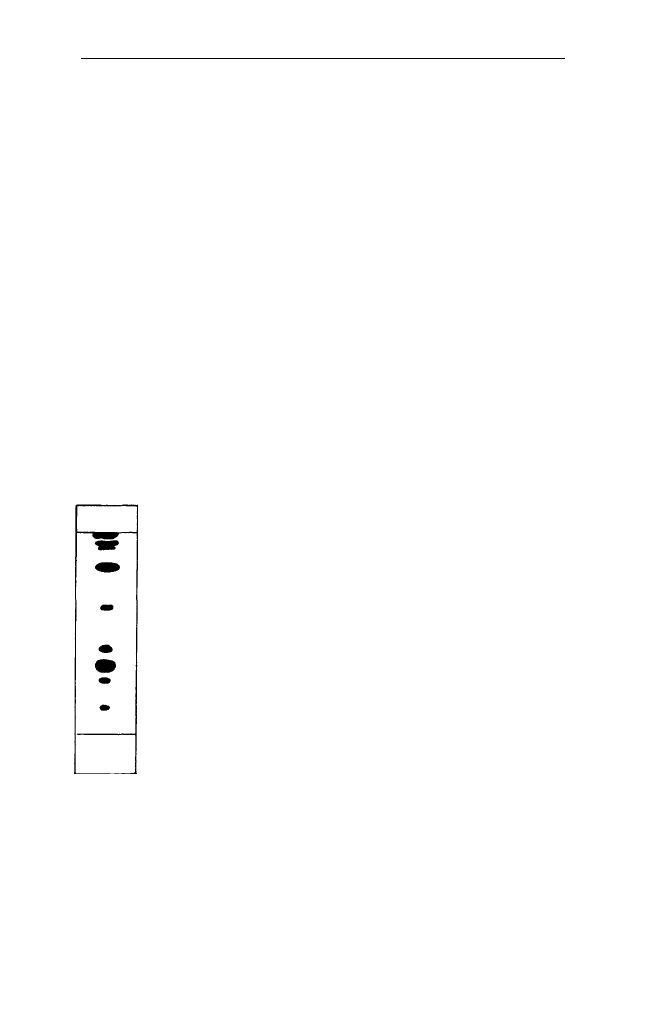
• Zidentyfikować poszczególne lipidy posługując się schematem (rys. 1).
FRONT
BARWNIKI
MGDG
PG
DGDG
SQOC
PC
Pl
START
Rys. 1. Schemat rozdziału lipidów roślinnych w chromatografii
cienkowarstwowej na żelu krzemionkowym
MGDG - monogalaktodwugliceryd, PG - fosfatydyloglicero1.
DGDG - digalaktodwugliceryd, SQDG - sulfolipid,
PC -fosfatydylocholina, PI - fosfatydyloinozytol
1.2.6. Izolacja i oczyszczanie lecytyny jajecznej
(wg Van Deenen L. L. M., de Haas G. H„ Adv. Lipid Res. 2 (1964) 168-229)
Materiały i odczynniki:
20 jajek kurzych;
aceton techniczny l x destylowany;

1.2. Izolacja i analiza lipidów 29
metanol cz.d.a. l x destylowany;
chloroform techniczny 2 x destylowany;
amoniak stężony;
woda destylowana.
Sprzęt:
sączek ze spiekiem G4;
kolba ssawkowa;
mieszadło mechaniczne;
wyparka próżniowa;
kolumna szklana (30 x 500 mm) na szlifach i z zaworem teflonowym wypełniona
żelem krzemionkowym Si60, 40-60 μm, np. firmy Baker.
Postępowanie:
• Oddzielić dokładnie żółtka od białek.
• Wymyć z żółtek lipidy obojętne przez ekstrakcję za pomocą 500 ml acetonu
przy mieszaniu mechanicznym przez kilka minut; przesączyć przez sączek
G4.
• Uzyskany osad przemyć jeszcze co najmniej 6-krotnie porcjami 500 ml aceto-
nu do chwili uzyskania bezbarwnego przesączu.
Uwaga:
1. Ze względu na obecność lecytyn nienasyconych procedura powinna być
prowadzona w atmosferze azotu.
2. Kluczową sprawą jest uzyskanie po przemyciu naprawdę bezbarwnego
przesączu, inaczej można mieć problemy w dalszych etapach oczyszczania.
• Z zebranego z sączka białego osadu ekstrahować trzykrotnie fosfolipidy po-
rcjami 500 ml mieszaniny chloroformu z metanolem (1: 1).
• Ekstrakty połączyć i jeszcze raz przesączyć.
• Odparować rozpuszczalniki w wyparce próżniowej (maks. 35°C).
• Uzyskaną masę fosfolipidów rozpuścić w małej objętości chloroformu.
• Roztwór fosfolipidów nanieść na zrównoważoną w chloroformie kolumnę
i eluować chloroformem do wymycia całości barwnego materiału. Lecytynę
wymyć za pomocą układu chloroform/metanol/ amoniak/woda (68:28:2:2).
Zbierać frakcje 50 ml.
• Obecność i czystość lecytyny we frakcjach sprawdzić przy użyciu TLC.
• Frakcje zawierające czystą lecytynę połączyć i odparować w wyparce. Lecy-
tynę rozpuścić w małej ilości chloroformu i oznaczyć jej zawartość poprzez
oznaczenie fosforu.
Uwaga:
Jeżeli uzyskana lecytyna nie jest dostatecznie czysta, należy powtórzyć chro-
matografię kolumnową lub zastosować HPLC.
• Kolumnę zregenerować metanolem i ponownie zrównoważyć w chlorofor-
mie. Orientacyjna wydajność - 1g PC o czystości > 95%/l żółtko.

1. Lipidy 30
1.2.7. Izolacja monogalakto-
i dwugalaktodwuglicerydów z całkowitych
lipidów roślinnych
(wg van't Hof R., van Klompenburg W., Pilon M., Kozubek A., de Korte-Kool G., Demel
R. A., Weisbeek P. J., de Kruijff B., J. Biol. Chem. 268 (1993) 4037-4042)
Materiały i odczynniki:
kolumna chromatograficzna wypełniona żelem krzemionkowym firmy Baker za-
wieszonym w mieszaninie chloroformu z acetonem (1:1);
chloroform;
metanol;
aceton.
Sprzęt:
naczynia do zbierania frakcji;
płytki HPTLC do chromatografii cienkowarstwowej;
komora do chromatografii cienkowarstwowej;
kolby do wyparki;
wyparka próżniowa;
pojemnik z jodem.
Postępowanie:
• Kolumnę przemyć 200 ml mieszaniny chloroform/aceton (1:1).
• Lipidy roślinne (około 50 mg) rozpuszczone w l ml chloroformu nanieść na
szczyt złoża i rozpocząć elucję tym samym układem z szybkością 3 ml/min.
Eluować używając rozpuszczalnika w ilości co najmniej 10 obj. kolumny.
• Eluat zbierać do jednego naczynia do chwili wypłynięcia drugiego bladozie-
lonego pasma, następnie zebrać kilka małych (20-30 ml) frakcji, tak by mieć
pewność, że pigmenty są całkowicie oddzielone od interesujących nas lipi-
dów, które (monogalaktodwuglicerydy) eluują się zaraz po pigmentach.
• Następnie elucję prowadzić kolejno: 10 obj. acetonu i 10 obj. mieszaniny
chloroform/metanol (9:1) zbierając frakcje 50-100 ml. Dwugalaktodwugli-
cerydy eluują się obu układami.
• Resztę lipidów eluować z kolumny 4 obj. mieszaniny chloroformu z metano-
lem (1:1).
• Odparować rozpuszczalniki z zebranych frakcji i po ich rozpuszczeniu w ma-
łej ilości chloroformu zanalizować w chromatografii cienkowarstwowej.
• Frakcje zawierające czyste MGDG i DGDG połączyć i umieścić w -70
0
C .

1.2. Izolacja i analiza lipidów 31
1.2.8. Izolacja lipidów fenolowych
(5-n-alk(en)ylorezorcynoli) z ziaren żyta
(wg Kozubek A., Acta Aliment. Polon. 9 (1985) 185-198)
Lipidy rezorcynolowe są grupą związków lipidowych będących długołańcucho-
wymi pochodnymi l,3-dwuhydroksy-5-alk(en)ylo-benzenu, są więc homologami
orcyny. Lipidy rezorcynolowe występują w materiałach roślinnych, w tym
w ziarniakach Gramineae oraz w przetrwalnikach (cystach) bakterii glebowych,
takich jak Azotobacter i Micrococcus. Biologiczna rola tych związków nie jest
jeszcze poznana, chociaż wiele wskazuje na możliwość ich uczestnictwa w regula-
cji biosyntezy innych lipidów oraz w mechanizmach obronnych. Charakterysty-
czną cechą lipidów rezorcynolowych ziaren zbóż jest fakt występowania w nich
szerokiego spektrum homologów. Wykazano homologi nasycone, jednonienasy-
cone, a także dwunienasycone. W każdej z tych grup występują z kolei homologi
posiadające nieparzystą liczbę atomów węgla w łańcuchach alifatycznych -
w ziarnach żyta od Cl3 do C27. Na przykładzie tych związków można prześle-
dzić strategię stosowaną do uzyskania określonego pojedynczego związku lipidowego.
Materiały i odczynniki:
ziarna żyta;
bibuła;
aceton;
heksan;
acetonitryl.
Sprzęt:
dużej objętości butla lub erlenmajerka;
kolba do wyparki;
rozdzielacz;
wyparka próżniowa;
wirówka, np. K-70.
Postępowanie:
• Umieścić ziarna żyta w naczyniu i zalać równą objętością acetonu.
• Zabezpieczyć przed parowaniem rozpuszczalnika i pozostawić na 24 godziny.
• Ekstrakt przesączyć przez sączek fałdowany z bibuły, a pozostałość ekstraho-
wać ponownie równą objętością acetonu.
• Połączyć ekstrakty i odparować z nich aceton w wyparce.
• Otrzymaną po odparowaniu acetonu pozostałość (tzw. olej acetonowy) rozpu-
ścić w heksanie w temperaturze około 50°C. Roztwór umieścić w zamrażarce
na kilka godzin.
• Wytrącony osad oddzielić od supernatantu przez wirowanie na zimno
w szklanych probówkach (około 3000 obr/min przez 20 min).

1. Lipidy 32
Supernatant zachować, a osad ponownie rozpuścić w heksanie, wymrozić
i odwirować.
Uzyskany po tym wirowaniu osad zawiera w większości homologi nasycone,
należy go zebrać i po wysuszeniu zachować.
Supernatanty heksanowe połączyć i odparować z nich heksan - uzyskany tzw.
olej heksanowy zawiera głównie homologi nienasycone.
Dla ich oczyszczenia olej heksanowy rozpuścić w 180 ml heksanu, umieścić
w rozdzielaczu, dodać 150 ml acetonitrylu (trucizna!) i wytrząsać całość
przez 10 min; odstawić do rozdzielenia faz.
Zebrać fazę dolną, a górną wytrząsać ponownie ze 150 ml acetonitrylu; po
rozdzieleniu faz zebrać fazę dolną i połączyć ją z poprzednio uzyskaną.
Z połączonych faz odparować acetonitryl w wyparce próżniowej - uzyska się
kilka mililitrów gęstej cieczy zawierającej mieszaninę nasyconych i nienasy-
conych homologów 5-n-alkilorezorcynolu; przechować ją w -20°C.
1.2.9. Chromatografia cienkowarstwowa
lipidów rezorcynolowych
(wg Mejbaum-Katzenellenbogen W., Tłuścik F., Kozubek A., Acta Soc. Bot. Polon. 47
(1978) 379-389)
Materiały, odczynniki i roztwory:
płytki do chromatografii cienkowarstwowej powleczone żelem krzemionkowym
Si 60;
chloroform;
aceton;
0.1% Fast Red B w 0.05 M HCl.
Sprzęt:
komory do chromatografii cienkowarstwowej;
kuweta do wywoływania chromatogramów;
suszarka;
kapilary do nanoszenia próbek.
Postępowanie:
• Na płytki o wymiarach 10 x 10 cm pokryte żelem krzemionkowym Si 60
nanieść w odległości 15 mm od dolnej krawędzi 10-50 μl ekstraktów zawiera-
jących lipidy rezorcynolowe.
• Po wysuszeniu plamek strumieniem powietrza rozwijać w układzie chloro-
form/aceton 95:5 do chwili osiągnięcia przez front rozpuszczalnika górnej
krawędzi płytki.
• Wysuszyć płytkę i plamy rozdzielonych frakcji wywołać przez spryskanie lub
zanurzenie jej w roztworze Fast Red B lub Fast Blue B.

1.2. Izolacja i analiza lipidów 33
Lipidy rezorcynolowe wykazują swoistą fioletowoczerwoną barwę oraz war-
tości R
f
ok. 0.2.
1.2.10. Oznaczanie składu
nasyconych i nienasyconych homologów
lipidów rezorcynolowych
w cienkowarstwowej chromatografu argentacyjnej
(wg Kaczmarek J., Tłuścik F., Genet. Polon. 25 (1984) 349-358)
Materiały, odczynniki i roztwory:
płytki do chromatografii cienkowarstwowej powleczone żelem krzemionkowym
Si 60;
chloroform;
aceton;
0.1% Fast Red B w 0.05 M HCl;
20% azotan srebrowy w 75% metanolu.
Sprzęt:
komory do chromatografii cienkowarstwowej;
kuweta do wywoływania chromatogramów;
suszarka;
kapilary do nanoszenia próbek.
Postępowanie:
• Płytki impregnować przez zanurzenie na 20-30 min w roztworze azotanu
srebrowego.
• Odsączyć z nadmiaru roztworu i wysuszyć w 105°C przez 15 min.
• Analizowane próbki (10-50 μl) nanieść w odległości 15 mm od dolnej krawę-
dzi płytki i po odparowaniu rozpuszczalnika suszarką chromatogram rozwijać
w układzie chloroform/aceton (95:5) do chwili osiągnięcia przez front układu
górnej krawędzi płytki.
• Po wysuszeniu chromatogramy przemyć 3 x po 15 min w 300 ml wody desty-
lowanej.
• Przemyte płytki zanurzyć na 20 min w roztworze Fast Red B.
• Nadmiar barwnika odmyć przez płukanie płytki 3 x w 200 ml 0.05 M HCl.
• Żel z wybarwionych pasm wydrapać z wilgotnych płytek i umieścić w pro-
bówkach.
• Barwnik ekstrahować 6 ml acetonu (30 min ekstrakcji) i po oddzieleniu
ekstraktów od żelu (sączenie lub wirowanie) określić ich absorbancję przy
470 nm. Próbę odnośnikową przygotować przez ekstrakcję żelu zdrapanego
z miejsc nie wybarwionych.

1. Lipidy 34
Poczynając od frontu rozpuszczalnika kolejność migracji homologów jest
następująca: nasycone, jednonienasycone i dwunienasycone.
Obliczenia: Procentową zawartość nasyconych i nienasyconych homologów
obliczyć w oparciu o sumę absorbancji oznaczanych frakcji.
1.2.11. Oznaczanie składu homologów
lipidów rezorcynolowych pod względem długości
łańcucha alifatycznego w chromatografii
cienkowarstwowej na tlenku glinu
(wg Tłuścik F., Kozubek A., Chem. Anal. 29 (1984) 79-84)
Materiały, odczynniki i roztwory:
płytki do chromatografii cienkowarstwowej powleczone tlenkiem glinu (Merck
5581);
metanol;
0.1% Fast Red B w 0.05 M HCl.
Sprzęt:
komory do chromatografii cienkowarstwowej;
kuweta do wywoływania chromatogramów;
suszarka;
kapilary do nanoszenia próbek.
Postępowanie:
• Próbki nanosić na płytki (5 x 20 cm) w postaci kresek długości l cm w odle-
głości 15-20 mm od dolnej ich krawędzi.
• Po odparowaniu rozpuszczalnika rozwijać na drodze 12-15 cm w układzie
metanol-12% wody. Płytki zanurzać w układzie nie więcej niż na 5 mm.
• Po rozwinięciu płytki wysuszyć i zanurzyć na 30 min w roztworze Fast Red
B.
• Osuszyć wybarwione chromatogramy między bibułą, wydrapać żel z wybar-
wionych pasm i przenieść go do czystych i suchych probówek.
• Barwnik z żelu ekstrahować 6 ml acetonu przez 30 min wstrząsając probówki
od czasu do czasu.
• Żel oddzielić przez sączenie lub wirowanie.
• Określić absorbancje ekstraktów przy 470 nm. Jako próby odnośnikowej użyć
ekstraktu z żelu wydrapanego z miejsc nie wybarwionych.
Dla pewnej identyfikacji homologów wraz z próbą badaną rozdzielać standard
pentadecylorezorcynolu (Cl5-AR). Ruchliwość homologów zmniejsza się wraz
ze wzrostem długości ich łańcucha alifatycznego.
Obliczenia: Procentową zawartość poszczególnych homologów obliczyć na pod-
stawie sumy absorbancji oznaczanych frakcji.

1.2. Izolacja i analiza lipidów 35
1.2.12. Oczyszczanie lipidów rezorcynolowych oraz
izolacja poszczególnych ich homologów
(wg Kozubek A., Acta Aliment. Polon. 9 (1985) 185-198)
Materiały i odczynniki:
żel krzemionkowy do chromatografii kolumnowej;
kolumna do chromatografii argentacyjnej w HPLC;
kolumna do chromatografii na odwróconych fazach (RP-18) w HPLC;
paski folii pokryte żelem krzemionkowym do chromatografii cienkowarstwowej;
nadchloran srebrowy;
Fast Blue B;
chloroform;
metanol;
aceton.
Sprzęt:
kolumna szklana do chromatografii;
chromatograf cieczowy preparatywny z kolumnami;
kolby do wyparki;
wyparka próżniowa.
Postępowanie:
• Kolumnę szklaną wypełnić zawieszonym w mieszaninie chloroformu z aceto-
nem (95:5) żelem krzemionkowym.
• Na szczyt złoża nanieść preparat lipidów rezorcynolowych rozpuszczony
w 2-4 ml chloroformu; eluować kolumnę tym samym układem.
• Początkowo zbierać frakcje do jednego dużego naczynia kontrolując wyciek
z kolumny testem kroplowym na obecność lipidów rezorcynolowych - na
pasek folii pokryty żelem krzemionkowym nanosić po kropli eluatu, wysuszyć
i pokryć kroplą 0.05% wodnego roztworu Fast Blue B; fioletowoniebieskie
zabarwienie wskazuje na ich obecność. Od tej chwili zbierać eluat do oddziel-
nego naczynia. Zakończyć zbieranie, gdy test kroplowy nie wykaże już obe-
cności lipidów rezorcynolowych.
• Frakcję zawierającą lipidy rezorcynolowe odparować na wyparce.
• Zbadać czystość preparatu w chromatografii cienkowarstwowej (zob. poniżej).
• W celu rozdzielenia i uzyskania homologów różniących się stopniem nasyce-
nia łańcuchów bocznych uzyskany preparat należy rozdzielić w chromatogra-
fii argentacyjnej. W tym celu 200 μl roztworu uzyskanych w poprzednich
etapach preparatu
należy wstrzyknąć na kolumnę HPLC impregnowaną nad-
chloranem srebrowym i rozdzielić w układzie chloroform/metanol (95:5) za-
wierającym 20 mmoli/l AgClO
4
. Proces rozdziału śledzić za pomocą detektora
UV przy 280 nm.
• Frakcje wypływające z kolumny zbierać do oddzielnych naczyń.
Wyszukiwarka
Podobne podstrony:
BMiGO Wykład 1 DNA izolacja i analiza
Protokó- izolacji DNA na -wiczenia (1), analiza DNA
analiza złożonych aktów ruchowych w sytuacjach patologicznych
Prezentacja 2 analiza akcji zadania dla studentow
Wypadkoznawstwo analiza wypadków
Zarz[1] finan przeds 11 analiza wskaz
Analiza czynnikowa II
4 ANALIZA WSKAŹNIKOWA Rachunkowość
analiza finansowa ppt
Analiza rys w twarzy
Analiza rynku konsumentów
Analiza
ANALIZA KOSZTU BIOLOGICZNEGO WYKONYWANEJ PRACY
Analiza genetyczna w medycynie sądowej
więcej podobnych podstron